水稻土壤宏基因组中的β-葡萄糖苷酶基因克隆、表达及酶活的研究
贺 俐,吴杨
水稻土壤宏基因组中的β-葡萄糖苷酶基因克隆、表达及酶活的研究
贺 俐,*吴杨
(井冈山大学生命科学学院,江西,吉安 343009)
β-葡萄糖苷酶(Ec3.2.1.21)属于糖苷水解酶家族3,它能够水解非还原性末端的β-D葡萄糖苷键,释放出游离的葡萄糖及相应的配基。β-葡萄糖苷酶是纤维素降解中的关键酶,对于可再生资源纤维素的利用具有十分重要的意义。本研究从水稻土壤中分离得到β-葡萄糖苷酶基因pds5,将其克隆到表达载体pET32a(+)中,转化BL21大肠杆菌中,并诱导表达该基因。重组BL21大肠杆菌用IPTG诱导后,所提取的酶蛋白具有β-葡萄糖苷酶的活性,经SDS-PAGE 分析,确定其相对分子质量为83 kD。通过控制pH和温度的方法,测得该酶酶活最适pH为7.0,最适温度为37.5℃。
β-葡萄糖苷酶;克隆;酶活
β-半乳糖苷酶(EC3.2.1.23),又称乳糖酶,广泛存在于各种微生物、植物及动物组织中。该酶能够水解乳糖中的β-1,4-D-半乳糖苷键,使其降解成为半乳糖与葡萄糖,同时具有半乳糖苷的转移作用[1]。β-半乳糖苷酶可用于降解乳糖和生产低聚半乳糖,合成或修饰其它碳水化合物以及促进果蔬软化和成熟,同时在免疫、检测及疾病诊断方面也有应用。随着生物技术的发展,对编码此酶的基因结构有了相当了解,人们也获得了具有优良特性酶活性较高的β-半乳糖苷酶,使得β-半乳糖苷酶不仅在食品工业中的用途越来越广泛,而且在生物技术领域中也发挥着重要的作用,并被广泛应用于医药、化学等领域[2]。目前,工业用β-半乳糖苷酶主要来源于多种微生物如霉菌、细菌、放线菌及酵母菌[3]。本研究利用大肠杆菌表达系统高效表达了从水稻土壤宏基因组研究中发现的β-半乳糖苷酶基因pds5,并进行了相关功能的研究。
1 材料和方法
1.1 主要试剂
分子生物学工具酶、DNA分子量标准及蛋白分子量标准均购自上海生物工程公司;卡那霉素、氨苄青霉素、IPTG、o-硝苯基-β-D-半乳糖购自厦门泰京生物科技有限公司;其他相关试剂盒购自Novagen公司。
1.2 菌株和质粒
大肠杆菌DH5α,BL21(DE3)、pUCl8质粒、pET-30a(+)质粒均为本实验室保藏。
1.3 水稻土壤基因组DNA提取及宏基因组文库的构建
水稻土壤基因组DNA提取根据参考文献[4]进行。粗提后的土壤基因组DNA利用低熔点琼脂糖凝胶电泳检测并纯化。Sau3AI酶切纯化的土壤基因组DNA,蔗糖密度梯度(10%~40%,W/V)离心后收集2 kb以上的DNA片段与BHI酶切回收的pUCl8连接,转化DH5α。收集白色克隆到96孔板,-80℃冻存。随机挑选白色克隆进行酶切验证转化效率。
1.4 基因克隆
将构建的文库影印到含0.1%七叶苷和0.25%柠檬酸高铁铵的LA平板上培养12~15 h后,菌落周围出现黑色水解圈的即为β-葡萄糖苷酶基因阳性克隆,具体参照文献[5]进行。
1.5 重组蛋白的诱导表达和纯化
重组蛋白的诱导表达参照《分子克隆实验指南》(第三版)进行。重组蛋白的纯化按照Rapid Affinity Purification Kit说明书进行。
1.6 酶活性测定及最适pH值和温度
酶活性的测定根据参考文献[6]进行。葡萄糖标准曲线的绘制: 分别吸取10 mg/ mL葡萄糖标准贮备溶液0、0. 2、0. 4、0. 6、0. 8、1.0 mL于试管中,用蒸馏水加至 1 mL,再加1 mLDNS试剂,充分混合后在沸水中煮沸5 min,冷却后用蒸馏水稀释至 10 mL,在540 nm波长处测定其吸光值。
2 结果
2.1 目的基因的克隆与鉴定
按照材料与方法1.3实验室已成功构建土壤宏基因组文库(未发表)。从筛选平板上挑取较黑的阳性克隆,经PCR扩增后产物经1%的琼脂糖凝胶电泳检测与预期片段大小一致,大小为2800 bp左右。双酶切得到与PCR产物大小一致的片段,将该目的基因命名为pds5。PCR产物电泳和重组质粒的酶切分析结果见图1和图2。

M:marker;1-4:随机选取的4个样品进行扩增

M:marker;1-3:不同内切酶组合的酶切效果
2.2 目的蛋白的诱导表达
将诱导菌液与未诱导菌液均10000 g离心2 min。倒掉上清,菌液沉淀先用少量 PBS溶液清洗,诱导菌液沉淀中加10 mLPBS溶液,未诱导菌液中加入300 µLPBS溶液吹起,超声破碎5~10 min。破碎后诱导液取全液500 µL用于后面的SDS凝胶电泳,将剩余的全液10000 g离心15 min。全液、上清液、未诱导液各取40 µLSDS凝胶电泳。结果如图3,从图中可以看出β-葡萄糖苷酶分子量大约为83 kD,与预期结果一致,该酶在加了IPTG才能表达,而且经离心后主要留在上清液中。
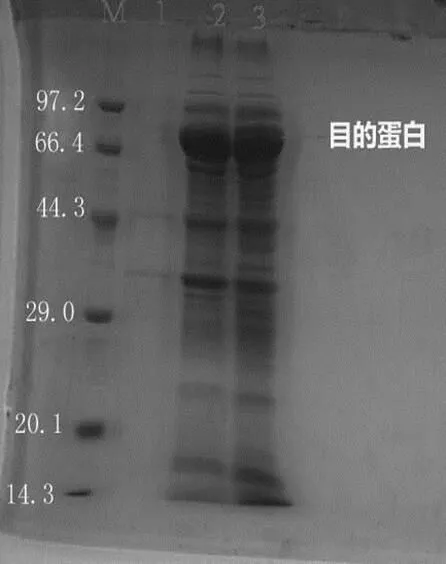
M:marker;1:阴性对照;2-3:目的蛋白
2.3 酶反应的最适pH和最适温度
取稀释10倍后100 µL酶液,700 µLpH2~8.5 磷酸氢二钠-柠檬酸缓冲液,200 µL 20 mg/L水杨苷溶液37 ℃水浴10 min中后加2 mL DNS沸水浴10 min,540 nm测吸光度。结果如图4,可以看出该酶在pH5~8活力较强,最适pH为7.0。取稀释10倍后0.1 m:酶液,700 µLpH 7.0 磷酸氢二钠-柠檬酸缓冲液,200 µL20 mg/L水杨苷溶液25~65 ℃水浴10 min中后加2 mLDNS沸水浴10 min,540 nm测吸光度。结果如图5,该酶在35~55 ℃活力较强,酶活力最适温度50 ℃。
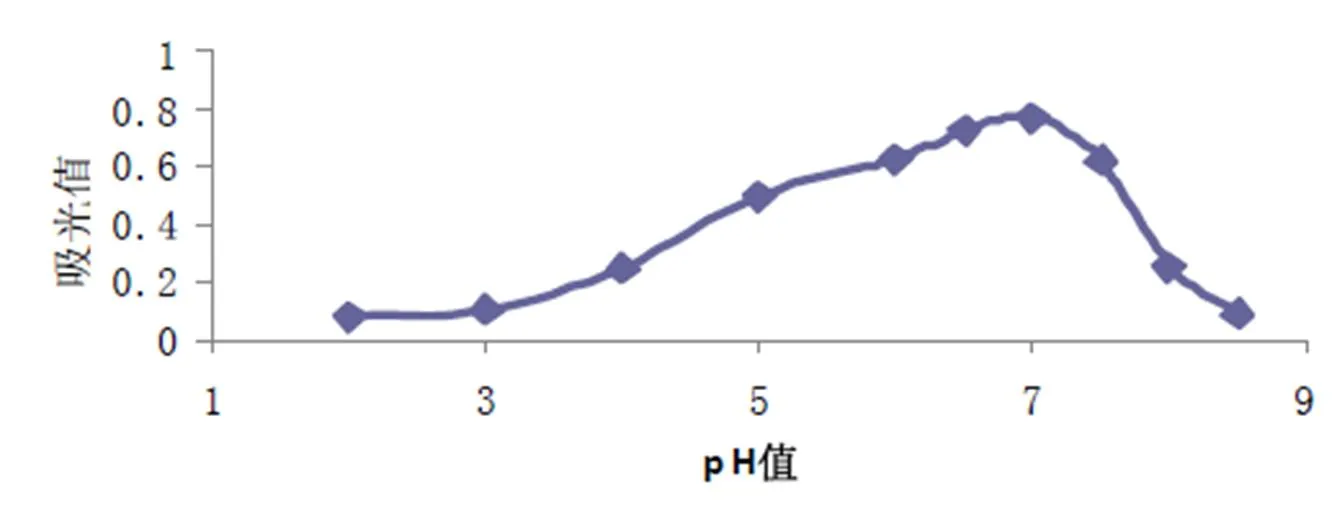
图4 β-葡萄糖苷酶最适pH值

图5 β-葡萄糖苷酶最适温度
2.4 β-葡萄糖苷酶活力的测定
将纯化前后的酶液用葡萄糖为底物进行酶活测定:取稀释一定倍数的酶液100 µL,加入200 µL0.5%的水杨苷(溶解于0.1 mol/ L pH值4.8的醋酸缓冲液中) , 55 ℃保温20 min, 加入 1mLDNS 试剂, 充分混合在沸水中煮沸5 min,冷却后用蒸馏水稀释至10 mL,在540 nm波长处测定其吸光值,以加热灭活的酶液按照同样方法处理作为空白。以加热灭活的酶液按照同样方法处理作为空白。定义每小时由底物产生 1 Lmol 还原糖(以葡萄糖计)所需的酶量为一个酶活单位(U)[7]。标准曲线结果如图6,根据测定的吸光值,经计算未纯化前的酶活力为24.7 U,纯化后的酶活力为256.9 U,降低了10.4倍,酶活性较低。

图6 葡萄糖标准曲线
3 讨论
当前在β半乳-糖苷酶基因的克隆和鉴定方面,国内外的主要方法是从纤维素被活跃降解的环境中分离纯化产酶活性微生物, 对所得的菌株鉴定并对其产酶条件及酶学特性等进行研究后,再进一步用分子生物学的方法对其进行克隆、鉴定和表达。而在自然界中超过99% 的未培养微生物组成了地球上生物多样性的主体[8],所以长期以来微生物的纯培养方法严重地限制了我们认识微生物的视野, 使得微生物的多样性资源难以得到全面的开发和利用。自从1998 年Handelsman 等人提出宏基因组( Metagenome) 的概念以来,宏基因组技术在开发未培养微生物以及功能基因、活性物质等方面应用非常广泛[9]。
本研究利用宏基因组研究方法,避开了传统的微生物纯培养,直接从水稻土壤样品混合微生物中提取基因组DNA,发现了β-半乳-糖苷酶的功能基因pds5,对其进行了克隆与表达研究,并对重组蛋白的功能进行了初步研究。由于该酶来源于土壤微生物,在大肠杆菌原核表达系统中大多以包涵体形式存在,且酶活较低,因此在后续研究中可尝试选择转录型或分泌型pET载体,或者利用信号肽来促进目的基因在大肠杆菌中的表达,或者选择毕赤酵母表达系统来有效提高目的蛋白的表达量及酶活,为其工业化发酵生产建立很好的基础[9]。同时,这些研究对探索土壤中的微生物新资源必将起到积极的作用。
[1] Wanarska M, Kur J, Pladzyk R, et a1.Thermostable pyrococcus woesei beta-D-galactosidase-high level expression,purification and biochemical properties[J]. Acta Biochim Pol, 2005, 52: 78l-787.
[2] 聂洪丽,汤丽霞,张诗海,等.富集培养及高质量DNA提取有利于从土壤宏基因组中获取新卤醇脱卤酶基因[J].生物技术通讯,2010,12(6):846-850.
[3] 高秀容,马力,叶华,等.β-半乳糖苷酶的研究进展[J].生物技术通报,2005(3):18-20.
[4] Zhou J,Brans M A,Tiedje J M.DNA recovery from soils of diverse composition[J].Appl Environ Microbiol,1996,62:316-322,
[5] 陆坚,杜丽琴,庞浩,等. 高糖土壤微生物宏基因组文库的构建及β-葡萄糖苷酶基因鉴定[J].基因组学与应用生物学,2013,32(1):30-35.
[6] Heather F, Seidle, Ira Maarten. Physieal and kinetic properties of the family 3 β-Glueosidase from aspergillusniger which is important for cellulose breakdown[J].The Protein Journal, 2004,23(l):11-23.
[7] JenkinsJ, Leggio L L, Harisq, et al. β-glucosidase,pgalactosidase filmy A cellulase polymyxa s filmy F xylanases and two barley glyeanases from a super family of enzymes with a 8-fold α/β-parehiteeture and with two conserved glutamates near the carboxyterminail ends of β-strands four and seven[J].FFBS Lett, 1995,36(2):281-285.
[8] Amann R I, Ludwig W, Schleifer K H. Phylogenetic identification and in situ detection of individual microbial cells without cultivation[J].Micro biol Rev,1995,59(1): 143-169.
[9] Schmeissor C, Steele H, Streit W R.Metagenomics: biotechnology with non-cuhurable microbes[J].Appl Microbiol Biotechnol, 2007,75(5) : 955- 962.
CLONE, EXPRESSION AND ACTIVITY OFFROM RICE SOIL METAGENOME
HE Li,*WU Yang
(School of Life Sciences, Jinggangshan University, Ji’an, Jiangxi 343009, China)
β-glueosidase (EC3.2.l.21) belongs to glycoside hydrolases superfamily 3, which could hydrolyze β-D-glueosidie bond and release glueose and corresponding aglueone. β-glueosidase is the key enzyme in cellulose degradation. The β-glucosidase gene was cloned into pET32a (+) and then build upon an expression carrier in BL21, and induces the expression of the gene. BL21recombinantinduced by IPTG, the relative molecular mass of the extracted protein with β-glucosidase activity analyzed by SDS-PAGE analysis is 83kD. Through the control of pH and temperature, the optimum pH of the enzyme activity is 7, the optimum temperature is 37.5 ℃.
β-glueosidase; cloning; activity of enzyme
Q785
A
10.3969/j.issn.1674-8085.2014.03.010
1674-8085(2014)03-0042-04
2013-12-21;
2014-04-19
国家自然科学基金项目(31060263);江西省自然科学基金项目(2010GQN0118,20132BAB204011);江西省教育厅科技计划项目(GJJ13543,GJJ13544)
贺 俐(1981-),女,江西吉安人,实验师,硕士,主要从事水稻抗虫研究(E-mail:heli@jgsu.edu.cn)
*吴 杨(1980-),男,江西吉安人,副教授,博士,主要从事逆境分子机制研究(E-mail:wuyangfenghao@sohu.com)

