异氰尿酸三烯丙酯的合成研究进展
张 亨
(锦西化工研究院,辽宁 葫芦岛125000)
0 前言
异氰尿酸三烯丙酯(TAIC)[1-7]及其异构体氰尿酸三烯丙酯(TAC)均为典型的三官能团三嗪类芳香杂环单体。它是一种新型高分子材料助剂,广泛用于热塑性塑料、模塑料、增强塑料、离子交换树脂、特种橡胶的交联剂、改性剂和助硫化剂,以及光固化涂料、光敏抗蚀剂、阻燃剂、农药等的中间体。
TAIC作为过氧化物交联及放射性交联的助交联剂,具有增加网状结构密度的效果,减少过氧化物用量,降低辐照剂量,适用于聚氨酯、丙烯酸酯系列树脂、三元(二元)乙丙橡胶、氯化聚乙烯、氟橡胶、硅橡胶、聚乙烯、聚丙烯、聚氯乙烯、聚苯乙烯、乙烯-醋酸乙烯共聚物等,可提高交联速率,改善制品的耐压缩性、机械强度、耐药品性、耐磨性等,耐热性也可提高到200℃以上。还可作为不饱和聚酯、环氧树脂和聚烯烃的交联剂和共聚单体,以及甲基丙烯酸树脂、聚乙烯、DAP树脂和纸张等的改性剂。
1 理化性质
异氰尿酸三烯丙酯又名三聚异氰酸三烯丙酯、三烯丙基异氰尿酸酯、三烯丙基异三聚氰酸酯等,分子式为C12H15N3O3,相对分子质量为249.27。TAIC为无色、白色或浅黄色结晶或透明液体,熔点24℃,沸点149~152℃(266.6Pa),闪点>110℃,相对密度1.172,折射率1.512。20℃在水中溶解度为0.1g,可溶于庚烷、苯、二甲苯、甲醇、乙醇、丙酮、二恶烷、乙酸乙酯、氯仿等有机溶剂,而微溶于正戊烷、乙二醇等。
TAIC和TAC均聚物性脆,应用较少。TAIC具有交联改性、助硫化、内增塑等功能。TAIC具有异氰尿酸结构,比TAC更稳定。TAC发生Claisen重排异构化得到TAIC和少量聚合物。TAIC卤化制得阻燃剂。
TAIC的毒性[8]比氰尿酸的强。试验证明TAIC毒害神经系统。
2 合成研究
TAIC的合成方法包括氰尿酸三烯丙酯异构化法、(异)氰尿酸和烯丙基卤反应法、(异)氰尿酸和烯丙醇反应法、碱金属(异)氰酸盐和烯丙基卤反应直接三聚法以及异氰酸烯丙酯三聚法等。工业上生产TAIC的主要方法是(异)氰尿酸和烯丙基氯反应法、(异)氰尿酸和烯丙醇反应法、碱金属(异)氰酸盐和烯丙基氯反应直接三聚法。这三种方法原料易得,反应条件易于控制,设备简单,有利于工业化生产。异氰酸烯丙酯一般不作为化工产品出售,由碱金属(异)氰酸盐和烯丙基卤反应直接三聚得到TAIC。氰尿酸三烯丙酯通常在低温(≤15℃)下,三聚氰氯和烯丙醇反应或氰尿酸和烯丙基氯反应制得。若提高反应温度得到异构化产物TAIC。控制反应温度即可调整TAC和TAIC的产品比例。
2.1 氰尿酸三烯丙酯异构化法
在催化剂存在下,加热(低于130℃)氰尿酸三烯丙酯,发生Claisen重排异构化得到更稳定的异氰尿酸三烯丙酯和少量聚合物。
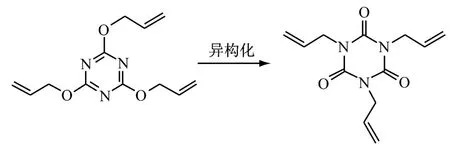
Balitskaya L G等[9]在铜存在下,将氰尿酸三烯丙酯于低温(30~70℃)下加热发生Claisen重排反应,得到异氰尿酸三烯丙酯和少量高聚物。
Klenovich S V等[10-11]在甲苯溶剂中,将氰尿酸三烯丙酯在铜盐催化剂作用下异构化得到异氰尿酸三烯丙酯,真空蒸馏得到产品。反应温度为100~130℃,氰尿酸三烯丙酯、溶剂、还原剂和催化剂的量之比为1∶(1.3~4.1)∶(0.39~0.8)∶(0.001 5~0.007 3)。还原剂选用四氯化锡或氯化亚铁,催化剂可选用氯化铜、醋酸铜、氯化亚铜、硫酸铜、硝酸铜、溴化亚铜、苄基亚铜和CuFe2等。
在铜催化剂(铜盐,如硫酸铜、氯化铜、氯化亚铜及其与叔胺复合物,如硫酸铜-三乙胺、硫酸铜-三甲胺和氯化铜-三甲胺等)存在下,低温(小于90℃)加热,TAC发生 Claisen重排反应[12-15],异构化得到TAIC和少量聚合物。反应可在甲苯溶剂或无溶剂条件下进行,转化率≥99.9%。
2.2 碱金属(异)氰酸盐和烯丙基卤反应直接三聚法[16-17]
碱金属(异)氰酸盐和烯丙基卤在非质子溶剂或水不溶性溶剂中,加热(130℃左右),搅拌反应,蒸馏回收溶剂,再经后处理得到异氰尿酸三烯丙酯。碱金属(异)氰酸盐可能有氰酸盐和异氰酸盐两种,但未曾分离,只有一个CAS登录号,一般为(异)氰酸钠和(异)氰酸钾。(异)氰酸钠价廉,使用得较多。烯丙基卤常用价廉的烯丙基氯,烯丙基溴价格较高。溶剂可选用乙腈、甲氧基丙腈、丙酮、硝基苯、二恶烷、DMF、DMSO、乙酸乙酯等。pH 值调节剂可选用叔胺、吡啶、盐酸吡啶、溴化十六烷基吡啶、氯化三苯甲基吡啶、溴化十六烷基-3,5-二甲基吡啶等。
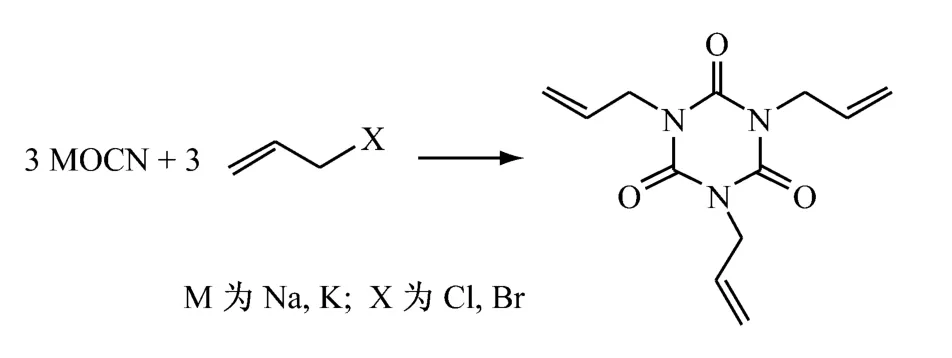
Donald W Kaiser等[18]将86份氰酸钾、80.5份烯丙基氯和391.4份乙腈的混合物,于150℃下搅拌反应3h,制得69份异氰尿酸三烯丙酯。叔胺催化剂的质量分数为0.1%~10.0%。
Kenichi Fukui等[19]将10g氰酸钾溶于300g DMF中,在137℃下滴入1mol烯丙基氯,保温反应0.5h,冷却,滤去无机盐,蒸馏回收DMF,继续蒸馏得到异氰尿酸三烯丙酯,产率为80%。
Kenichi Fukui等[20]在300g DMF中,将10g氰酸钾和1mol烯丙基溴加热至135℃左右,搅拌反应1h,得到异氰尿酸三烯丙酯,产率为90%。
Fumio Tanimoto等[21]在300g DMF中,加入200g氰酸钾,搅拌加热至135℃,2h内滴完190g烯丙基溴,维持135~140℃反应1h,冷却,用200 g无水丙酮处理,放置过夜,得到异氰尿酸三烯丙酯,产率为80%。
Kitano Hisao[22]将200g DMF、200g N,N-二甲基脲、80g异氰酸钠和一定量烯丙基氯的混合物,于130℃下搅拌反应3h,蒸馏回收溶剂,再用水蒸汽蒸馏,得到异氰尿酸三烯丙酯。
Zenner Karl F等[23]在压热器中,将烯丙基氯和氰酸钠在乙腈溶剂中,以及有机胺[三烷基(如甲基或乙基)烯丙基氯化铵或N-甲基吡咯烷]存在下,于95~105℃下加热反应得到异氰尿酸三烯丙酯,产率为90.6%~92.0%,纯度>97.2%。
Nadachi Yoshitaka等[24]在氮气氛中及季铵(鏻)盐催化作用下,将定量的氰酸钾、烯丙基氯和溴化钾在乙酸乙酯中回流反应24h,得到异氰尿酸三烯丙酯。季铵(鏻)盐催化剂可选用苄基三甲基氯化铵、苄基三乙基氯化铵、十六烷基三甲基溴化铵和十六烷基三甲基溴化鏻等。
Tanaka Yoshiaki等[25]将氰酸钠和烯丙基氯在pH值调节剂存在下,于130℃左右加热反应,制得异氰尿酸三烯丙酯。pH值调节剂可选用吡啶、盐酸吡啶、溴化十六烷基吡啶、氯化三苯甲基吡啶、溴化十六烷基-3,5-二甲基吡啶等。
Nakamura Tetsuo等[26]介绍了制备异氰尿酸三烯酯的改进工艺。将氰酸钾和二甲亚砜的混合物加热至130℃,连续加入烯丙基溴反应1.5h后,液面以上温度达120~130℃,蒸馏回收溶剂,向蒸馏残液中加入水,得到异氰尿酸三烯丙酯,产率为95%。从液面上方滴入烯丙基溴,异氰尿酸三烯丙酯的产率为83%。
Sekiguchi Akio等[27]将氰酸钠(含质量分数为5%的碳酸钠)、溴化钾和烯丙基氯溶于DMF中,在130~135℃下搅拌反应3h,蒸馏回收DMF,残液用40℃的温水洗涤30min,分出有机相,然后蒸馏得到异氰尿酸三烯丙酯,产率为92%,纯度为99.1%。
Kitano Hisao等[28]在10mol DMF中,将0.5 mol烯丙基氯、60g氰酸钾、10g硅胶和2~3g盐酸三乙胺的混合物,于140~150℃下加热反应2 h,制得异氰尿酸三烯丙酯,产率为97%。脱水固体酸可选用硅胶、硅酸镁、磷酸铝、沸石、磷酸锌、硅酸锌、硅磷酸锌、稀土金属硅酸盐或磷酸盐、硅酸盐矿物和磷酸盐矿物等。pH值调节剂可选用叔胺或季铵盐。
Kitano Hisao等[29]将1mol烯丙基氯(含质量浓度为30~50mg/L的水)、1.5mol质量分数为91%的氰酸钠(含质量浓度为70~80mg/L的水和质量分数为8.9%的碳酸钠)和0.5g 1,4-二氮双环[2,2,2]辛烷的混合物,溶于 DMF中,在100℃下加热反应5h,得到异氰尿酸三烯丙酯,产率为98%。
Saikawa Shinya等[30]在DMF中,将烯丙基氯缓慢滴入氰酸钠、氯化钙和三乙胺的混合物中,于120℃下反应4h,在120~130℃下保温5h,过滤,用二氯乙烷洗涤滤饼。固体副产物用浓盐酸中和,分离回收二氯乙烷,然后真空蒸馏回收DMF和二氯乙烷。蒸馏残渣再用水洗涤、盐酸中和,真空蒸馏有机相,得到异氰尿酸三烯丙酯,产率为93.5%,纯度为99.5%。
Nagao Fumio等[31]向装有660kg质量分数为90%的氰酸钠、70kg氯化钙、7.4kg溴化钾和1970kg DMF的混合物的反应器中,加入665kg烯丙基氯,于110℃下加热反应6h,于110~125℃下搅拌2h,蒸馏回收DMF;加入40℃的温水1 600L,再加入6mol/L盐酸380kg,调节水溶液pH值为4.5;将含有异氰尿酸三烯丙酯的有机层与820L质量分数为2%的碳酸钾溶液混合;除去水溶液层,有机层用820L质量分数为2%的碳酸钾溶液洗涤,然后蒸馏,得到643kg高纯异氰尿酸三烯丙酯。氯离子的质量浓度为0.17mg/L。
Takayama Yoshihiro等[32-33]在 DMF 中,将氰酸钠和烯丙基氯于140℃下反应2h,得到异氰尿酸三烯丙酯,产率为94%~96%。
杨康[34]根据氰酸钠与氯丙烯(AC)在非质子溶剂中发生取代、环化反应特点,开发出无含盐废水排放、AC单耗低、产品纯度为99.5%的溶剂法的清洁生产工艺技术;并对温度的选定,反应结束后固体物质的脱除、脱DMF、酸碱洗和石油醚处理等进行研究。用低浓度的盐酸溶液洗涤产品的效果优于单独水洗,还省去了用低浓度的碱液洗涤,简化了操作步骤,提高了产品的纯度。氯丙烯滴加管口的放置需接近液面处。放置太远,氯丙烯挥发较大,不利于提高产品产率;若氯丙烯滴加管口进入反应体系,容易造成管口堵塞。氯丙烯的滴加速率应该缓慢。滴加速率太快,造成氯丙烯大量挥发,造成原料的浪费;滴加速率太慢,延长反应时间,降低生产效率。最佳温度为130℃左右。温度太高,产物发生自聚;温度太低,难以达到反应温度,均使产率降低。氯丙烯和氰酸钠的量之最佳配比为1.14。配比过高,浪费原料;配比过低,难以提高产率。水洗能除去大量水溶性副产物。经过酸洗、碱洗和水洗,提高了产品纯度。改进了原合成方法的副产物NaCl分离方法。将水溶解分离NaCl改为从反应物中分离NaCl固体副产物。在不影响TAIC产率下,解决了原工艺路线存在的高浓度含盐废水排放问题。
2.3 (异)氰尿酸和烯丙醇反应法
氰尿酸和异氰尿酸为同分互变异构体,系芳香杂环化合物。固态或溶液状态下,两种异构体同时存在,相互转变,构成热力学平衡态。(异)氰尿酸与活泼的烷基化试剂烯丙醇反应生成更稳定的N-烷基化产物。
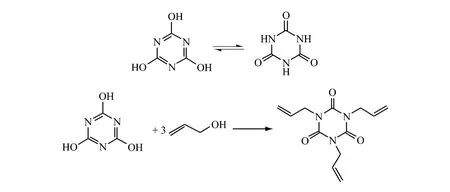
Ishimura Y等[35]在Ph2P(CH2)4PPh2和醋酸钯存在下,将异氰尿酸和烯丙醇于110℃下,在邻二甲苯溶剂中反应得到异氰尿酸三烯丙酯,产率为99.4%。副产物为质量分数为0.4%的异氰尿酸二烯丙酯,无异氰尿酸单烯丙酯产物。
2.4 (异)氰尿酸和烯丙基卤反应法
在缚酸剂存在下,将(异)氰尿酸和烯丙基卤加热反应生成异氰尿酸三烯丙酯。缚酸剂一般选用碳酸钠和氢氧化钠。常用相转移催化剂有季铵盐、聚乙二醇、DMF、二甲亚砜、二甲基砜及高分子交联的季铵盐型催化剂等。(异)氰尿酸和烯丙基卤在缚酸剂和相转移催化剂存在下反应很顺利。反应完毕,除去卤化钠,回收溶剂及未反应的原料,经后处理得到产品。
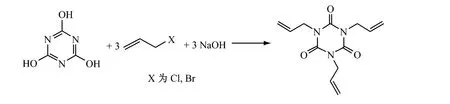
Billy E Lloyd等[36]在合适的溶剂中,以氰尿酸、苛性碱和烯丙基氯反应制得异氰尿酸三烯丙酯,产率>63%。
Thomas C Frazier等[37-38]将65g氰尿酸和60 g氢氧化钠加入800mL水中,于50℃下15min内加入0.5g氯化亚铜和250g烯丙基氯,维持温度50℃,加入过量的质量分数为50%的氢氧化钠,维持pH值10.0~10.5,反应完毕用苯萃取,蒸馏,得到异氰尿酸三烯丙酯,产率为86%。铜盐及亚铜盐催化剂可缩短反应时间,并提高产率。亚铜离子与氰尿酸的量之比≥0.01。
Spencer Chemical Co.报道了制备异氰尿酸三烯丙酯的改进工艺[39]。在100mL DMF中,加入0.1mol氰尿酸和0.3mol氧化钙,加热至105℃,加入1mol烯丙基氯回流反应6h,冷却,过滤,减压蒸馏回收DMF和未反应的烯丙基氯。蒸馏残液用丙酮萃取,然后蒸馏,干燥,得到异氰尿酸三烯丙酯粗品,产率为12%。以碳酸钾、苄基三甲基氯化铵、氢氧化钠为缚酸剂,105℃下反应2~18h,产率为45%~88.5%。
James J Tazuma等[40]在200mL邻二氯苯溶剂中,将0.24mol氰尿酸、0.74mol烯丙基氯和0.8mol三乙胺,于120~180℃下沸腾反应3h,趁热过滤,得到104g盐酸三乙胺和异氰尿酸三烯丙酯,产率为82%。
Priebe H等[41]将氰尿酸和烯丙基氯在氢氧化钠溶液中反应,制得白色的异氰尿酸二烯丙酯和异氰尿酸三烯丙酯,产率分别为68%和20%~22%。
Belyaeva N V等[42]将65g氰尿酸和60g氢氧化钠加入800mL水中,于50℃下15min内加入0.5g氯化亚铜和一定量烯丙基溴,维持温度50℃,加入过量的质量分数为50%的氢氧化钠,维持pH值10.0~10.5,反应完毕用苯萃取,蒸馏,得到异氰尿酸三烯丙酯。
Edwin D Little[43]将60份氢氧化钠、800份水和65份氰尿酸的混合物,搅拌加热至50℃,加入0.495份氯化亚铜,再加入235份烯丙基氯等温反应。反应初期pH值下降为7.0,再加入50份质量分数为50%的氢氧化钠溶液,维持pH值9.0~10.5,继续反应30min,冷却,分出油层,水溶液层用苯萃取和油层合并;在53.2~66.5kPa下减压蒸馏,得到异氰尿酸三烯丙酯粗品,产率为86.6%。
William C Francis等[44]将390g氰尿酸三钠溶于2LDMF中,于110℃下,加入1 530g烯丙基氯,反应4h,然后回流反应18h,汽提回收过量的烯丙基氯,过滤,得到异氰尿酸三烯丙酯,产率为97.5%。选用N,N-二乙基甲酰胺为溶剂亦得到同样效果。
Sugai Kiyoshi等[45]将200g氰尿酸三钠溶于400g DMF中,于70~90℃下,在20min内加入330g烯丙基氯和10g苯胺,将混合物在105℃下加热1.5h,冷却,过滤除去氯化钠,在60~80℃和2.67~3.33kPa下减压回收 DMF,得到108g异氰尿酸三烯丙酯。
Takeuchi Ichiro[46]将100g氰尿酸三钠、一定量烯丙基氯和5g KI溶于200mL乙二醇中,于115℃下搅拌加热6h,冷却,用苯萃取,后处理得到异氰尿酸三烯丙酯,产率为51.5%。
Sugai Kiyoshi等[47]将500g粉碎的氰尿酸三钠加到1LDMF中,于100℃下滴加一定量的烯丙基氯和550mL浓度为1mol/L的氨水,反应一定时间,制得520g异氰尿酸三烯丙酯。
Savos'kin V M 等[48]将氰尿酸和烯丙基氯溶于烃溶剂中,加入含铜催化剂[氯化亚铜、铜和氰尿酸的质量比为(0.02~0.03)∶(0.066~0.02)∶1],控制反应温度50~65℃,再用质量分数为2%~5%的盐酸或硫酸溶液洗涤,然后蒸馏,得到异氰尿酸三烯丙酯。
Nissan Chemical Industries Ltd.[49]将51.6g异氰尿酸和177.6g三丙基胺溶于邻二氯苯中,加热至130℃,于105~120℃下,在3h内滴完119.4g烯丙基氯;在170℃下加热混合物4h,然后分馏得到异氰尿酸三烯丙酯,产率为81.5%,纯度为99.92%。
Hiramatsu Kenji[50-51]将 0.2mol异 氰 尿 酸、1.2mol烯丙基氯、少量氯化铜和氢氧化钠溶液的混合物,在pH值10~11和45~55℃下反应3h,然后将产物静置分层。水溶液层中异氰尿酸三烯丙酯的质量分数为1.0%,油层中异氰尿酸三烯丙酯的质量分数为87.1%。继续加入烯丙基氯,维持同样条件反应一定时间后,静置分层。水溶液层中异氰尿酸三烯丙酯的质量分数增加到7.7%,油层中异氰尿酸三烯丙酯的质量分数为89.9%,总产率为97.6%。研究结果表明:随pH值下降,异氰尿酸单烯丙酯和异氰尿酸二烯丙酯的分配系数增加。
2.5 异氰酸烯丙酯三聚法
将异氰酸烯丙酯溶于适当溶剂中,在130℃下加热一定时间,冷却,然后蒸馏溶剂,蒸馏残渣经重结晶得到异氰尿酸三烯丙酯。可供选用的溶剂有DMF、二甲基乙酰胺、N,N-二甲基苯磺酰胺、吡啶、三乙基膦等。
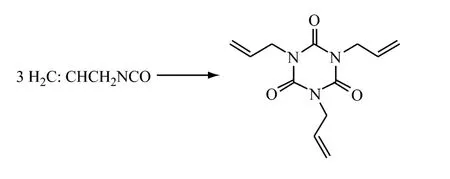
Eric C Juenge等[52]在干燥氮气氛中,改进Hart工艺制得异氰酸烯丙酯,产率为94%。
Fumio Tanimoto等[21]在压热器中,将10g异氰酸烯丙酯溶于50mL干燥吡啶中,于180~190℃下加热10h,得到异氰尿酸三烯丙酯,产率为15%。在压热器中,在1g苯甲酸钠存在下,将10 g异氰酸烯丙酯溶于50g DMF中,于100~110℃下加热4h,得到异氰尿酸三烯丙酯,产率为97%。
Heinert Dietrich H[53]于500~1 000℃和低于13.3kPa条件下,热解异氰酸烯丙酯得到异氰尿酸三烯丙酯。
Etienne Andre等[54]在三丁基磷存在下,将异氰酸烯丙酯在二氯乙烷溶剂中三聚制得异氰尿酸三烯丙酯。
3 结语
提高异氰尿酸三烯丙酯的质量和产率,需改进现有合成工艺,选择合适的溶剂和催化剂,缩短反应时间,控制副反应,改进后处理工序等,以降低成本,保护环境,增强产品竞争力。
[1] KIRK-OTHMER.Encyclopedia of chemical technology[M].4th ed.New York:John Wiley &Sons,1992:176-179.
[2] KITANO Hisao,TANIMOTO Fumio.Triallyl isocyanurate(TAIC),A new polymer material[J].Chemical E-conomy & Engineering Review,1971,3(3):42-45,52.
[3] TAKAHASHI Hironobu,TOGASHI Kunihiko,MURAKAMI Yasushi.Triallyl isocyanurate insecticide:JP,7838624[P].1978-04-08.
[4] TAKAHASHI Hironobu,MURAKAMI Yasushi,YOSHIMOTO Masahiro,et al.Synthesis and insecticidal activity of isocyanuric acids trimesters,particularly the termite-resistance properties of tripropyl isocyanurate[J].Mokuzai Gakkaishi,1985,31(6):504-514.
[5] 谢筱娟,刘广才.异氰尿酸三烯丙酯的合成[J].精细石油化工,1989(2):13,9.
[6] 王景明.氰尿酸及其衍生物的制备及应用[J].河南化工,1996(4):33-35.
[7] 赵小平,樊真.过氧化物交联剂和烯丙基系列助交联剂[J].精细与专用化学品,2003,11(17):13-15.
[8] BIDNENKO L I.Toxicity of cyanuric acid and trially isocyanurate[J].Gigiena Primeneniya Polimernykh Materialov i Izdelii iz Nikh,1969(1):299-302.
[9] BALITSKAYA L G,KHOMENKOVA K K,LAPTII S V.Isomerization of cyanurates in the presence of copper[J].Ukrainskii Khimicheskii Zhurnal,1974,40(8):881-882.
[10] KLENOVICH S V,ETLIS V S,TSAREVA L A.Triallyl isocyanurate:SU,1121259[P].1984-10-30.
[11] KLENOVICH S V,ETLIS V S,LIKHTEROV V R,et al.Triallyl isocyanuratei:SU,1121260[P].1984-10-30.
[12] WERLE Peter, KRIMMER Hans-Peter, SCHMIDT Manfred,et al.Preparation of triallyl isocyanurate:DE,102006032167[P].2007-02-22.
[13] WERLE Peter, KRIMMER Hans-Peter, SCHMIDT Manfred,et al.Process for preparation of triallyl isocyanurate:CN,101125832A[P].2008-02-20.
[14] 赢创德固赛有限责任公司.制备异氰尿酸三烯丙酯(TAIC)的方法:CN,101490019A[P].2009-07-22.
[15] 赢创德固赛有限责任公司.制备异氰尿酸三烯丙酯(TAIC)的方法:CN,101490019B[P].2012-03-09.
[16] CHIRON-CHARRIER M,CAUBERE P.Application of mono and trisubstituted salts of isocyanuric acid to the synthesis of mono and trisubstituted isocyanurates[J].Synthetic Communications,1993,23(19):2659-2672.
[17] ATSUO Nagasawa,HISAO Kitano,KENICHI Fukui.A new synthetic method for N-substituted urethans[J].Bulletin of the Japan Petroleum Institute,1964(6):72-78.
[18] DONALD W Kaiser,DAGFRID H Church.Isocyanu-rates:US,2536849[P].1951-01-02.
[19] KENICHI Fukui,HISAO Kitano.Isocyanuric acid derivatives:Brit,858810[P].1961-01-18.
[20] KENICHI Fukui,HISAO Kitano.Cyanuric and isocyanuric esters:Ger,1124957[P].1962-03-08.
[21] FUMIO Tanimoto,TAKATOMI Tanaka,HISAO Kitano,et al.Isocyanurates(Ⅱ)Synthesis of several unsaturated aliphatic isocyanurates[J].Bulletin of the Chemical Society of Japan,1966,39(9):1922-1925.
[22] KITANO Hisao.Isocyanuric acid triesters:JP,7214395[P].1972-04-28.
[23] ZENNER Karl F,APPEL Hans G.Triallyl isocyanurate:Ger,2126296[P].1972-11-30.
[24] NADACHI Yoshitaka,KOKURA Makoto.Isocyanuric acid esters:JP,7595289[P].1975-07-29.
[25] TANAKA Yoshiaki,HANDA Susumu,NISHIBATA Atsushi,et al.Isocyanurate esters:JP,7892791[P].1978-08-15.
[26] NAKAMURA Tetsuo,SAITO Hiroyasu,MATSUNAGA Yoshiki,et al.Triallyl isocyanurate:Ger,2839084[P].1979-03-39.
[27] SEKIGUCHI Akio,SAITO Hiroyasu.Triallyl isocyanurate:JP,79130591[P].1979-10-09.
[28] KITANO Hisao,TANIMOTO Fumio.Polymerizable isocyanurates:JP,6245579[P].1987-02-27.
[29] KITANO Hisao,TANIMOTO Fumio,INOUE Yoshiharu,et al.Preparation of alkenyl isocyanurates:JP,6248671[P].1987-03-03.
[30] SAIKAWA Shinya,SAITO Yoko.Preparation of triallyl isocyanurate and recovery of solvents used in the process:JP,09208564[P].1997-08-12.
[31] NAGAO Fumio,MIYAI Takehiko,YATA Tomoaki.Preparation of high quality triallyl isocyanurate:JP,11 255753[P].1999-09-21.
[32] TAKAYAMA Yoshihiro,TAKAGI Kiyohide,NAKANISHI Tsuneo,et al.Preparation of alkali metal cyanates and cyanuric acids:JP,2000119016[P].2000-04-25.
[33] TAKAYAMA Yoshihiro,TAKAGI Kiyohide,NAKANISHI Tsuneo,et al.Preparation of alkali metal cyanates and cyanuric acids:JP,2000109314[P].2000-04-18.
[34] 杨康.三烯丙基异三聚氰酸酯的合成研究[D].合肥:合肥工业大学,2013.
[35] ISHIMURA Yoshimasa, KYOKU Keihei, CHIBA Tsunehisa.Manufacture of allyl group-containing amides:JP,04321655[P].1992-11-11.
[36] BILLY E Lloyd,FRED L Kelly.Triallyl isocyanurate:US,2894950[P].1959-07-14.
[37] THOMAS C Frazier,EDWIN D Little,BILLY E Lloyd.Isocyanurates(I)Condensation reaction of cyanuric acid[J].Journal of Organic Chemistry,1960,25:1944-1946.
[38] THOMAS C Frazier,BERNARD H Sherman.Triallyl isocyanurate:US,3065231[P].1962-11-20.
[39] Spencer Chemical Co. Triallylic isocyanuates:Brit,912964[P].1962-12-12.
[40] JAMES J Tazuma,RICHARD Miller.Trialkyl isocyanurates:US,3075979[P].1963-01-29.
[41] PRIEBE H,FALK B,DEUTSCH K.Polyester molding compositions based on diallyl isocyanurate[J].Plaste und Kautschuk,1966,13(4):223.
[42] BELYAEVA N V,GARETOVSKAYA N L,SIMONOVA N F,et al.Use of triallyl isocyanurate in saturating compounds for Dacron[J].Kauchuki Rezina,1967,26(1):33-35.
[43] EDWIN D Little.Purification of triallyl isocyanurate:US,3322761[P].1967-05-30.
[44] WILLIAM C Francis,DONALD L Burdick.Triallylic isocyanurates:US,3376301[P].1968-04-02.
[45] SUGAI Kiyoshi,TAKEUCHI Ichiro.Triallyl isocyanurates:JP,6829146[P].1968-12-13.
[46] TAKEUCHI Ichiro.Triallyl isocyanurate:JP,7015908[P].1970-06-03.
[47] SUGAI Kiyoshi,TAKEUCHI Ichiro.Triallyl isocyanu-rates:JP,6829395[P].1968-12-17.
[48] SAVOS'KIN V M ,GONTAREVSKAYA N P,BORBULEVICH A I,et al.Trially isocyanurate:USSR,765265[P].1980-09-23.
[49] Nissan Chemical Industries Ltd.High purity triallyl isocyanurate:JP,57200371[P].1982-12-08.
[50] HIRAMATSU Kenji.Manufacture of triallyl isocyanurate:JP,0449284[P].1992-02-18.
[51] HIRAMATSU Kenji.Recovery of intermediate for triallyl isocyanurate:JP,0449285[P].1992-02-18.
[52] ERIC C Juenge,FRANCIS Wm C.Vinyl isocyanurates:Preparation of alkenyl isocyanurates by trimerization or cotrimerization of isocyanates[J].Journal of Organic Chemistry,1961,26:3334-3337.
[53] HEINERT Dietrich H.Organic isocyanates:US,3470228[P].1969-09-30.
[54] ETIENNE Andre, LONCHAMBON Georges, GIRAUDEAU Pierre,et al.Triallyl isocyanurate and products from the organomagnesium compounds reactions[J].Comptes Rendus Hebdomadaires des Seances del'Academie des Sciences(Series C),1975,280(15):995-998.

