香菇多糖对小鼠骨髓树突状细胞表型和功能的影响
胡婷婷,孟一鸣,单风平
(中国医科大学免疫学教研室,辽宁 沈阳 110001)
香菇多糖(Lentinan,LNT)是香菇子实体提取物中的主要有效成分之一,是1969年 Chihara等[1]首次从香菇中分离出的具有抗肿瘤活性的多糖。研究发现,LNT具有多种药理学作用,是一种兼有抑制肿瘤和提高免疫功能的多糖类生物反应调节剂[2]。LNT可以增强巨噬细胞的吞噬功能,激活T淋巴细胞释放活化因子,提高NK细胞活性,诱导干扰素或白细胞介素等细胞因子的产生[3]。树突状细胞(dendritic cells,DCs)是体内功能最强大的专职抗原递呈细胞(antigen presenting cell,APC),具有独特的抗原递呈和激活功能;作为免疫反应的核心和关键,在肿瘤细胞和T淋巴细胞的相互作用中起桥梁和枢纽作用[4]。本研究利用LNT作用于小鼠骨髓源树突状细胞(bone marrow dendritic cells,BMDCs),进一步观察 LNT的免疫活性及其对DCs的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 雌性C57BL/6小鼠,6~8周,购自中国医科大学实验动物中心。
1.1.2 药物和主要试剂 香菇多糖(商品名为天地欣)购自南京绿叶思科药业有限公司;IL-12、IL-10和 TNF-α ELISA 试剂盒(eBioscience),MHCⅡ抗体、CD40抗体、CD83抗体、CD86抗体、CD80抗体和DEC205抗体(BD Biosciences)。
1.2 方法
1.2.1 小鼠骨髓来源的树突状细胞的培养 取6~8周龄C57BL/6小鼠,颈椎脱臼处死,于75%酒精中浸泡10~15 min,无菌手术取出四肢放入75%酒精中,剔去肌肉,剪掉骨头两端,用1 mL无菌注射器吸取RPMI1640反复冲洗骨髓腔,收集细胞悬液,1500 r/min离心6 min,倒掉上清,加入1~2 mL红细胞裂解液1~2 min,用PBS洗3遍后重悬于含双抗和10%胎牛血清(FCS)的RPMI1640培养液中,接种于6孔板,24 h后弃去未贴壁细胞,再加入含 GM-CSF、IL-4、双抗和10%FCS的RPMI1640,每隔1 d取出半量培养液再加入等量的含 GM-CSF、IL-4、双抗和 10%FCS的RPMI1640培养液,培养至对数期,加药刺激。
1.2.2 药物处理 LNT溶解于RPMIl640中,使LNT浓度为50 μg/mL,然后加入培养至对数生长期的BMDCs细胞培养液中,用RPMI1640培养作为空白对照组,10 ng/mL的LPS(Sigma)刺激培养作为阳性对照。
1.2.3 酸性磷酸酶活性检测 BMDCs经药物处理后培养48 h,再用胰酶消化成细胞悬液,调整细胞浓度为1×106个/mL,按照酸性磷酸酶试剂盒(南方建成生物工程研究所)提供方法操作。
1.2.4 免疫荧光标记和流式细胞仪检测 BMDCs经药物作用48 h后,用胰酶消化为细胞悬液,用FACS缓冲液(含2%FCS的PBS)洗1次,1500 r/min离心6 min,调整细胞浓度1×106个/mL,每管加0.1 mL细胞悬液,加 PE标记的 MHCⅡ和CD40,FITC 标记的 CD83、CD86、CD80 和 DEC205单克隆抗体,4℃避光温育30 min,用FACS缓冲液洗3遍,然后用300 μL FACS缓冲液重悬细胞置于流式细胞仪(FACScan B.D.)检测。
1.2.5 吞噬试验 实验过程要求无菌操作,细胞处理步骤同 1.2.4,加入 FITC-dextran抗体,4℃避光温育2 h,37℃避光温育1 h,用FACS缓冲液洗3遍,然后用300 μL FACS缓冲液重悬细胞置于流式细胞仪(FACScan B.D.)检测。
1.2.6 细胞因子检测 BMDCs经药物作用48 h后收集上清,应用双抗体夹心法酶联免疫吸附试验(ELISA)检测细胞培养液上清中IL-12、IL-10和TNF-α的含量,试验按照购买的ELISA试剂盒的步骤操作。反应终止后用酶标仪检测450 nm吸光值(A450),再根据标准曲线确定所测细胞因子的浓度。
2 结果与分析
2.1 LNT对酸性磷酸酶活性的影响
BMDCs经药物LNT刺激培养48 h后,检测酸性磷酸酶活性。50 μg/mL的 LNT((78.73±3.14)U/gpmt)和 LPS((65.66 ±1.07)U/gpmt)组与 RPMI1640((94.18 ±1.35)U/gpmt)对照组相比酸性磷酸酶活性下降(P<0.01),见图1。
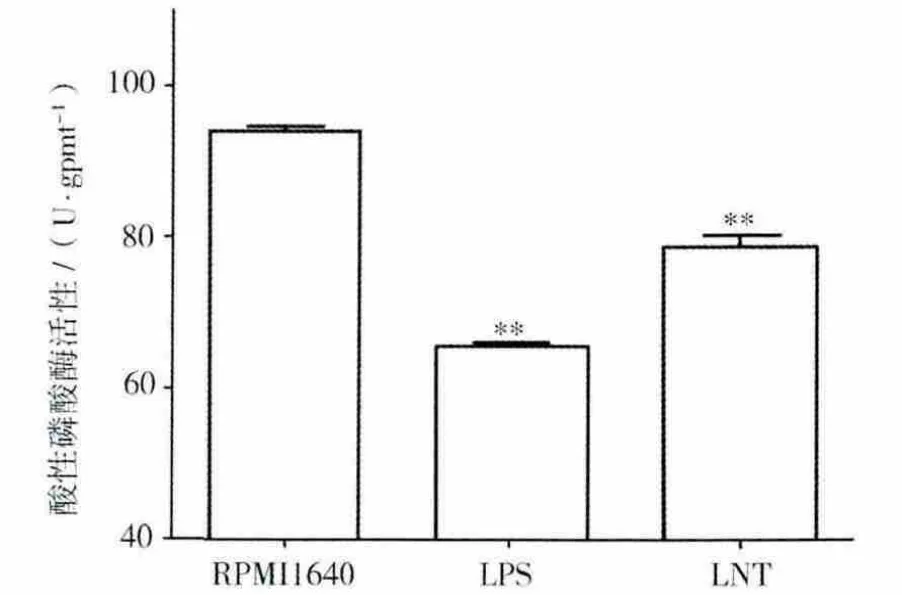
图1 LNT下调BMDCs酸性磷酸酶活性Fig.1 LNT depress the activity of acid phosphatase of BMDCs
2.2 LNT 对 DC MHCⅡ、CD40、CD83、CD80、CD86和DEC205表达的影响
BMDCs经药物LNT刺激培养48 h后,流式细胞仪检测 DC 表面 MHCⅡ、CD40、CD83、CD80、CD86和DEC205的表达情况见图2。表明50 μg/mL 的 LNT 能够上调 MHCⅡ、CD40、CD83、CD80、CD86 和 DEC205 的表达(P <0.01),即50 μg/mL的LNT能够促进DC表型的成熟。

图2 LNT能够上调BMDCs表面 MHCⅡ、CD40、CD83、CD80、CD86和DEC205的表达Fig.2 LNT enhance the expression of MHCⅡ,CD40,CD83,CD80,CD86 and DEC205 molecules on the BMDCs surface
2.3 LNT抑制DC对FITC-dextran的吞噬
BMDCs经药物LNT刺激培养48 h后,再加入FITC-dextran后4℃避光温育2 h,再37℃避光温育1 h,在流式细胞仪上检测阳性细胞的百分比,以此百分比代表DC吞噬FITC-dextran的量,反映DC摄取抗原的能力。经过LNT和LPS处理过的DC阳性细胞所占比例分别是(46.86±5.99)%和(43.53 ±6.29)%,比空白对照组(即RPMI1640组)的(59.82±1.67)%明显降低(P <0.05)(见图 3)。
2.4 LNT 对 DC 分泌 IL-12、IL-10 和 TNF-α 的影响
ELISA结果显示 DC的空白对照(即 RPMI1640组)IL-12、IL-10和 TNF-α分泌的量少((33.34 ± 2.61)、(99.75 ± 6.74)、(553.69 ±16.29)pg/mL),50 μg/mL 的 LNT 和 LPS处理的DC能够分泌高水平的IL-12、IL-10和TNF-α(LNT、LPS 分别为(143.53 ± 20.98)、(496.2 ±17.99)pg/mL;(196.23 ± 2.93)、(437.21 ±13.21)pg/mL;(706.54 ± 13.79)、(835.56 ±21.47)pg/mL,(P <0.01)),见图4。
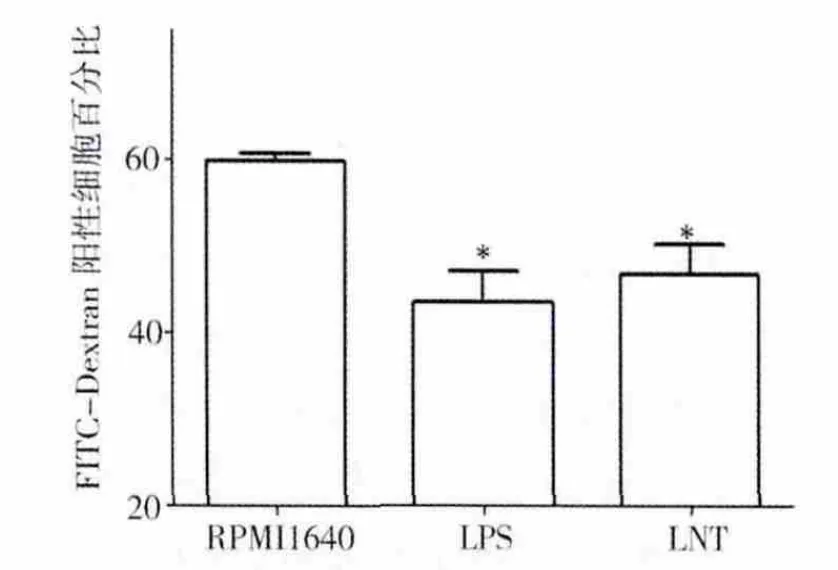
图3 LNT和LPS处理的DC吞噬功能比RPMI1640(即空白对照组)明显降低Fig.3 The ability of unstimulated BMDCs to uptake FITC-dextran was higher than that of LNT-or LPS-treated BMDCs
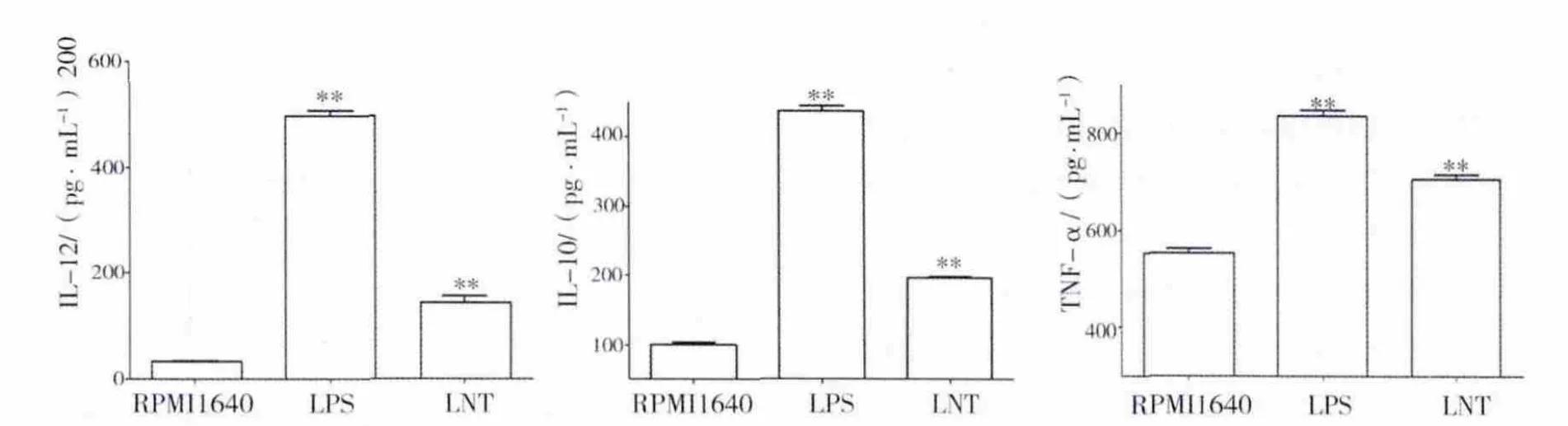
图4 LNT能够增强BMDCs对IL-12、IL-10和TNF-α的分泌Fig.4 LNT-treated BMDCs secreted higher level of IL-12,IL-10 and TNF-α
3 讨论
LNT具有多种药理学作用,可有效激活T细胞,增强肿瘤患者 Th和 Tc细胞的功能[5],激活肿瘤坏死因子的产生及巨噬细胞的细胞毒作用,间接杀灭肿瘤细胞[6]。DCs是目前人体内最活跃、功能最强大的专职抗原呈递细胞,参与机体多种自身免疫性疾病、免疫缺陷病、肿瘤及一些炎症反应的病理过程,在机体的抗感染免疫及肿瘤免疫应答过程中起着极其重要的作用。
本实验研究了浓度为50 μg/mL的LNT对小鼠骨髓来源的DCs表型和功能的影响。研究结果显示,50 μg/mL LNT刺激培养48 h后,细胞高表达 MHCⅡ、CD40、CD83、CD80、CD86 和DEC205分子。成熟DCs高表达 MHCⅡ、CD40、CD86和CD80等共刺激分子,CD83是DCs成熟的特征性标志[7],DEC205是C型凝集素巨噬细胞甘露糖受体家族成员,在淋巴结T细胞区的DCs上高表达[8],能高效地将抗原加载到 MHCⅡ分子上并提呈给T淋巴细胞[9],而且细胞对FITC-dextran的吞噬能力下降,细胞趋向成熟;此外,还发现50 μg/mL LNT可使细胞内酸性磷酸酶活性下降,酸性磷酸酶是溶酶体进行细胞内消化的标示酶,其活性下降,说明细胞溶酶体含量减少,间接说明DCs吞噬抗原的能力减弱,细胞趋向成熟。IL-12和IL-10是DCs的自分泌细胞因子[10],在受到细菌、病毒或其自身表面分子配体的刺激下分泌更明显。IL-12有强大的诱生干扰素的作用,故DCs可通过IL-12介导Th1型免疫反应,促进细胞免疫应答,其含量的增加可进一步促进CD4+T细胞增殖,增强细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)杀伤活性,刺激T细胞和NK细胞产生 IFN-γ,抑制 IgE合成[11]。内源性及外源性IL-10可影响DCs指导Th1/Th2极化,诱导无能/调节T细胞,有助于DCs诱导Th2反应[12]。TNF-α可诱导IFN的产生,与IFN具有协同抗病毒作用,TNF-α具有抗肿瘤、促进 T、B细胞生长等多种生物学活性[13]。IL-12、IL-10和TNF-α 是 mDC 的功能性产物[10,14],本实验研究结果显示其含量的增高及DCs抗原提呈方面的成熟和表型上的成熟是对应的。
机体抗肿瘤免疫主要依靠CTL的免疫应答来杀伤肿瘤细胞,CTL并不能识别完整的肿瘤抗原分子,只能特异性地识别由MHC分子呈递的抗原多肽。在大部分恶性肿瘤中,肿瘤细胞表面的MHC抗原肽、共刺激分子和黏附分子表达较低,不能有效地诱导T细胞活化,故需要抗原呈递细胞的协同作用[15],然而功能最强大的专职抗原呈递细胞DCs在肿瘤组织及其周围只有很少的浸润[16]。所以,DCs疫苗治疗肿瘤是一种安全的、有效诱导T细胞反应的免疫疗法,诸多试验也取得了一些疗效[17-19]。
本实验结果表明,LNT能够促进DCs的成熟,提高DCs的抗原提呈能力,刺激DCs高表达共刺激分子,使IL-12、IL-10和 TNF-α等因子分泌量增加,抑制肿瘤的生长。因此,LNT作为DCs治疗肿瘤的免疫佐剂具有重要的临床意义,其在体内对DCs的影响等也值得深入研究。
[1]Chihara G,Maeda Y,Hamuro J,et al.Inhibition of Mouse Sarcoma 180 by Polysaeeharides from LentinusEdodes(Berk)Sing[J].Nature,1969,222(5194):687-688.
[2]Bisen PS,Baghel RK,Sanodiya BS,et al.Lentinus edodes:A Macrofungus with Pharmacological Activities[J].Curr Med Chem,2010,17(22):2419-2430.
[3]Xu X,Wang X,Cai F,et al.Renaturation of triple helical polysaccharide lentinan in water-diluted dimethylsulfoxide solution[J].Carbohydr Res,2010,345(3):419-424.
[4]Xue M,Zhu L,Meng Y,et al.Detailed modulation of phenotypes and functions of bone marrow dendritic cells(BMDCs)by interferon-gamma(IFN-γ)[J].Int Immunopharmacol,2013,17(2):366-372.
[5]汪继斌,谢毅强,吴贤波.香菇多糖对约氏疟原虫感染小鼠树突状细胞的免疫调节作用[J].中国病原生物学杂志,2013,8(1):56-58.
[6]丛阳,黄敏.香菇多糖抗肿瘤的基础研究及临床应用进展[J].大连医科大学学报,2010,32(4):465-469.
[7]Meng Y,Plotnikoff NP,Shan F,et al.Synergistic effect of methionine encephalin(MENK)combined with pidotimod(PTD)on the maturation of murine dendritic cells(DCs)[J].Hum Vaccin Immunother,2013,9(4):773-783.
[8]Thonur L,Haig DM,Thomson J,et al.Toll-like receptor gene expression in fresh and archived ovine pseudoafferent lymph DEC205+dendritic cells[J].J Comp Pathol,2012,147(2-3):296-304.
[9]Cheong C,Choi JH,Vitale L,et al.Improved cellular and humoral immune responses in vivo following targeting of HIV Gag to dendritic cells within human anti-human DEC205 monoclonal antibody[J].Blood,2010,116(19):3828-3838.
[10]Sabado RL,Miller E,Spadaccia M,et al.Preparation of tumor antigen-loaded mature dendritic cells for immunotherapy[J].J Vis Exp,2013,1:78.
[11]Darlak KA,Wang Y,Li JM,et al.Enrichment of IL-12-producing plasmacytoid dendritic cells in donor bone marrow grafts enhances graft-versus-leukemia activity in allogeneic hematopoietic stem cell transplantation[J].Biol Blood Marrow Transplant,2013,19(9):1331-1339.
[12]Huang H,Dawicki W,Lu M,et al.Regulatory dendritic cell expression of MHCII and IL-10 are jointly requisite for induction of tolerance in a murine model of OVA-asthma[J].Allergy,2013 ,68(9):1126-1135.
[13]Miwa S,Nishida H,Tanzawa Y,et al.Correction:TNF-α and Tumor Lysate Promote the Maturation of Dendritic Cells for Immunotherapy for Advanced Malignant Bone and Soft Tissue Tumors[J].PLoS One,2013,24:8(10).
[14]Matsuda R,Kezuka T,Nishiyama C,et al.Suppression of murine experimental autoimmune optic neuritis by mature dendritic cells transfected with calcitonin gene-related Peptide gene[J].Invest Ophthalmol Vis Sci,2012,53(9):5475-5485.
[15]Kim DS,Kim DH,Goo B,et al.Immunotherapy of malignant melanoma with tumor lysate-pulsed autologous monocyte-derived dendritic cells[J].Yonsei Med J,2011,52(6):990-998.
[16]Ayari C,LaRue H,Hovington H,et al.High level of maturetumor-infiltrating dendritic cells predicts progression to muscle invasion in bladder cancer[J].Hum Pathol,2013,44(8):1630-1637.
[17]Perroud MW Jr,Honma HN,Barbeiro AS,et al.Mature antolognus dendritic cell vaccines in advanced non-small cell lung caneer:a phase I pilot study[J].Exp Clin Cancer Res,2011,30:65.
[18]Kvisthorg P,Beehmann CM,Pedersen AW,et al.Comparison of monocyte-derived dendritic cells from colorectal cancer patients,non-small-cell-lung-cancer patients and healthy donors[J].Vaccine,2010,28(2):542-547.
[19]Fukushima S,Himta S,Motomura Y,et al.Multiple antigentarged immunotherapy with alpha-galactosylce-ramide-loaded and genetically engineered dendritic cells derived from embryonic stem cells[J].Immunother,2009,32(3):219-231.

