不同强度有氧运动对糖尿病大鼠血糖及心肌氧自由基的影响
王瑜,于瑞雪,胡思博
糖尿病是胰岛素分泌障碍和(或)作用障碍引起的慢性代谢性疾病,糖尿病心、脑、肾脏并发症成为导致糖尿病人死亡的主要原因[1]。近年来研究证实,氧化应激可引起心肌细胞凋亡、坏死,进而导致糖尿病心肌病[2]。运动疗法是治疗糖尿病安全、有效、简便的方式,在临床中得到广泛应用[3]。
有氧运动可提高组织对葡萄糖的利用,增强胰岛素敏感性,降低血糖[4];同时运动中产生的氧自由基可阻断胰岛素作用通路[5]。本研究通过高脂饮食饲喂联合腹腔注射链脲佐菌素的方法建立糖尿病大鼠模型,探讨不同强度有氧运动对糖尿病大鼠的血糖以及心肌组织氧自由基的影响,为运动疗法在临床实践与应用提供理论依据。
1 材料与方法
1.1动物建模型建立与分组雄性健康成年SD大鼠,6周龄,体重(200±10)g,购于天津放射医学研究所。65只大鼠以基础饲料预饲1周。抽签法随机抽取10只为正常组(A组),普通饲料喂养。剩余55只大鼠,给予高脂饲料(普通饲料66.5%、白砂糖20%、猪油10%、胆固醇2.5%、胆酸钠1%)喂养4周后,空腹12小时,一次性腹腔注射STZ40 mg/kg(溶于1 mmol/L,pH4.4枸橼酸缓冲液)。A组注射等体积柠檬酸缓冲液。72小时后尾静脉采血测空腹血糖。空腹血糖≥7.0 mmol/L为造模成功[6]。选取糖尿病模型成功的大鼠,随机分为四组,模型组(B组)、低强度运动组(C组)、中强度运动组(D组)、高强度运动组(E组),每组10只。参考Fernando[7]方法采用跑台运动,适应性训练3天,休息1天后正式训练。训练强度:低、中、高强度组跑速分别为10 m/min(相当于30%VO2MAX)、15 m/min(相当于50%VO2MAX)、20 m/min(相当于70%VO2MAX),坡度均为0,每天运动1小时,每周6天,连续6周。
1.2主要药品和仪器链脲佐菌素(STZ,美国sigma公司);Western及IP细胞裂解液(碧云天生物技术研究所);大鼠血清胰岛素ELISA检测试剂盒(深圳晶美生物工程有限公司),超氧化物歧化酶(SOD)检测试剂盒、丙二醛(MDA)检测试剂盒、一氧化氮(NO)检测试剂盒、总一氧化氮合酶(NOS)测试盒(南京建成生物工程研究所)。血糖仪(美国罗氏公司),血糖试纸(罗氏罗康全优越型血糖试纸),紫外分光光度计(上海精密仪器有限公司)。
1.3观测指标和方法
1.3.1血清学检测各组大鼠分别在造模前、注射后、运动前、连续运动6周后,空腹12 h,尾静脉采血,检测血糖。随后取血5 ml,3000 r/min,4℃离心5 min分离血清,置于-80°C保存。使用Elisa法检测大鼠血清胰岛素含量。计算胰岛素抵抗指数[HOMA-IR=(FBG×FINS)/22.5][8]。
1.3.2心肌组织SOD、MDA、NO、NOS检测连续运动6周后,各组大鼠取血后断头器处死,取心脏,冰冷生理盐水清除血迹,每组取心肌组织200 mg剪碎,加入裂解液后组织匀浆器匀浆,后3000 r/min,4℃离心10 min,取上清,4℃保存。各指标检测按照试剂盒说明书操作,应用分光光度计检测。
1.4统计学处理所有数据使用SPSS16.0统计学软件处理,计量资料以均数±标准差(s)表示,多组间均数比较采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1各组大鼠造模前与造模后FBS、FINS、HOMA-IR变化情况与造模前比较,各组大鼠注射STZ后FBG、FINS、HOMA-IR均升高(P均<0.05)(表1)。
2.2各组大鼠运动前后FBG、FINS、HOMA-IR变化情况跑台运动6周后,与模型组比较,低强度运动组、中强度运动组、高强度运动组FBG均下降(P均<0.05),但仍未达到正常水平。低、中、高强度运动组FINS、HOMA-IR较模型组均降低(P均<0.05)。与低、中强度运动组比较,高强度运动组FBG、FINS、HOMA-IR均显著升高(P均<0.05)(表2)。
2.2各组大鼠心肌组织SOD,MDA,NO,NOS水平与正常组比较,模型组大鼠MDA和NO水平、NOS活性均升高(P均<0.05),SOD活性明显降低(P<0.01);与模型组比较,运动组大鼠治疗6周后,MDA和NO水平、NOS活性均显著降低(P均<0.01),SOD活性升高(P均<0.05)。与低、中强度运动组比较,高强度运动组MDA和NO水平、NOS活性升高(P均<0.05),SOD活性降低(P均<0.05)(表3)。
3 讨论
糖尿病作为严重危害人类健康的慢性代谢性疾病,其并发症的防治及治疗关键在于控制血糖。本研究证实,糖尿病大鼠运动6周后,各运动组空腹血糖较模型组下降,提示运动可降低血糖。而低、中强度运动组FBG及HOMA-IR较高强度运动组明显降低,表明低、中强度运动降糖效果优于高强度运动,可增强胰岛素敏感性,减轻胰岛素抵抗,有利于糖代谢。已有研究证实,有氧运动属于高能耗刺激,提高骨骼肌中葡萄糖转运蛋白4(glucose transporter-4,GLUT4)的表达,增强GLUT4的活性,促进细胞对葡萄糖的摄取和利用[3]。但运动强度并非越高越好,低、中强度运动可使骨骼肌细胞产生适应性,激活胰岛素信号通路向糖代谢方向传递的相关蛋白分子,使骨骼肌细胞中一些重要的信号蛋白参与运动适应,增强胰岛素信号转导[9]。

表1 各组大鼠造模前后FBG、FINS、HOMA-IR的比较(n=10)
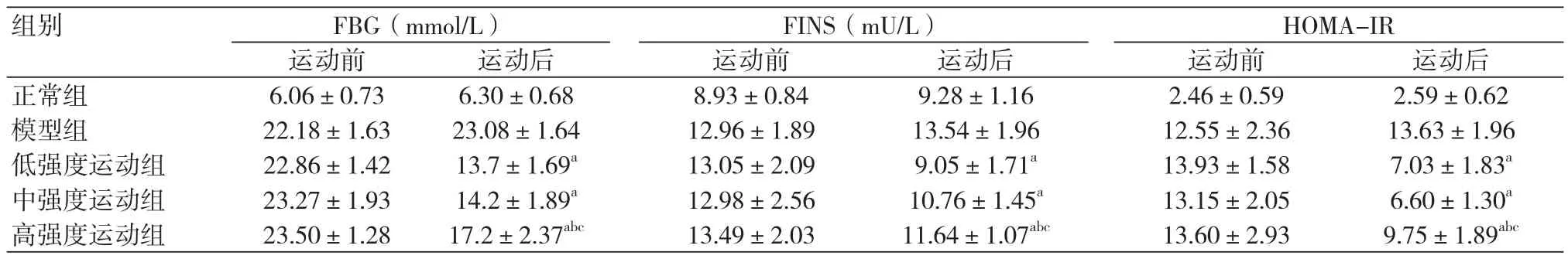
表2 各组大鼠运动前后FBG、FINS、HOMA-IR的比较(n=10)

表3 各组大鼠心肌组织SOD,MDA,NO,NOS的变化(n=10)
近年来,氧自由基在糖尿病心肌病发生发展中的作用越来越受到关注。高糖环境下,心肌细胞氧化应激产生的活性氧簇(ROS)增多,造成细胞膜脂质、胞质蛋白及核酸损伤[10]。MDA为脂质过氧化的代表终产物之一,其含量降低表明体内产生自由基减少,抗氧化能力增强。SOD是机体清除氧自由基的关键酶之一,可反映机体抗氧化能力[11]。内源性NO可促进血管舒张,抑制血管平滑肌增殖、促进脂质过氧化及氧自由基产生。NOS是NO合成的主要限速酶,随着糖尿病进展,NOS合酶活性升高,NO产生增多,后者又促进氧化应激反应,增加氧自由基生成,导致细胞进一步损伤[12]。本研究中,各运动组NO水平及NOS活性较模型组降低,提示运动疗法可抑制NOS活性,减少NO产生。
本研究结果证实有氧运动可降低血糖,降低心肌组织氧自由基水平,提高心肌组织的抗氧化能力,提示,适量有氧运动可能对糖尿病心肌病治疗发挥作用。
[1]葛均波,徐永健. 内科学[M]. 北京:人民卫生出版社,2013:733.
[2]韩宝玲. 氧化应激在2型糖尿病及其并发症发病机制中的作用[J].实用临床医学杂志,2011,15(3):122-4.
[3]Goodyear LJ,Kahn BB. Exercise,glucose transport,and insulin sensitivity[J]. Annu Rev Med,1998,49:235-61.
[4]钱荣,谈艳,汪宗宝,等. 不同运动强度下糖尿病大鼠骨骼肌胰岛素受体mRNA表达及氧化应激变化[J]. 第三军医大学学报,2010,32(9):926-7.
[5]Houstis N,Rosen ED,Lander ES. Reactive oxygen species have a causal role in multiple forms of insulin resistance[J]. Nature,2006,440(7086):944-8.
[6]刘德慧,邢翔飞. 2型糖尿病大鼠模型的特点及评价[J]. 中国实验方剂学杂志,2010,16(12):212-4.
[7]Fernando P,Bonen A,Hoffman-Goetz L. Predicting submaximal oxygen consumption during treadmill running in mice[J]. Can J Physiol Pharmacol,1993,71(10-11):854-7.
[8]Bonora E,Targher G,Al beriche M,et al. Homeostasis model assessment closely minors the gluose clamp technique in the assessment of insulin sensitivity:studies in subjects with various degrees of glucose tolerance and insulin sensitivity[J]. Diabetes Care,2000,23(1):57-63.
[9]胡瑞萍,吴毅,胡永善. 运动对大鼠骨骼肌胰岛素信号转导蛋白表达和活性的影响[J]. 中国康复医学杂志,2005,20(6):409-11.
[10]Elmarakby AA,Sullivan JC. Relationship between oxidative stress and inflammatory cytokines in diabetic nephropathy[J]. Cardiovascular Ther,2012,30(1):49-59.
[11]谢建军,杨英姿. 2型糖尿病患者斋月前后丙二醛、超氧化物歧化酶、总抗氧化力和谷胱甘肽过氧化物酶变化的观察[J]. 中国糖尿病杂志,2013,21(5):449-51.
[12]张然然. 黄芪注射液联合胰岛素对糖尿病大鼠氧化应激水平的影响[D]. 吉林大学,2013.

