瑞舒伐他汀联合普罗布考对大鼠动脉粥样硬化炎症与氧化应激的干预效果
李云攀,刘美云,赵雯娜,陈作元
动脉粥样硬化(atherosclerosis,AS)所致的心、脑血管疾病严重危害人类生命健康。现普遍认为,AS的形成是各种损伤因素作用于血管内皮细胞,导致内皮细胞功能障碍,并进一步表达和释放各种活性物质及黏附分子共同参与的慢性炎症过程[1-3]。同时,多种活性氧簇(reactive oxygen species,ROS)所诱发的氧化应激反应在冠状动脉粥样硬化性心脏病病理生理过程中发挥重要作用[4]。本实验观察大鼠动脉粥样硬化相关血清炎症指标血管内皮细胞钙黏蛋白(VE-cadherin)、脂联素(APN)与氧化应激指标8-异前列腺素-F2a(8-iso-PGF2a)、超氧化物歧化酶(SOD)表达水平及主动脉壁病理组织学改变,并观察单独和联合应用降血脂药(瑞舒伐他汀)和抗氧化剂(普罗布考)对以上指标的影响,为临床合理用药提供理论依据。
1 材料和方法
1.1实验材料
1.1.1动物健康清洁级雄性Wistar大鼠54只(山东鲁抗医药股份有限公司质检中心提供),8周龄,体重180~220 g,饲养房分笼喂养(4~6只/笼),自由饮食。
1.1.2高脂饲料配制[5]69%基础饲料、20%猪大油、5%白糖、3%胆固醇、0.5%胆酸钠、0.2%丙基硫氧嘧啶、1%葡萄糖酸钙,2%蛋黄粉。
1.1.3试验药品与试剂瑞舒伐他汀钙片(10 mg/片,阿斯利康制药有限公司,批号:115449);普罗布考(0.125 g/片,齐鲁制药有限公司,批号:2030031KL);注射用卵清白蛋白(美国Sigma公司);大鼠VE-vadherin酶联免疫吸附测定试剂盒、大鼠ADP酶联免疫吸附测定试剂盒、大鼠8-iso-PGF2a ELISA试剂盒、大鼠SOD ELISA试剂盒均购自武汉博士德生物工程有限公司。
1.2方法
1.2.1动物分组54只大鼠适应性喂养1周,1周后随机分5组,正常组(A组)12只,模型组(B组)12只,瑞舒伐他汀组(C组)10只,普罗布考组(D组)10只,瑞舒伐他汀+普罗布考组(E组)10只。
1.2.2动物模型建立A组普通饲料喂养,B组及药物干预组高脂饲料喂养同时给予卵清白蛋白2.5 mg/kg腹腔注射(5次/周)[6]。第8周末,A、B两组各随机选取2只大鼠,麻醉后处死,取主动脉弓处血管1 cm,固定,石蜡包埋,后进行HE染色,光镜下观察血管壁病理组织学改变,确定大鼠AS模型建立情况。第9周起,模型组及药物干预组高脂饲料喂养同时每日进行药物干预,C组给予瑞舒伐他汀5 mg/kg.d灌胃,D组给予普罗布考500 mg/kg.d灌胃,E组给予瑞舒伐他汀5 mg/kg.d+普罗布考500mg/kg.d灌胃,A、B组给予生理盐水灌胃作为对照,连续干预8周。
1.2.3血清学指标检测第16周末,全部大鼠禁食12 h, 10%水合氯醛4 ml/kg腹腔注射麻醉。开胸经右心房取血3 ml,置于普通生化管中,以3000 r/min离心,取上层血清,置于-70℃保存。采用酶联免疫吸附法(ELISA)经标准品的稀释、加样、孵育、洗涤、加酶显色、测定OD值等过程,通过标准曲线计算血清VE-cadherin、8-iso-PGF2a、APN、SOD的表达。
1.2.4 HE染色第16周末,留取血清后,取主动脉弓处血管1 cm,放于4%多聚甲醛溶液中固定24小时。将固定好的血管组织经梯度酒精脱水、二甲苯溶液组织透明、石蜡包埋后,切片。二甲苯脱蜡,再经由高浓度到低浓度酒精,蒸馏水冲洗,苏木精染色、伊红染色,脱水透明、固定。光镜下观察主动脉壁内膜光滑度和厚度、内膜细胞排列情况、内膜下有无脂肪细胞和泡沫细胞聚集等,随机选取5个视野,应用Simple PCI图像分析软件测量主动脉内膜厚度,取平均值。
1.3统计学分析采用SPSS17.0软件进行统计处理,计量资料采用(s)表示,多样本均数比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1动物模型建立第8周末,A、B两组大鼠,光镜下观察其主动脉血管壁病理组织学改变。A组血管内膜光滑完整且较薄,细胞排列整齐(图1A);B组血管内膜明显增厚,内皮细胞排列紊乱,可见多发的不规则脂质条纹,有脂肪细胞和泡沫细胞聚集(图1B),表明动脉粥样硬化模型建立成功。
2.2各组大鼠血清相关指标变化与A组比较,模型组和药物干预组血清VE-cadherin、8-iso-PGF2a水平显著升高(P<0.01);APN、SOD水平降低(P<0.01); 与B组比较,C、D、E组血清VE-cadherin、8-iso-PGF2a水平降低(P<0.01),APN、SOD表达明显升高(P<0.05);与C组比较,D、E组血清8-iso-PGF2a水平下降(P<0.01),SOD水平升高(P<0.01);与C、D组比较,E组血清VE-cadherin降低(P<0.01),APN升高(P<0.05,表 1)。
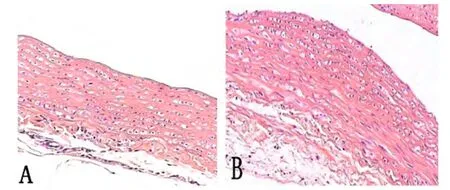
图1 第8周末A、B两组大鼠主动脉HE染色 [(200×),A:正常组;B:模型组]
2.3各组大鼠主动脉病理组织学改变第16周末,光镜下观察大鼠主动脉病理变化,A组血管内膜光滑(图2A),细胞排列规则。与A组比较,B组血管内膜明显增厚(P<0.01,图2B),细胞排列紊乱,可见泡沫细胞和单核细胞,且细胞间隙增宽;与B组比较,C、D、E组血管壁内膜厚度变薄(P<0.01)(图2C、D、E)。与C、D组比较,E组血管内膜变薄(P<0.05,表1)。
3 讨论
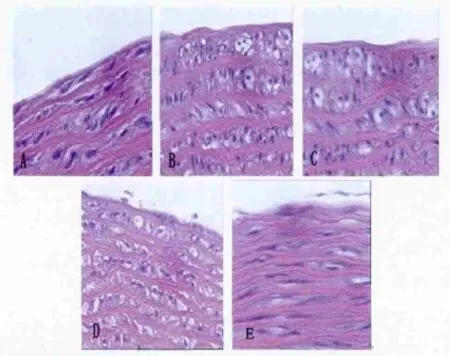
图2 16周末各组大鼠主动脉HE染色[(400×);A:正常组;B:模型组;C:瑞舒伐他汀组;D:普罗布考组;E:瑞舒伐他汀+普罗布考组
越来越多的研究表明,炎性反应在AS的发生发展中起重要作用,其主要由巨噬细胞黏附于血管内膜,于脂质沉积在血管内膜时,单核巨噬细胞可与血管内皮细胞表面受体结合吞噬脂蛋白,并转化为泡沫细胞,释放多种炎性细胞因子,加重组织损伤[7]。
氧化应激是体内参与氧化和抗氧化作用相关物质的比例失衡,从而机体产生过多的氧自由基,引起细胞的毒性反应[8,9]。氧化应激损伤也参与了AS发病的整个过程,可通过活性氧的氧化作用诱导血管内膜细胞相关基因的表达,促进局部炎性反应和细胞增殖。炎性反应和氧化应激共同作用可加重对血管内膜的损伤,加快AS的发病进程。
VE-cadherin,又名CD144,属于钙粘蛋白家族成员之一,广泛表达于血管内皮细胞的膜表面,在血管结构及功能的完整性、血管内皮间的通透性以及炎性细胞在血管内皮的表达等方面起重要作用[10]。VE-cadherin在动脉硬化新生血管形成及斑块不稳定过程中扮演了重要的角色,其过度表达能够提示AS的进展,本研究通过检测内皮功能指标VE-cadherin的含量,可间接提供有关早期AS的信息[11]。近期研究[12]结果显示,与正常组比较,AS模型组小鼠血清VE-cadherin的表达与炎症因子肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)的表达水平呈正相关,提示血清VE-cadherin水平可以反映血管内皮细胞损害程度。因此VE-cadherin成为研究AS的重要指标。APN是近几年新发现的脂肪组织特异性蛋白,研究发现APN在AS的发生、发展中发挥抵抗作用。APN可在内皮细胞表面通过激活AMPK信号通路,促进内源性一氧化氮的产生与释放,抑制血管内膜的炎症反应,发挥保护作用。APN是目前被证实与代谢综合征、糖尿病及心血管疾病呈负相关的脂肪因子,作为AS的保护性因子,可作用于AS发病机制的多个环节,也可抑制炎症因子的表达,具有抗炎及抗AS的作用[13,14],成为近几年的研究热点。8-iso-PGF2a是氧自由基损伤细胞膜多不饱和脂肪酸,如花生四烯酸(arachidonic acid,AA)等,使其发生脂质过氧化而形成的终末产物,在体液和组织中的含量极其稳定,能够准确、稳定地反映体内脂质氧化应激的程度,常将其作为评价体内氧化应激水平的最佳标准[15]。SOD是体内天然存在的抗氧化因子,可抑制氧化应激因素对血管内膜的损伤作用,抑制和逆转AS斑块进展,并可修复损伤的血管内膜[16]。
表1 各组大鼠血清炎症应激指标及主动脉内膜厚度比较(s)
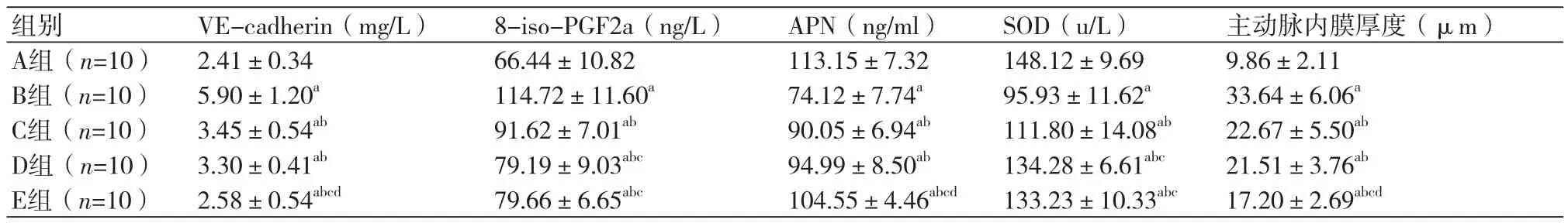
表1 各组大鼠血清炎症应激指标及主动脉内膜厚度比较(s)
注:VE-cadherin:血管内皮细胞钙黏蛋白;8-iso-PGF2a:8-异前列腺素-F2a;APN:脂联素;SOD:超氧化物歧化酶;与A组比较,aP<0.01;与B组比较,bP<0.01;与C组比较,cP<0.01;与D组比较,dP<0.05
组别 VE-cadherin(mg/L)8-iso-PGF2a(ng/L)APN(ng/ml)SOD(u/L)主动脉内膜厚度(μm)A组(n=10)2.41±0.34 66.44±10.82 113.15±7.32 148.12±9.69 9.86±2.11 B组(n=10)5.90±1.20a 114.72±11.60a 74.12±7.74a 95.93±11.62a 33.64±6.06a C组(n=10)3.45±0.54ab 91.62±7.01ab 90.05±6.94ab 111.80±14.08ab 22.67±5.50ab D组(n=10)3.30±0.41ab 79.19±9.03abc 94.99±8.50ab 134.28±6.61abc 21.51±3.76ab E组(n=10)2.58±0.54abcd 79.66±6.65abc 104.55±4.46abcd 133.23±10.33abc 17.20±2.69abcd
在本研究中,大鼠AS VE-cadherin、8-iso-PGF2a水平明显升高,APN、SOD水平明显降低,表明炎症和氧化应激作用可能参与AS早期病变发展。实验中期分别给予瑞舒伐他汀、普罗布考及两药联合干预后,VE-cadherin、8-iso-PGF2a水平显著降低,APN、SOD水平显著升高,两药合用可明显降低血清VE-cadherin、8-iso-PGF2a的表达,并提高APN、SOD的表达。同时光镜下观察,两药合用主动脉内膜损伤较单独用药减轻,且内膜厚度较单用药组薄。本研究结果表明,瑞舒伐他汀可能通过降低血清VE-cadherin含量,并升高APN的表达,来发挥其抗炎作用,达到稳定AS斑块、修复受损血管内膜的作用。而普罗布考则可能通过降低血清8-iso-PGF2a含量,并升高SOD表达,来发挥其抗氧化作用。
综上所述,瑞舒伐他汀与普罗布考均具有抗炎和抗氧化作用,普罗布考的抗氧化作用优于瑞舒伐他汀,两药合用可明显降低血清VE-cadherin水平,并升高ANP的表达。本实验结果可指导两药在临床中更合理的应用。
[1]Zernecke A,Weber C. Chemokines in the vascular inflammatory response of atherosclerosis[J]. Cardiovascular Research,2010,86(2):1 92-101.
[2]苏珂,龙艳,黄漓莉,等. 2型糖尿病高尿酸患者动脉粥样硬化与白细胞介素10和脂联素的关系[J]. 中国动脉硬化杂志,2013,21(4):331-5.
[3]谈春芝,吴洁,唐朝克,等. 白细胞介素4与动脉粥样硬化[J]. 中国动脉硬化杂志,2011,19(2):155-9.
[4]Seo H,Oh H,Park H,et al. Contribution of dietary intakes of antioxidants to homocysteine-induced low density lipoprotein(LDL)oxidation inatherosclerotic patients[J]. Yonsei Med J,2010,51(4):526-33.
[5]王园园,龙民慧,邹民吉,等. 大鼠动脉粥样硬化动物模型的建立和评价[J]. 中国实验动物学报,2008,16(6):421-3.
[6]Campbell LA,Blessing E,Rosenfeld M,et al. Mouse models of copneumoniae infection and atherosclerosis[J]. J Infect Dis,2000,181(3):508-13.
[7]Lobatto ME,Calcagno C,Metselaar JM,et al. Imaging the efficacy of anti-inflammatory liposomes in a rabbit model of atherosclerosis by non-invasive imaging [J]. Methods Enzymol,2012,508:211-28.
[8]Fujimoto H,Kobayashi H,Ohno M. Age-induced reduction in mitochondrial manganese superoxide dismutase activity and tolerance of macrophages against apoptosis induced by oxidized low density lipoprotein[J]. Circulation,2010,74(2):353-60.
[9]林春喜,林建聪,郭润民,等. 硫化氢通过调控JNK通路对抗高糖诱导的心肌细胞氧化应激损伤[J]. 中国动脉硬化杂志,2013,21(1):1-5.
[10]Verin AD. Tyrosine phosphorylation and endothelial cell barrier regulation[J]. Am J Pathol, 2005,166(4):955-7.
[11]程王生,张钲,白锋,等. 冠心病患者中血管内皮细胞钙黏蛋白的检测及临床意义[J]. 中国现代医学杂志,2006,16(16):851-7.
[12]尹海鹏,刘向群,等. 黄芩苷对ApoE-/-小鼠动脉粥样硬化及VE-钙黏蛋白表达水平的影响[J]. 山东大学学报(医学版),2013,51(9):26-30.
[13]Antoniades C,Antonopoulos AS,Tousoulis D,et al. Adiponectin:from obesity to cardiovascular disease[J]. Obes Rev,2009,10(3):269-79.
[14]Persson J,Folkersen L,Ekstrand J,et al. High plasma adiponectin concentration is associated with all-cause mortality in patients with carotid atherosclerosis[J]. Atherosclerosis,2012, 225(2):491-6.
[15]Morrow JD. Quantification of isoprostanes as indices of oxidant stress and the risk of atherosclerosis in humans[J]. Arterioscler Thromb Vase Biol,2005,25(2):279-86.
[16]Teodoro BG,Natali AJ,Fernandes SAT,et al. Improvements of atherosclerosis and hepatic oxidative stress are independent of exercise intensity in LDLr-/-mice[J]. J Atheroscler Thromb,2012,19(10):904-11.

