硫化氢/胱硫醚-γ-裂解酶在胆管梗阻致急性胆囊炎中的表达
张 丽,余保平,杨 斌,潘陈为,肖 勇
武汉大学人民医院消化内科,湖北 武汉 430060
硫化氢(hydrogen sulfide,H2S)是继NO和CO之后的第3种气体信号分子,参与机体多种病理生理学反应。内源性H2S主要是半胱氨酸在胱硫醚-β-合成酶(cystathionine-β-synthetase,CBS)、胱硫醚-γ-裂解酶(cystathionine-γ-lyase,CSE)和半胱氨酸转移酶催化作用下产生的[1]。其中CBS是脑中产生H2S的主要酶,CSE则主要分布在神经系统外的组织。在消化系统内,胃、十二指肠、回肠、结肠、肝脏以及胰腺组织均存在CSE,并可产生内源性H2S[2]。而胆囊组织中是否存在CSE尚未见报到。本研究采用胆总管结扎方法构建急性非结石性胆囊炎(acute acalculous cholecystisis,AAC)模型,观察胆囊组织中H2S/CSE体系的表达变化。
1 材料与方法
1.1 材料 健康成年豚鼠30只(武汉大学人民医院动物中心提供),雄性,体质量250~350 g。饲养环境为:温度20~25℃,湿度40% ~60%。GAPDH单克隆抗体、CSE多克隆抗体购自美国Santa Cruz公司,羊抗兔二抗购自北京中衫生物试剂公司,Western blotting相关试剂购自碧云天公司进口分装。
1.2 方法 本实验共分为3组:正常组、假手术对照组(Sham组)、胆总管结扎48 h(BDL-48 h)组。每组8只。
1.2.1 模型构建[3]:戊巴比妥钠(50 mg/kg 体质量)腹腔麻醉后,腹部备皮,消毒。剑突下1 cm左右沿腹中线切口,游离胆总管,在胆管进入十二指肠入口处结扎胆总管(3-0线)。胆囊不作任何操作。依次缝合肌层、皮肤。切口氢氧化物消毒,常规消毒包扎处理。假手术组不结扎胆总管,其他处理与上述一致。待动物清醒后,将其转移到笼内(可以自由喂食及饮水)。实验时间后收集各组胆囊标本。
1.2.2 HE染色鉴定模型:取各组胆囊标本,4%多聚甲醛液室温固定4~6 h后,石蜡包埋、切片,4~5 μm厚。行苏木素-伊红(HE)染色,光镜下观察胆囊病理学改变。胆囊炎症的评定由2位病理学医师独立双盲评分[4]。
1.2.3 胆囊组织CSE活性测定:参照文献[5],将磷酸钾缓冲液(100 mmol/L,pH 7.4)加入胆囊组织,冰上研磨,制备成匀浆。取含有中央小室的锥形瓶。外室反应体系由磷酸钾缓冲液(pH 7.4)、L-半胱氨酸(10 mmol/L)、5'-磷酸吡多醛(2 mmol/L)和10%(w/v)组织匀浆组成。中央小室内加入1%醋酸锌,并置入2.0 cm×2.5 cm滤纸。锥形瓶充入氮气30 s后严密封闭瓶口。37℃摇床孵育90 min后,加50%三氯醋酸终止反应。将中央小室内容物移入到含3.6 ml蒸馏水的试管中,加入对氨基二甲基苯二胺盐酸盐(20 mol/L)和三氯化铁(30 mol/L),室温孵育20 min。分光光度计在670 nm波长处检测吸光度。根据NaHS标准曲线计算组织H2S含量。CSE活性以每毫克组织每分钟生成H2S的量表示,单位为 μmol· min-1·g-1。
1.2.4 胆囊组织CSE蛋白的表达定位:采用SP试剂盒进行免疫组织化学检测。将保存于4%多聚甲醛中的胆囊组织取出,石蜡包埋、切片。常规脱蜡至水,抗原修复。加一抗4℃孵育过夜、隔日加二抗孵育20 min、37℃孵育20 min,DAB显色。苏木素复染,蒸馏水冲洗返蓝,梯度酒精逐级脱水,二甲苯透明,中性树脂封片。结果判断:显微镜下胞质出现棕黄色片状或颗粒状物为阳性。
1.2.5 胆囊组织CSE蛋白含量的测定:采用Western免疫印迹法检测,用组织裂解液提取总蛋白后,4℃12000 r/min离心30 min。BCA法测定蛋白浓度。制备12%的PAGE胶,按50 μg蛋白/泳道加样,电泳后按恒流200 mA转膜。用含5%脱脂奶粉的TBST室温封闭2 h,加一抗(稀释度1∶200),4℃摇床过夜,加入HRP标记的抗兔二抗(1∶2000),室温孵育1 h。洗膜后加入ECL(enhanced chemilumine scence)发光液,暗室中曝光。凝胶成像分析系统上摄像分析,测得目标带的灰度值,进而计算出各组样品CSE目标带与内参GAPDH的灰度值之比。
1.3 统计学分析 采用SPSS 13.0统计软件对数据进行分析,结果用表示,各组比较采用方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 HE染色及组织病理炎症评分 正常组与Sham组胆囊组织各层结构完整,未见明显炎性细胞浸润。BDL-48 h组可见血管增生、扩张、充血及出血,伴组织水肿以及成纤维细胞增生。大量炎性细胞浸入(主要为中性粒细胞)黏膜层、肌层及浆膜层(见图1)。正常组与Sham组炎症评分比较,差异无统计学意义(P>0.05)。BDL-48 h炎症评分较正常组和Sham组明显增高,差异有统计学意义(P<0.05,见表1)。
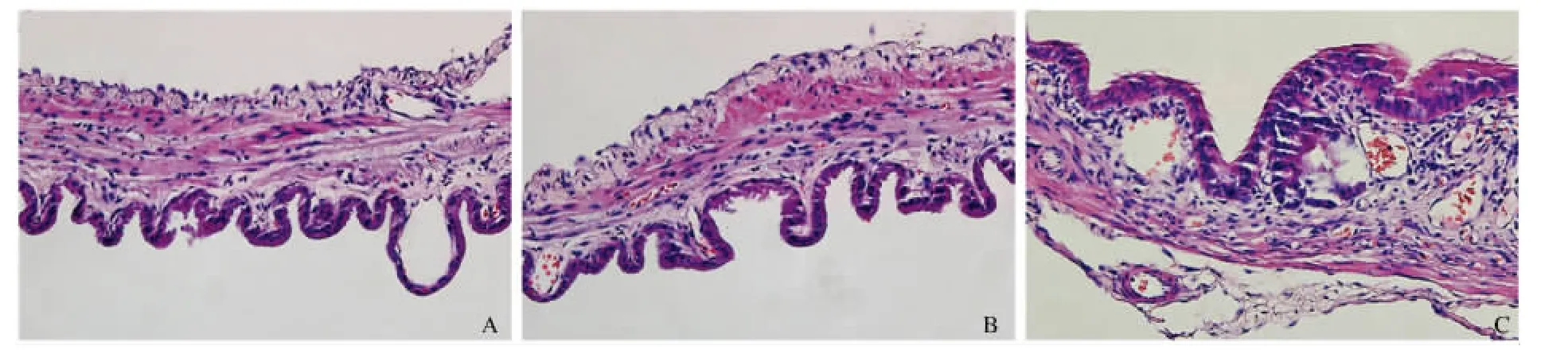
图1 各组豚鼠胆囊组织HE染色(200×)A:正常组;B:Sham组;C:BDL-48 h组Fig1 Photomicrographs of gallbladder samples stained with hematoxylin and eosin in each group(200×)A:normal group;B:sham group;C:BDL-48 h group
2.2 胆囊组织中CSE活性的变化 BDL-48 h组较正常组和Sham组胆囊组织中CSE活性显著增高(P<0.05,见表 1)。
2.3 免疫组化检测CSE蛋白的表达定位 CSE蛋白主要定位于胞质和胞膜。在正常组与Sham组胆囊组织中,CSE免疫阳性主要表达于黏膜上皮组织层、浆膜层;而在BDL-48 h组,CSE蛋白在黏膜层、浆膜层以及血管内皮层均有表达(见图2)。
2.4 免疫印迹法测定CSE蛋白表达变化 正常组与Sham组胆囊组织CSE蛋白表达水平比较,差异无统计学意义(P>0.05),而BDL 48 h后,CSE 蛋白表达显著升高,差异有统计学意义(P<0.05,见表1、图3)。
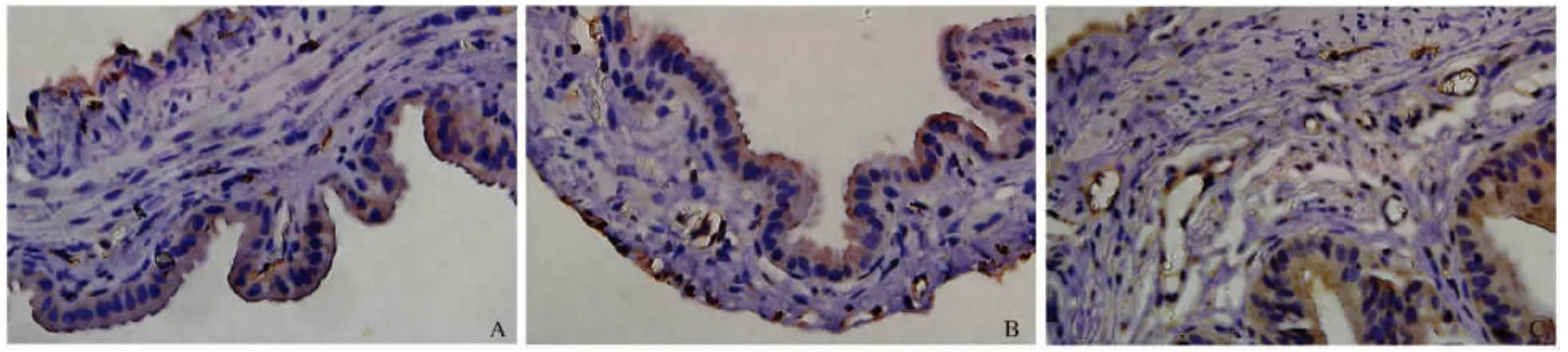
图2 各组豚鼠胆囊组织CSE阳性细胞(400×)A:正常组;B:Sham组;C:BDL-48 h组Fig2 Representative sections for CSE staining in gallbladder tissues in each group(400×)A:normal group;B:sham group;C:BDL-48 h group
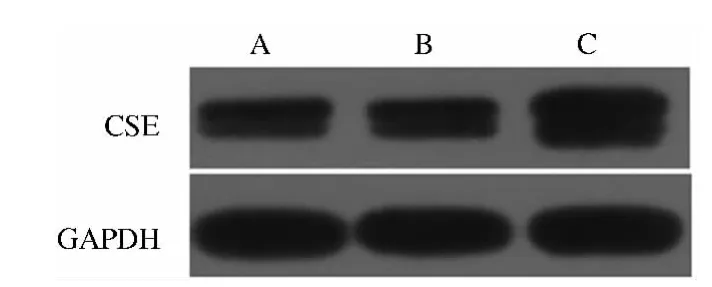
图3 Western blotting检测各组鼠胆囊组织CSE蛋白表达A:正常组;B:Sham组;C:BDL-48 h组Fig3 CSE proteins expression of guinea pig gallbladder in each group A:normal group;B:sham group;C:BDL-48 h group
表1 各组豚鼠胆囊组织炎症评分、CSE活性和CSE蛋白表达()Tab1 Inflammation score,CSE activity and CSE protein expression in gallbladder tissue of guinea pigs from different groups()
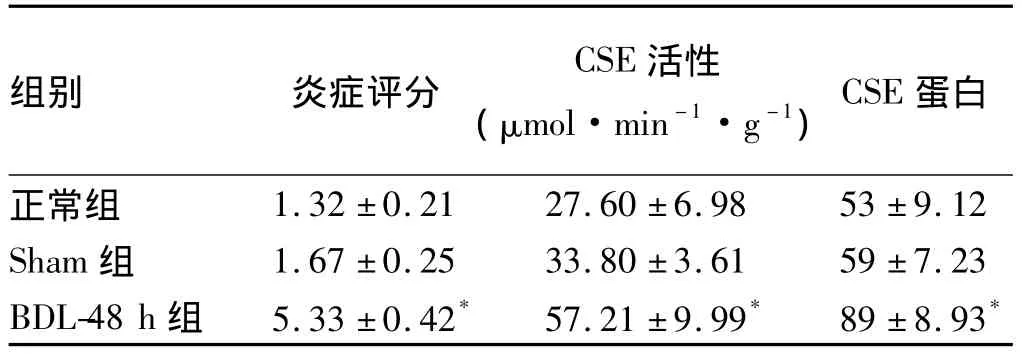
表1 各组豚鼠胆囊组织炎症评分、CSE活性和CSE蛋白表达()Tab1 Inflammation score,CSE activity and CSE protein expression in gallbladder tissue of guinea pigs from different groups()
注:与正常组和Sham组比较,*P<0.05。
组别 炎症评分CSE活性(μmol·min-1·g-1)CSE蛋白1.32 ±0.21 27.60 ±6.98 53 ±9.12 Sham 组 1.67 ±0.25 33.80 ±3.61 59 ±7.23 BDL-48 h 组 5.33 ±0.42* 57.21 ±9.99* 89 ±8.93正常组*
3 讨论
本研究通过组织化学以及免疫印迹方法,证实豚鼠胆囊组织中存在合成内源性H2S的关键酶CSE。文献[6]报道,CBS和CSE在小鼠结肠黏膜组织均有表达,但仅CSE可表达于外肌层与肌间神经丛。Schicho等[7]研究显示,CBS和CSE广泛表达于人类黏膜下层和肠肌层的神经元,但不表达于人结肠上皮细胞。我们的研究表明,CSE可以在胆囊黏膜上皮层、浆膜层以及血管内皮层表达。这些结果表明CSE在体内的表达存在种属差异和分布差异。
急性非结石性胆囊炎(AAC)是指影像学、术中及病理学检查胆囊内无结石,却存在明显炎症的胆囊疾病[8]。AAC的病理基础包括胆囊血管系统变化、组织缺血坏死、细菌感染以及胆汁淤积。BDL是构建AAC有效且常用的动物模型[3]。本实验 HE染色显示,BDL 48 h后,胆囊组织急性炎症状态明显增加,与Soylu 等[3]的研究结果一致。
H2S具有抗炎和促炎双重效应。预防性给予NaHS可以降低非甾体类抗炎药(NSAID)所致的胃黏膜血流减少以及白细胞在血管的黏附。然而在角叉菜胶致大鼠足跖肿胀、急性胰腺炎、内毒素血症以及严重感染性休克的实验模型中[2],H2S则表现出明显的促炎作用。Zanardo等[9]指出 H2S产生于机体炎症部位,可以抑制白细胞黏附血管内皮组织并减少炎性细胞浸润和水肿形成。H2S通过激活NF-κB的转录活性促进急性胰腺炎的发生[10];在冠状动脉粥样硬化的进展中,H2S可以抑制NF-κB活性,从而减少炎症产生[11]。由此推测,H2S的抗炎或促炎作用与动物模型以及产生部位有关。本研究发现,在正常胆囊组织,CSE主要表达于黏膜上皮层和浆膜层;而在AAC模型组,胆囊组织血管增生、中性粒细胞浸润,CSE蛋白在黏膜层、浆膜层以及血管内皮层均有表达,且模型组的CSE活性以及CSE蛋白表达量显著高于正常组,表明H2S/CSE体系与胆囊炎症有关。另外,CSE在血管内皮的表达增高可能提示,H2S在白细胞的黏附、浸润过程中起抑制或促进作用。
近年来研究证实,H2S在调节胃肠动力[12]、保护肠缺血再灌注损伤[13]等方面有非常重要的作用。外源性H2S通过激活ATP敏感钾通道降低豚鼠胃的自发性收缩;而内源性H2S则抑制电压依赖性钾通道促进胃平滑肌运动[12]。硫氢化钠预处理后,大鼠小肠的缺血再灌注损伤减少,可能的机制是H2S激活钙激活钾通道使肠道黏膜细胞的线粒体损伤降低[13]。赵梦等[14]研究显示,胆管梗阻后,胆囊平滑肌肌条对各种兴奋性神经递质的效应性降低,而产生的原因与胆囊的炎症程度密切相关[15]。我们推测,炎症部位产生的H2S可能影响胆囊平滑肌的收缩功能,具体机制有待进一步研究。
综上可见,胆囊组织存在合成H2S的关键酶CSE。H2S/CSE体系可能参与了AAC的炎症、动力改变等病理过程。
[1]Stipanuk MH,Beck PW.Characterization of the enzymic capacity for cysteine desulphhydration in liver and kidney of the rat[J].Biochem J,1982,206(2):267-277.
[2]Wang R.Physiological implications of hydrogen sulfide:a whiff exploration that blossomed[J].Physiol Rev,2012,92(2):791-896.
[3]Soylu S,Aydin C,Bagcivan I,et al.Effects of NO/L-arginine pathway on gallbladder contractility in bile duct ligated guinea pigs[J].J Surg Res,2009,155(1):70-76.
[4]McCarthy J,O'Mahony L,O'Callaghan L,et al.Double blind,placebo controlled trial of two probiotic strains in interleukin 10 knockout mice and mechanistic link with cytokine balance[J].Gut,2003,52(7):975-980.
[5]Zhang H,Moochhala SM,Bhatia M.Endogenous hydrogen sulfide regulates inflammatory response by activating the ERK pathway in polymicrobial sepsis[J].J Immunol,2008,181(6):4320-4331.
[6]Linden DR,Sha L,Mazzone A,et al.Production of the gaseous signal molecule hydrogen sulfide in mouse tissues[J].J Neurochem,2008,106(4):1577-1585.
[7]Schicho R,Krueger D,Zeller F,et al.Hydrogen sulfide is a novel prosecretory neuromodulator in the Guinea-pig and human colon [J].Gastroenterology,2006,131(5):1542-1552.
[8]Zhou L,Ke MY.Gastrointestinal motility[M].Beijing:Science Press,1999:293-303周吕,柯美云.胃肠动力学[M].北京:科学出版社,1999:293-303.
[9]Zanardo RC,Brancaleone V,Distrutti E,et al.Hydrogen sulfide is an endogenous modulatorofleukocyte-mediated inflammation [J].FASEB J,2006,20(12):2118-2120.
[10]Tamizhselvi R,Shrivastava P,Koh YH,et al.Preprotachykinin-A gene deletion regulates hydrogen sulfide-induced toll-like receptor 4 signaling pathway in cerulein-treated pancreatic acinar cells[J].Pancreas,2011,40(3):444-452.
[11]Wang Y,Zhao X,Jin H,et al.Role of hydrogen sulfide in the development of atherosclerotic lesions in apolipoprotein E knockout mice[J].Arterioscler Thromb Vasc Biol,2009,29(2):173-179.
[12]Zhao P,Huang X,Wang ZY,et al.Dual effect of exogenous hydrogen sulfide on the spontaneous contraction of gastric smooth muscle in guinea-pig[J].Eur J Pharmacol,2009,616(1-3):223-228.
[13]Liu Y,Kalogeris T,Wang M,et al.Hydrogen sulfide preconditioning or neutrophil depletion attenuates ischemia-reperfusion-induced mitochondrial dysfunction in rat small intestine[J].Am J Physiol Gastrointest Liver Physiol,2012,302(1):G44-G54.
[14]Zhao M,Yu BP,Xiao Y,et al.Effects of acute acalculous cholecystitis induced by bile duct ligation on the contraction of extracorporea l gallbladder smooth muscle of guinea pigs[J].Chin J Gastroenterol Hepatol,2010,19(3):230-233.赵梦,余保平,肖勇,等.胆道梗阻诱发急性胆囊炎对豚鼠胆囊平滑肌收缩的影响[J].胃肠病学和肝病学杂志,2010,19(3):230-233.
[15]Parkman HP,Bogar LJ,Bartula LL,et al.Effect of experimental acalculous cholecystitis on gallbladder smooth muscle contractility[J].Dig Dis Sci,1999,44(11):2235-2243.

