乙型肝炎后肝硬化失代偿期患者的临床病理分析
谢能文,何金秋,肖影群,曹 涌
南昌市第九医院肝病科,江西 南昌 330002
我国是乙型肝炎高发区,失代偿期肝硬化的5年病死率约为70% ~86%[1-2]。目前关于乙型肝炎后肝硬化失代偿期患者肝脏组织病理学特点的研究鲜有报道。我们通过对82例乙型肝炎后肝硬化失代偿期行脾切除术患者的临床资料与其肝组织病理对照分析,探讨乙型肝炎后肝硬化失代偿期患者肝脏组织炎症活动度及其与血清HBV DNA载量、HBeAg和临床生化参数间的相关性。
1 资料与方法
1.1 一般资料 选取2010年1月-2012年12月在南昌市第九医院行脾切除术的乙型肝炎后肝硬化失代偿1期患者82例,诊断依据2010年《慢性乙型肝炎防治指南》[1],均经临床和病理检查证实,男69例,女13例;平均年龄(49±8)岁;并排除其他病毒性肝炎、酒精性肝炎、药物性肝炎、脂肪肝、自身免疫性肝炎。本研究方案入选患者均知情同意取肝组织活检,临床资料完整。对患者临床资料和肝组织病理资料进行回顾性分析。
1.2 方法
1.2.1 实验室检查:血清ALT、TBIL应用日本OLYMPUS AU640全自动生化分析仪,试剂盒由德赛诊断系统(上海)有限公司提供;PT采用Sysmex CA6000全自动凝血分析仪,试剂盒由成都协和生物技术有限公司提供;HBV血清标记物采用ELISA法检测,ELISA试剂采用中山生物技术有限公司生产的试剂。血清HBV DNA定量检测采用ABI 7300实时荧光定量PCR仪(美国ABI公司生产),试剂盒由深圳匹基生物有限公司提供,HBV DNA≥103copies/ml为阳性。所有操作严格按说明进行。依据生化和临床指标计算Child-Pugh评分。
1.2.2 病理组织学检查:脾切除术中留取患肝,肝组织经4%甲醛溶液固定、脱水、石蜡包埋、切片,行苏木精-伊红(HE)染色、网状纤维和Masson染色,光镜下组织学观察。肝脏炎症活动度和纤维化程度按《病毒性肝炎防治方案》[3]的标准进行判定,病理医师阅片诊断,病理证实为肝硬化S4期,将肝组织病变炎症活动度分为G0-1、G2、G3和G4四级。
1.3 统计学分析 应用SPSS 13.0数据分析软件进行统计学分析。符合正态分布的连续变量以表示,组间比较采用t检验或方差分析;非正态分布连续变量用中位数和四分位数表示,组间比较采用秩和检验;率的比较采用行*列表资料的χ2检验;临床指标、肝功能评分与肝脏组织炎症活动度的相关性分析采用Spearman秩相关。P<0.05为差异有统计学意义。
2 结果
2.1 肝组织病理照片 部分肝组织病理图片见图1,其中肝脏组织炎症活动度G0-1级患者30例(36.6%),肝组织病理表现为肝小叶结构完整,肝板排列整齐,小叶内少数点灶状坏死,少数淋巴细胞浸润,汇管区不扩大,少数炎症细胞浸润(见图 1A);G2级 33例(40.2%),肝组织病理表现为肝细胞胞浆疏松,气球样变,小叶内多数点灶状坏死,汇管区扩大,轻度界面炎,多数炎症细胞浸润,汇管区周围细胆管反应增生(见图1B);G3级12例(14.6%),肝组织病理表现为小叶内多数灶状坏死、融合性坏死,汇管区明显扩大,中度界面炎,汇管区周围细胆管反应增生明显(见图1C);G4级7例(8.5%),小叶结构失常,肝板排列不整,多个小叶桥接坏死,重度界面炎,汇管区周围细胆管反应增生明显(见图1D)。
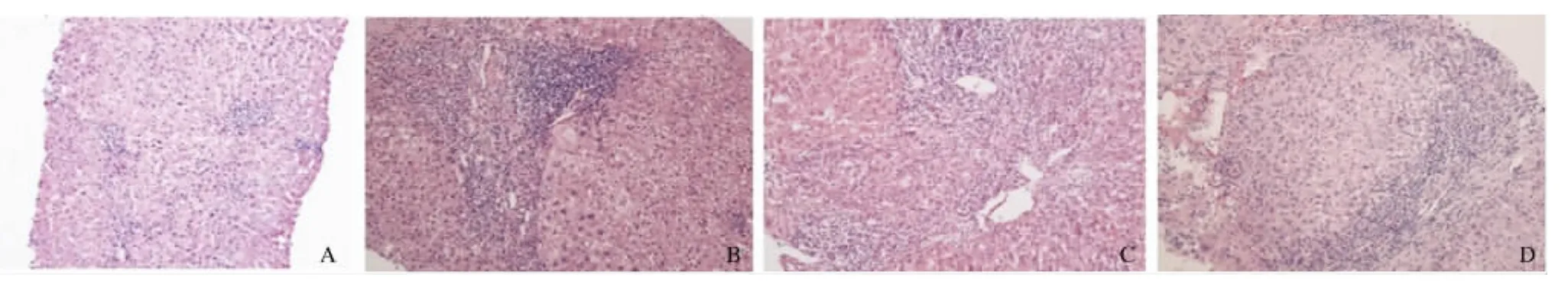
图1 肝组织病理图片(HE 100×)A:G1患者;B:G2患者;C:G3患者;D:G4患者Fig1 Patients with liver tissue pathological picture(HE 100×)A:G1 patients;B:G2 patients;C:G3 patients;D:G4 patients
2.2 入组患者一般情况 共纳入乙型肝炎后肝硬化失代偿期行脾切除术患者82例,其中ALB(30.0±4.9)g/L;ALT(52 ±32)U/L;TBIL(35.9 ±7.6)μmol/L;脾切除前腹水患者33例(40.2%);伴有上消化道出血者8例(9.7%);Child-Pugh A 级患者 43 例(52.4%),B 级35例(42.7%),C 级4 例(4.9%)。入组患者脾切除前5例既往未抗病毒治疗,77例患者使用核苷类抗病毒药物抑制乙型肝炎病毒复制,其中15例(18.3%)使用恩替卡韦抗病毒治疗,12例(14.6%)使用阿德福韦联合拉米夫定,10例(12.1%)单用阿德福韦酯,其余40例(48.8%)单用拉米夫定,10例患者抗病毒治疗时间超过5年,接受抗病毒时间最长为9年半,39例患者的治疗时间不足半年。脾切除术前HBeAg阳性患者24例(29.3%)。
2.3 临床生化指标与肝脏组织炎症活动度相关性经Spearman等级相关分析显示,血清ALB与肝组织炎症活动度呈负相关(r= -0.405,P <0.01),随着肝组织炎症增加趋于下降,PT与肝脏组织炎症活动度呈正相关(r=0.340,P <0.01),随着肝脏组织炎症活动度的增加而呈延长趋势,而性别、年龄、血清 ALT、TBIL、Child-Pugh评分、腹水均不能反映肝脏组织炎症活动度(见表1)。
2.4 血清HBV DNA载量、HBeAg与肝组织炎症病理分期相关性 将常用血清病毒载量分为<1000、1000~100000、>100000(copies/ml)3级,并统计病毒载量分级与肝脏炎症活动度的关系。由表2可以看出,随病毒载量的增加,肝脏炎症并非越重,血清HBV DNA载量<1000 copies/ml者的与1000~100000 copies/ml、>100000 copies/ml者肝脏组织炎症活动度相比,差异无统计学意义(χ2=0.16,P > 0.05),乙型肝炎后肝硬化失代偿期患者肝脏组织炎症活动度随着血清HBV DNA载量的增高而无明显升高的趋势。由表3可得出血清HBeAg阳性者与阴性者肝脏组织炎症活动度相比,差异无统计学意义(χ2=0.01,P>0.05),说明血清HBV DNA载量和HBeAg阳性并不能反映肝脏组织炎症活动度。
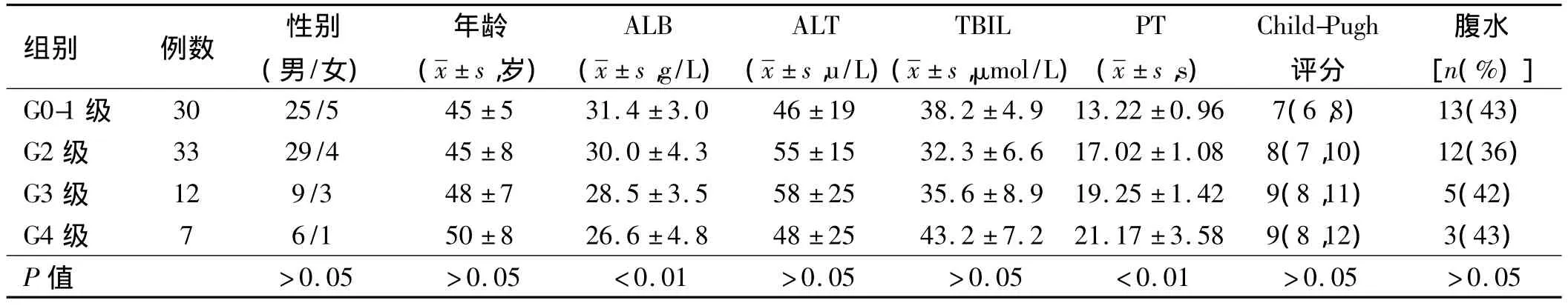
表1 不同肝脏组织炎症活动度的乙型肝炎后肝硬化失代偿期患者资料分析Tab1 Data of different liver tissue inflammation activity of hepatitis B patients with decompensated cirrhosis

表2 不同血清HBV DNA载量与肝脏组织炎症活动度关系的比较Tab2 Comparison of relationship between different serum HBV DNA load and the liver tissue inflammation activity
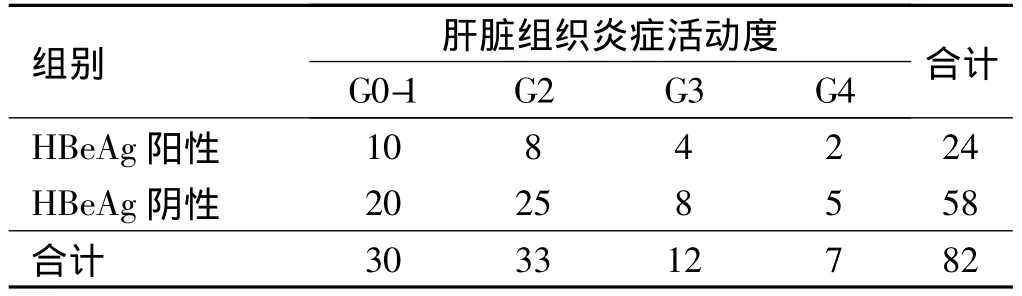
表3 HBeAg阳性组与HBeAg阴性组肝脏组织炎症活动度关系的比较Tab3 Comparison of liver inflammation activity between HBeAg positive group and HBeAg negative group
3 讨论
从本研究显示,尽管血清ALT、TBIL对肝损伤极为敏感,但升高幅度与肝组织病变的严重程度并不呈一致关系,影响病情分析与判断,这可能与这些病例早期使用过降酶保肝药物有关,影响病情分析与判断,在分析时应将近期肝功能改变情况、药物治疗情况加以综合考虑。同时,患者肝硬化失代偿程度随着肝脏组织炎症活动度的增加而增加,主要表现为PT延长、ALB下降。但本研究中发现Child-Pugh评分、腹水并不能反应肝脏组织炎症活动度,主要是因为选择脾切除手术的患者多为Child-Pugh A级、B级,黄疸大多轻度偏高、腹水不多。因此,有关乙型肝炎后肝硬化失代偿期患者肝脏组织炎症活动度和Child-Pugh评分的关系尚待进一步观察研究。
其次,血清HBeAg阳性者与阴性者相比,肝脏组织炎症活动度差异无统计学意义(χ2=0.01,P>0.05),血清HBeAg阳性患者病毒复制较为活跃,且以血清HBV DNA检测水平作为病毒复制的指标,但血清学HBeAg转阴并不能说明乙型肝炎病毒复制、肝脏炎症活动停止,部分HBeAg阴性患者同样存在HBV的复制,其特点是对目前治疗方案的持续应答率低、复发率高、自发缓解率低、临床转归差。此血清HBeAg阴性者大多存在前C区或核心启动子区(BCP)的基因突变,常见突变包括前C区1896位G-A替换,导致提前出现终止密码子TAG,不表达HBeAg。以及1762位A-T和1764位的G-A替换,影响前C区mRNA转录,减少HBeAg合成而表现为HBeAg阴性。BCP突变后,HBV DNA复制增加。慢性乙型肝炎、肝硬化和肝癌患者中88% ~100%有BCP突变[4-5]。血清HBV DNA载量<1000 copies/ml者的肝脏组织炎症活动度与1000~100000 copies/ml、>100000 copies/ml者相比,差异无统计学意义(χ2=0.16,P >0.05),表明乙型肝炎后肝硬化失代偿期患者肝脏组织炎症活动度与血清HBV DNA载量无明显相关性,这和Kim等[6]报道的血清HBV DNA含量和肝组织炎症活动分级无关是相一致的。因为HBV感染后主要通过机体对病毒的免疫应答而导致肝细胞的损伤[7],虽然病毒的存在激发体内免疫系统的应答,但病毒量的高低和机体的免疫应答强度无直接关系。因此,不能单凭血清HBeAg、HBV DNA完全判定肝损伤情况,对此类患者制定治疗方案时需结合肝组织病理结果,以免延误治疗时机[8]。
研究进一步发现,高达76.8%(63/82)的乙型肝炎后肝硬化失代偿期患者肝脏组织仅有轻度活动性炎症(G0-1、G2级),这可能与目前随着慢性乙型肝炎抗病毒治疗理念的不断推广,现在越来越多的慢性乙型肝炎患者接受了抗病毒治疗有关。本研究82例患者中有77例接受核苷类药物抗病毒治疗,其中21例患者血清HBV DNA转阴,10例患者抗病毒治疗时间超过5年。国外多项研究发现失代偿期肝硬化患者服用核苷类抗病毒药物的时间至少6个月才能改善其预后,且一旦患者肝硬化失代偿进展至终末期,即使长期抗病毒治疗,亦可能无法改善病情[9-10]。本研究中多达39例患者的治疗时间不足半年,因此,虽然高达77.4%(72/82)的患者病毒载量低,但由于抗病毒治疗时间较短不能改变其肝硬化失代偿。由此可见,核苷类抗病毒药物治疗的疗程不足、未能早期抗病毒治疗以致部分患者肝硬化失代偿严重程度已无法由抗病毒治疗改善等多因素的作用,可能是导致乙型肝炎后肝硬化失代偿患者虽然外周血生化指标和病毒学指标趋于正常,但导致病情持续进展的原因。
本研究结果表明,乙型肝炎病毒持续复制和肝脏炎性反应坏死是肝炎肝硬化病情进展的主要决定因素[11]。无论肝硬化患者体内病毒复制水平如何,均应进行抗病毒治疗,而且应当重视早期治疗,特别是在早期肝硬化阶段和出现失代偿倾向时及时阻止疾病进展。尽管抗病毒治疗不能改变肝炎肝硬化失代偿期的最终结局,但能通过抑制病毒复制,改善肝功能,提高患者的生存质量,有效抗病毒治疗可明显减轻患者肝脏组织活动性炎症,从而改善临床症状、减少肝硬化失代偿并发症的发生,延长患者等待肝移植时间,降低肝移植率和死亡率[12]。
[1]Chinese Society of Hepatology,Society of Infectious Diseases.The guideline of prevention and treatment for chronic hepatitis B(2010 edition)[J].Chin J Infect Dis,2011,29(2):65-80.中华医学会肝病学分会、中华医学会感染病学分会.慢性乙型肝炎防治指南(2010年版)[J].中华传染病杂志,2011,29(2):65-80.
[2]Zhang LX.Improve the level of chronic hepatitis B prevention-read the chronic hepatitis B prevention guide[J].Med J Chin PLA,2006,31(5):377-378.张玲霞.提高慢性乙型肝炎防治水平-解读《慢性乙型肝炎防治指南》[J].解放军医学杂志,2006,31(5):377-378.
[3]Chinese Society of Infectious Diseases and Parasitology and Chinese So-ciety of Hepatology of Chinese Medical Association.Prevention and treatment program for viral hepatitis[J].Chin J Hepatol,2000,8(6):324-329.中华医学会传染病与寄生虫病学分会、肝病学分会.病毒性肝炎防治方案[J].中华肝脏病杂志,2000,8(6):324-329.
[4]Nakashima H,Furusyo N,Kubo N,et al.Double point mutation in the core promoter region of hepatitis B virus(HBV)genotype C may be related to liver deterioration in patients with chronic HBV infection[J].J Gastroenterol Hepatol,2004,19(5):541-550.
[5]Manesis EK,Papatheodoridis GV,Sevastianos V,et al.Significance of hepatitis B viremia levels determined by a quantitative polymerase chain reaction assay in patients with hepatitis B e antigen-negative chronic hepatitis B virus infection[J].Am J Gastroenterol,2003,98(10):2261-2267.
[6]Kim JD,Choi JY,Bae SH,et al.Hepatitis B virus load in serum does not reflect histologic activity in patients with decompensated cirrhosis[J].Clin Gastroenterol Hepatol,2010,8(1):60-65.
[7]Duan HC,Fan ZL,Wang XH,et al.The role and progress of the immunocyte in the formation of liver cirrhosis with HBV[J].Chin J Gastroenterol Hepatol,2010,19(9):780-782.段惠春,范仲麟,王学红,等.免疫细胞在乙肝肝硬化形成中的作用及研究进展[J].胃肠病学和肝病学杂志,2010,19(9):780-782.
[8]Tang YH,Xie JM,Liang YQ,et al.Analysis of relationship between HBeAg and HBV DNA levels and grading of liver inflammation in patients with chronic hepatitis B[J].Chin J Infect Dis,2005,23(5):338-341.唐跃华,谢健敏,梁玉全,等.慢性乙型肝炎患者血清HBeAg、HBV DNA与肝组织炎症关系的探讨[J].中华传染病杂志,2005,23(5):338-341.
[9]Das K,Das K,Datta S,et al.Course of disease and surviva1 after onset of decompensation in hepatitis B virus-related cirrhosis[J].Liver Int,2010,30(7):1033-1042.
[10]Fontana RJ,Hann HW,Perrillo RP,et al.Determinants of early mortality in patients with decompensated chronic hepatitis B treated with antiviral therapy [J].Gastroenterology,2002,123(3):719-727.
[11]Zhuang Y,Xie Q.Hepatitis B cirrhosis antiviral treatment of new ideas[J].Chin J Dig,2012,32(8):567-570.庄焱,谢青.乙型肝炎肝硬化抗病毒治疗的新观点[J].中华消化杂志,2012,32(8):567-570.
[12]Singal AK,Fontana RJ.Meta-analysis:oral anti-viral agents in adults with decompensated hepatitis B virus cirrhosis[J].Aliment Pharmacol Ther,2012,35(6):674-689.

