聚普瑞锌诱导HSP70保护大鼠胃黏膜损伤
杨晓鸥,钱家鸣,陈 蔷
1.中国医学科学院北京协和医学院北京协和医院消化内科,北京 100730
热休克蛋白70(heat shock protein 70,HSP70)是热休克蛋白家族中主要的蛋白之一。HSP70存在于人及动物的胃黏膜,胃黏膜在受到外源性刺激(如乙醇等)后将迅速合成HSP70,在急性胃黏膜损伤过程中具有保护作用。聚普瑞锌是L-肌肽与锌的螯合物,可以诱导热休克蛋白的产生,从而发挥抗损伤的作用。
1 材料与方法
1.1 动物 Sprague-Dawley大鼠(SD),购自北京大学医学部实验动物科学部,许可证号:SCXL(京)2006-0008。
1.2 药物 聚普瑞锌原料药粉末,由吉林省博大伟业制药有限公司提供。将聚普瑞锌粉末溶于1.5%羧甲基纤维素(购自 Sigma公司)溶液中(Carboxymethyl cellulose,CMC),分别配置 100 mg/kg、200 mg/kg 浓度药物备用。
1.3 方法
1.3.1 实验动物:雄性SD大鼠20只,体质量200~250 g,饲养于标准环境温度(22℃ ±2℃)和湿度(55% ±5%),及12 h明暗周期交替的标准动物实验室,自由饮食。并于动物适应环境后1周开始实验。
1.3.2 实验分组:20只大鼠随机分为4组,每组5只。空白对照组5只:自由饮食,于第3天处死5只,处死前24 h禁食,不禁水。实验组每组5只,所有动物均于实验前24 h禁食,不禁水;CMC组:1 ml无水乙醇灌胃,1 h后1 ml 1.5%CMC灌胃,此后每天同一时间连续灌胃2 d,并于最后一次给药后1 h处死动物;聚普瑞锌100 mg/kg治疗组:1 ml无水乙醇灌胃,1 h后1 ml聚普瑞锌100 mg/kg灌胃,此后每天同一时间灌胃2 d,并于最后一次给药后1 h处死动物;聚普瑞锌200 mg/kg治疗组:1 ml无水乙醇灌胃,1 h后1 ml聚普瑞锌200 mg/kg灌胃,此后每天同一时间灌胃2 d,并于最后一次给药后1 h处死动物。处死动物采用腹腔注射过量戊巴比妥钠麻醉致死。
1.3.3 标本取材:各组大鼠处死后,开腹取出全胃。沿胃大弯剪开胃,立即平铺于预先置于冰上的玻璃平皿上,肉眼观察胃黏膜改变情况,并拍照。随后取材胃组织,固定于10%甲醛溶液中6 h,石蜡包埋、切片、HE染色。使用干净的玻片迅速刮取胃黏膜,分别保存于冻存管中,置于液氮保存,长期保存则冻存于-80℃冰箱。
1.3.4 免疫蛋白印迹法(Western blotting)检测大鼠胃黏膜HSP70蛋白的表达:将保存胃黏膜的1.5 ml离心管置于冰上,称取胃黏膜组织重量按比例加入裂解液,剪碎组织,匀浆器15000 r/min进行匀浆。匀浆时EP管需要浸入冰水混合物中进行降温。匀浆完成后在冰上孵育20 min,4 ℃离心,13000 r/min,20 min。离心完成后取上清,分装保存,待测。目的蛋白经10%SDSPAGE凝胶电泳后,转膜。抗-HSP70(abcom,England)(1∶1000稀释)抗体孵育、过夜。二抗山羊抗兔IgG(1∶10000稀释)孵育、洗膜、曝光。用软件 Labworks 4.6对结果进行灰度分析。
1.3.5 酶联免疫法(ELISA)方法检测大鼠胃黏膜胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1):大鼠麻醉过程中迅速心脏取血,离心;使用IGF-1ELISA试剂盒(Medignost GmbH,Aspenhaustr.Germany)检测血清中IGF-1含量。
1.3.6 酶联免疫法(ELISA)方法检测大鼠胃黏膜超氧化物歧化酶(superoxide dismutase,SOD)活性:上述方法刮取大鼠胃黏膜,在Tris-Hcl缓冲液(pH 7.4)中匀浆,4℃,10000 r/min,30 min离心,取上清;使用SOD检测试剂盒(Cayman chemical company,USA)检测SOD活性。
1.4 统计学分析 应用SPSS 11.5统计软件进行统计。数据以表示,采用One-Way ANOVA进行分析,并采用Bonferroni检验进行多重比较,P<0.05为差异有统计学意义。
2 结果
2.1 各实验组胃黏膜大体及病理表现 与空白对照组相比,1 ml无水乙醇灌胃后,给予聚普瑞锌100 mg/kg 1 ml治疗3 d,胃黏膜大体和镜下均恢复较好。1 ml无水乙醇灌胃后,给予聚普瑞锌200 mg/kg 1 ml灌胃治疗3 d,胃黏膜大体和病理均恢复完好。而给予CMC 3 d的大鼠胃黏膜未见明显变化(见图1)。
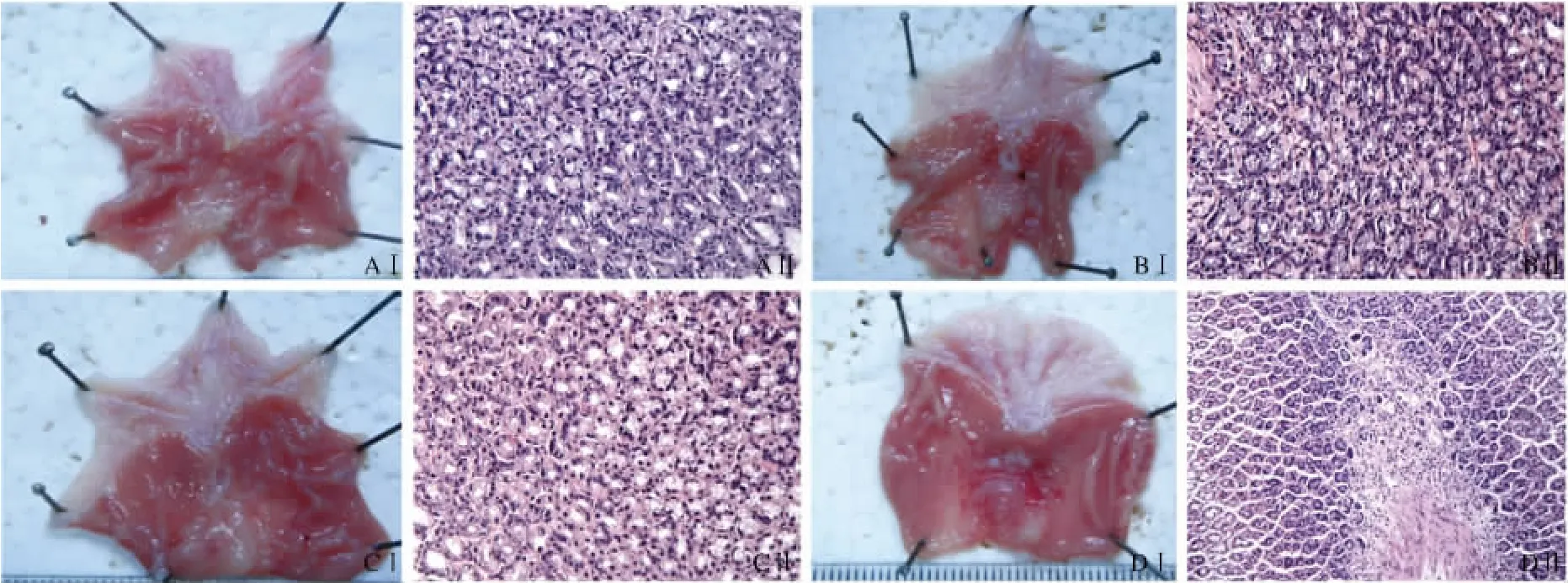
图1 各实验动物组胃黏膜大体表现(Ⅰ)与病理表现(Ⅱ)(HE染色400×)A:空白对照组;B:CMC组;C:聚普瑞锌100 mg/kg治疗组;D:聚普瑞锌200 mg/kg治疗组Fig1 The gross appearance of gastric mucosa(Ⅰ)and pathology(Ⅱ)in each experimental animal group A:Blank control group;B:CMC group;C:Polaprezinc 100 mg/kg treatment group;D:Polaprezinc 200 mg/kg treatment group
2.2 各实验组HSP70表达 采用Western blotting方法,聚普瑞锌100 mg/kg治疗组、200 mg/kg治疗组治疗3 d时大鼠胃黏膜HSP70表达的相对灰度值分别为278.3% ±10.8%、471.1% ±24.7%,与空白组(100%)和 CMC 组(153.3% ±3.2%)比较,差异有统计学意义(P 均 <0.01,见图2~3)。
2.3 各实验组血清IGF-1含量 空白对照组、CMC组、聚普瑞锌100 mg/kg治疗组和聚普瑞锌200 mg/kg治疗组血清 IGF-1含量分别为(1.35 ±0.093)ng/ml、(1.269 ± 0.372)ng/ml、(1.489 ± 0.159)ng/ml 和(1.427 ±0.142)ng/ml,各组之间 IGF-1 含量差异无统计学意义(P >0.05)。
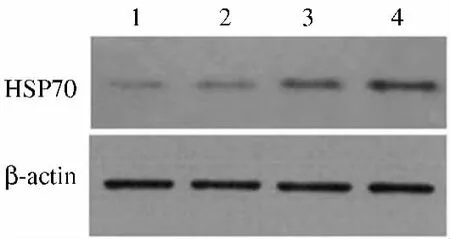
图2 各实验组大鼠胃黏膜HSP70表达电泳图 1.空白对照组;2.CMC组;3.聚普瑞锌 100 mg/kg治疗组;4.聚普瑞锌200 mg/kg治疗组Fig2 Expression of HSP70 in each group 1.control group;2.vehicle group;3.Polaprezinc 100 mg/kg treatment group;4.Polaprezinc 200 mg/kg treatment group
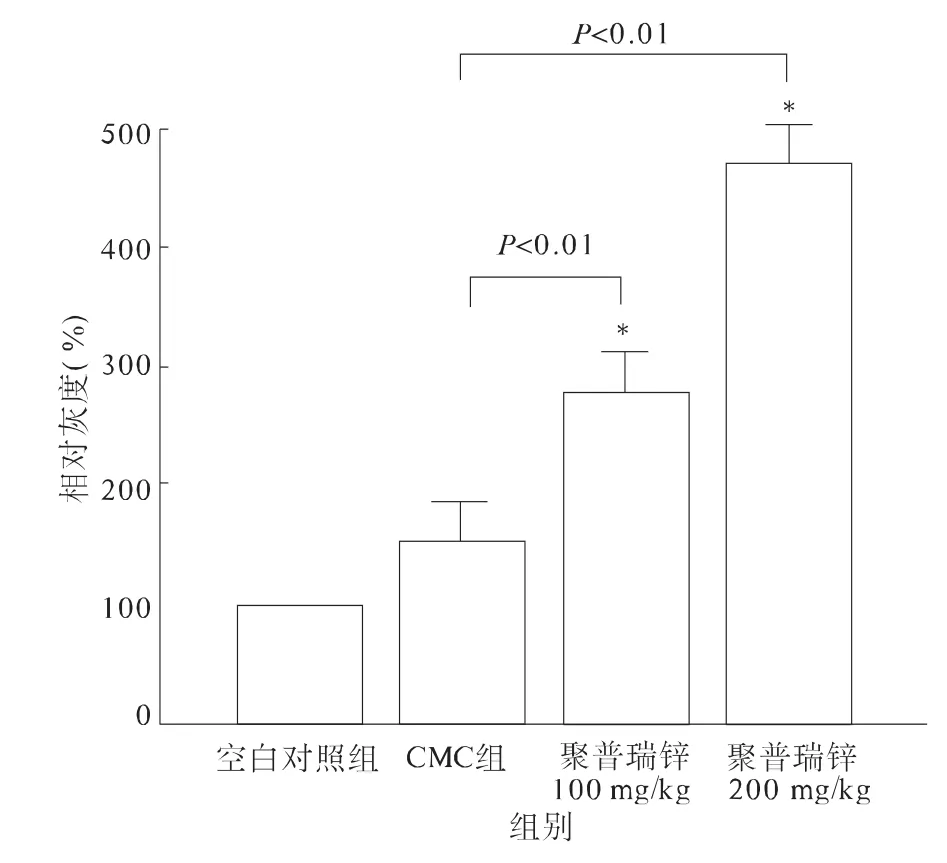
图3 各实验组大鼠胃黏膜HSP70表达灰度图Fig3 HSP70 expression relative density of each group
2.4 各实验组胃黏膜SOD的活性 空白对照组、CMC组、聚普瑞锌100 mg/kg治疗组和聚普瑞锌200 mg/kg治疗组胃黏膜SOD活性分别为(48.68±7.80)U/ml、(46.52 ± 2.79)U/ml、(57.04 ± 6.52)U/ml和(55.97 ±8.00)U/ml,各组之间 SOD 活性差异无统计学意义(P >0.05)。
3 讨论
HSPs是一种进化上高度保守的细胞应激蛋白,广泛存在于几乎所有的原核和真核细胞中[1]。HSPs具有分子伴侣功能,所谓“分子伴侣”是指能够结合和稳定另外一种蛋白质的不稳定构象,并能通过有控制的结合和释放,促进新生多肽链的折叠,多聚体的装配或降解及细胞器蛋白跨膜转运的一类非常保守的蛋白质[2]。目前认为,HSP70是该家族中主要的伴侣蛋白之一。HSP70分子具有伴侣功能的主要原因基于其与ATP的亲和性,其与变性蛋白多肽结合后,依赖ATP水解释放出能量来解开多肽链的错误折叠,使其再次成熟为细胞内的正常蛋白,进而使细胞的功能和结构得到恢复[2]。同时它又可以作为一种内源性保护物质对脏器损伤产生自身保护作用[3]。
HSP70存在于人及动物的胃黏膜,胃黏膜在受到外源性刺激(如乙醇等)后将迅速合成HSP70,在急性胃黏膜损害过程中具有保护作用。HSP70的诱导表达在发挥分子伴侣作用的同时,亦可以防止应激导致的细胞凋亡,抑制蛋白激酶JNK(一种细胞凋亡的调节因子)的活化。因此可以认为HSP70是细胞凋亡的抑制剂[4]。另外由NSAIDs药物消炎痛引起的大鼠胃黏膜损伤的实验研究中,检测到了HSP70 mRNA的表达上调;与野生株大鼠相比,敲除了热休克蛋白基因的大鼠HSP70 mRNA表达显著降低。另外对比消炎痛对HSP70转基因大鼠和野生大鼠造成的胃黏膜溃疡发生,HSP70转基因大鼠溃疡发生较轻;同时证明HSP70抑制了NSAIDs药物引起体外培养细胞的细胞凋亡[5]。
聚普瑞锌是L-肌肽与锌的螯合物,可以诱导HSPs的产生,从而发挥抗溃疡的作用。锌作为重金属元素,它能激活存在于HSP70启动区的金属响应要素[6]。因此认为锌是通过激活HSPs基因转录而诱导HSP的合成。研究表明聚普瑞锌对大鼠急性溃疡模型如水浸法,盐酸乙醇、组胺、无水乙醇引起的溃疡,幽门结扎阿司匹林性溃疡,低温拘束应急性溃疡,烫伤应激性溃疡,利血平性溃疡,AAPH胃黏膜损伤及缺血再灌注膜损伤都有抑制作用。除了与L-肌肽组成聚合物发挥作用,其中微量元素锌是诱导HSPs产生的有效成分[7],锌本身作为身体必需的微量元素在不同生物系统和生理过程中发挥着至关重要的作用。如治愈创伤;促进细胞形成、生长和代谢;稳定细胞膜;维护正常的糖代谢和脂代谢;同时是DNA和RNA聚合酶依赖的元素,以及维持正常的酒精代谢。锌元素通过上述功能影响细胞增殖和蛋白质合成,因此在组织的修复过程中发挥着至关重要的作用。反之,在胃黏膜损伤的过程中,锌缺乏就会导致创伤愈合的延迟。同时由于锌和L-肌肽聚合物的特性使得其在胃液中分解率很慢,因此聚普瑞锌可在胃中存留较长时间并持续发挥修复作用。研究表明锌是聚普瑞锌诱导HSP70产生的有效成分,减轻由对乙酰氨基酚引发大鼠的肝细胞毒性反应[8]。聚普瑞锌在多个研究中证实对酒精致胃肠黏膜损伤的动物模型具有保护作用。其作用机理包括维持黏膜的稳定[9]、刺激黏液生成[10]、抗氧化[11],以及诱导热休克蛋白的产生并发挥一系列胃黏膜保护作用。
HSPs的细胞保护作用为药物治疗提供了新的治疗模式。由于HSP在多种病理生理条件下有着很好的对抗应激产生的胃黏膜损伤作用,因此L-肌肽与锌的螯合物作为HSP诱导剂来发挥保护胃黏膜,削减应激性刺激对黏膜的进一步损伤。在本研究中,造模3 d后CMC组HSP70的蛋白表达稍高于空白对照组,说明造模后HSP70在无水乙醇致胃黏膜损伤后应激性的产生,发挥保护作用。将聚普瑞锌应用于损伤后大鼠胃黏膜,HSP70的蛋白表达显著高于CMC组,即聚普瑞锌诱导大量HSP70产生,以加速对胃黏膜损伤的修复。那么应用2倍剂量的聚普瑞锌作用于胃黏膜,HSP70的总量增加,与CMC组相比,作用同样显著(P<0.01)。聚普瑞锌治疗胃黏膜损伤是否为剂量依赖,还需更深入的研究。CMC组也有HSP70的产生,但不足以对抗损伤,聚普瑞锌持续诱导HSP70的产生是对抗损伤的关键。早前的研究显示应用聚普瑞锌后2~3 h即可诱导大量HSP70产生[7]。在聚普瑞锌诱导HSP70的时效性方面的研究还有待开展。
Odashima等[12]报道,通过直肠内给予锌衍生物(锌L型肌肽)类药诱导热休克蛋白的产生,抑制NF-κB的灭活来提高对肠黏膜的保护功能。
酒精是导致胃黏膜损伤的主要致病因素,其引发的胃黏膜损伤包括急性和慢性胃炎、溃疡等。近年来研究发现,HSP蛋白在细胞水平的胃黏膜防御机制方面发挥着作用。HSP70的诱导产生可以保护乙醇致大鼠发生的胃黏膜损伤[13]。研究表明HSP70是通过使丝裂原活化蛋白激酶(MAPK)失活,从而减弱酒精对胃黏膜的损伤[14]。
聚普瑞锌对胃黏膜损伤发挥的其他保护机制有:聚普瑞锌作用于受损的胃上皮细胞和成纤维母细胞,可以诱导间充质细胞表达IGF-1,通过旁分泌途径促进胃上皮细胞修复;因此提示IGF-1在胃黏膜损伤中发挥重要作用;从而为深入探讨聚普瑞锌在细胞水平上发挥的细胞机理提供了依据。由弗氏佐剂诱导的大鼠导致的胃溃疡大鼠研究也提示,聚普瑞锌可诱导IGF-1生成增加而使胃黏膜损伤减轻[15]。本研究中检测胃黏膜IGF-1的含量,聚普瑞锌治疗组呈现了IGF-1水平升高的趋势,但差异无统计学意义,文献报道多为检测胃黏膜上皮细胞IGF-1 mRNA水平的表达[15],故推测在外周血中IGF-1的生成不甚明显,有待在方法学上进行改进。含有锌元素的氨丙酰组氨酸类药物可以通过增加胃黏膜SOD等酶的合成来清除氧自由基,从而使由乙醇导致的胃黏膜损伤得以修复[16]。本研究中检测了胃黏膜SOD的合成,聚普瑞锌治疗组SOD水平稍高于未治疗组,但差异无统计学意义。国外有关聚普瑞锌治疗大鼠胃黏膜损伤的研究中,多用SD大鼠和Wistar大鼠,部分研究也使用DA大鼠作为实验动物;本研究使用SD大鼠进行实验。本研究与国外报道不同,可能与所用动物品系以及数量有关。
综上所述,聚普瑞锌通过诱导HSP产生来发挥保护胃黏膜损伤的作用。分子伴侣作用、抗凋亡以及细胞保护是HSP保护胃黏膜损伤的主要机制。在诱导IGF-1和SOD产生并修复胃黏膜损伤也起到一定的作用。
[1]Hendrick JP,Hartl F.Molecular chaperone functions of heat-shock protein[J].Ann Rev Biochem,1993,62:349-384.
[2]Gething MJ,Sanlbroo KJ.Protein folding in the cell[J].Nature,1992,355(6355):33-45.
[3]Nomura F,Aoki M,Forbess L,et al.Myocardial self-preservative effect of heat shock protein70 on an immature lamb heart[J].Ann Thorac Surg,1999,68(5):1736-1741.
[4]Shen XZ,Koo MW,Cho CH.Sleep deprivation increase the expression of inducible heat shock protein70 in rat gastric mucosa[J].World J Gastroenterol,2001,7(4):496-499.
[5]Shintaro S,Ken-Ichiro T,Takushi N,et al.A role for HSP70 in protecting against indomethacin-induced gastric lesions[J].J Biol Chem,2009,284(29):19705-19715.
[6]Wu BJ,Kingston RE,Morimoto RI.Human HSP70 promoter contains at least two distinct regulatory domains [J].Proc Natl Acad Sci,1996,83(3):629-633.
[7]Odashima M,Otaka M,Jin M,et al.Induction of a 72-kDa heat shock protein in cultured rat gastric mucosal cells and rat gastric mucosa by zinc L-carnosine[J].Dig is Sci,2002,47(12):2799-2804.
[8]Tadashi N,Shuzo O,Chiaki K,et al.Zinc Supplementation with polaprezinc protects mouse hepatocytes against acetaminophen-Induced toxicity via induction of heat shock protein 70 [J].Clin Biochem Nutr,2010,46(1):43-51.
[9]Cho CH,Luk CT,Ogle CW.The membranestabilizing action of zinc carnosine(Z-103)in stress-induced gastric ulceration in rats[J].Life Sci,1991,49(23):189-194.
[10]Arakawa T,Satoh H,Nakamura A,et al.Effects of zinc L-carnosine on gastric mucosal and cell damage caused by ethanol in rats.Correlation with endogenous prostaglandin E2 [J].Dig Dis Sci,1990,35(5):559-566.
[11]Yoshikawa T,Naito Y,Tanigawa T,et al.Effect of zinc carnosine chelate compound(Z-103),a novel antioxidant,on acute gastric mucosal injury induced by ischemia-reperfusion in rats[J].Free Radic Res Commun,1991,14(4):289-296.
[12]Odashima M,Otaka M,Jin M,et al.Zinc L-carnosine protects colonic mucosal injury through induction of heat shock protein 72 and suppression of NF-kappaB activation[J].Life Sci,2006,79(24):2245-2250.
[13]Park SW,Oh TY,Kim YS,et al.Artemisia asiatica extracts protect against ethanol-induced injury in gastric mucosa of rats[J].J Gastroenterol Hepatol,2008,23(6):976-984.
[14]Lee JS,Oh TY,Kim YK,et al.Protective effects of green tea polyphenol extracts against ethanol-induced gastric mucosal damages in rats:stress-responsive transcription factors and MAP kinases as potential targets[J].Mutation Res,2005,579(1-2):214-224.
[15]Kato S,Tanaka A,Ogawa Y,et al.Effect of polaprezinc on impaired healing of chronic gastric ulcers in adjuvant-induced arthritic rats-role of insulin-like growth factors(IGF)-1[J].Med Sci Monit,2001,7(1):20-25.
[16]Ito M,Shii D,Segami T,et al.Preventive actions of N-(3-Aminopropionyl)-L-Histidinato Zinc(Z-103)through increases in the activities of oxygen-derived free radical scavenging enzymes in the gastric mucosa on ethanol-induced gastric mucosal damage in rats[J].Japan J Pharmacol,1992,59(3):267-274.

