丝裂霉素在兔离体角膜中的渗透特性研究
王石健,应苗法
0 引言
丝裂霉素是头状链霉菌中分离得到的一种毒副作用少的抗代谢成分,具有苯醌、乌拉坦和乙烯亚胺3种有效基团,在机体内丝裂霉素中的苯酯还原成为双功能烷化基团,可使互补的DNA双键之间产生交叉连接,选择性抑制RNA合成,抑制增殖期DNA复制,对增殖各期细胞和静止期细胞均有抑制作用[1]。临床用于治疗消化道癌、肺癌、肝癌、乳腺癌、结肠直肠癌、胰腺癌等多种肿瘤。丝裂霉素亦可抑制成纤维细胞的增殖及转移,并阻止成纤维细胞产生胶原物质,同时可阻止血管的再生,其抗瘢痕效果优于其他抗代谢药,在眼科领域使用广泛[2-3]。但是丝裂霉素在眼部的应用也伴随着较少见而严重的不良反应[4],主要有角膜水肿、角膜穿孔、眼部感染、巩膜钙化、巩膜软化、巩膜溃疡、虹膜炎、继发性青光眼等。另外,丝裂霉素的稳定性比较差,也限制了其应用的进一步推广。为了克服现有丝裂霉素给药系统的缺点,新型的丝裂霉素眼用给药系统也在不断的开发中[5-8],包括新型滴眼剂、眼用膜剂、眼用温敏凝胶、可降解植入剂等。药物在角膜中的渗透特性对给药后药物在眼部的分布、作用与消除均有重要的影响,是眼部给药系统设计时需要重点考虑的因素。本研究采用兔角膜为模型,使用水平式扩散仪考察了丝裂霉素在离体角膜中的渗透特性,为丝裂霉素新型眼用给药系统的开发提供参考。
1 方法
1.1 仪器和试剂
1.1.1 仪器 高效液相色谱仪,配备G1310A泵,G1314A紫外检测器,7255i手动进样器,TC100柱温箱(Agilient 1100,美国),水平式扩散池(AH-6,上海锴凯科技有限公司,接受室与供应室体积均为4 mL),分析天平(AL204,梅特勒-托利多公司)。
1.1.2 试剂 丝裂霉素对照品(中国药品生物制品检定所,批号:130438-200502),丝裂霉素注射液(浙江海正药业,规格10 mg,批号:120401),谷胱甘肽氧化型(上海生工生物工程有限公司),甲醇为色谱纯(德国默克),其余试剂均为分析纯。
1.1.3 实验动物 新西兰兔(雄性,2 kg左右,浙江省医学科学院)
1.2 色谱条件 色谱柱:Agilent Zorbax C18柱(150 mm × 4.6 mm,5 μm),流动相:甲醇∶水 =70∶30,v/v,流速:1 mL/min,检测波长:365 nm,柱温:40 ℃;进样量:20 μL。
1.3 溶液制备 谷胱甘肽缓冲液的配制[9]:A液:氯化钠12.4 g,氯化钾0.716 g,磷酸二氢钠0.206 g,碳酸氢钠4.908 g,用水溶解并定容至1L;B液:谷胱甘肽氧化型0.184 g,氯化钙0.23 g,氯化镁0.318 g,葡萄糖1.8 g,用水溶解并定容至1 L。分别置4℃保存,临用前混合。
精密称取丝裂霉素对照品约10 mg,用甲醇溶解并定容至25 mL,即得丝裂霉素的对照品贮备液。将对照品贮备液适当稀释即得丝裂霉素的对照品溶液。
1.4 系统适应性试验 分别取空白接受液、丝裂霉素对照品溶液和样品溶液20 μL进样,记录色谱图,考察释放介质及其他角膜浸出物质对丝裂霉素的测定有无干扰。
1.5 标准曲线 用甲醇将丝裂霉素贮备液稀释成浓度为 0.2、1、2、5、10、20 μg/mL 的溶液,分别进样,记录峰面积。以峰面积(C)对浓度(C)进行线性回归,绘制标准曲线。
1.6 回收率 分别取丝裂霉素贮备液适量,用空白接收液稀释成浓度为1、5、10 μg/mL的溶液,HPLC测定,计算回收率。
1.7 精密度与稳定性 分别取用空白接收液稀释成浓度为 1、5、10 μg/mL 的丝裂霉素溶液,HPLC连续测定6次,记录丝裂霉素的峰面积,计算RSD,考察精密度;取浓度为5 μg/mL的丝裂霉素溶液在温室下12 h内不同时间HPLC测定,记录丝裂霉素的峰面积,计算RSD,考察稳定性。
1.8 离体角膜渗透实验
1.8.1 离体角膜的制备 新西兰兔耳缘静脉注射空气处死后,立即使用眼科镊和手术刀分离角膜,除去巩膜、虹膜、睫状体等组织,置于4℃谷胱甘肽缓冲液中备用。
1.8.2 角膜渗透试验 取新鲜制备的离体角膜,置于水平式扩散池的供应室和接收室之间,角膜外侧面朝向供应室。在接受室内加入4 mL谷胱甘肽缓冲液作为接收液,供应室内加入0.02%丝裂霉素溶液4 mL,水浴温度设置34℃,磁力搅拌速度为 250 r/min。分别在试验开始后 1、2、3、4、6 h取样1 mL,并补充等量同温的新鲜接收液。样品经0.45 μm滤膜过滤后,取续滤液HPLC测定峰面积,按照标准曲线计算浓度,计算累积透过量。以累积透过量对时间作图,即得丝裂霉素在离体角膜的渗透曲线。
1.8.3 渗透特性分析 将所得丝裂霉素的渗透曲线按照不同的动力学方程进行拟合,考察其渗透特性。
2 结果
2.1 系统适应性 丝裂霉素的系统适应性实验结果如图1所示。HPLC测试时间约17 min,丝裂霉素的保留时间约12.5 min,峰形良好,在丝裂霉素的保留时间处无其他杂质干扰测定。

图1 丝裂霉素的高效液相色谱图
2.2 标准曲线 以丝裂霉素的峰面积A对浓度C作线性回归,得标准曲线:A=28.081C+0.719,r=0.999 9,结果显示,丝裂霉素在 0.2~20 μg/mL的范围内线性关系良好,满足测试要求。
2.3 回收率 丝裂霉素回收率的结果如表1所示,结果显示,丝裂霉素在高中低各浓度的回收率良好,平均回收率为99.70%,符合测定要求。
2.4 精密度与稳定性 低中高浓度丝裂霉素精密度试验 RSD分别为 0.62%、0.22%、0.14%(n=6)。结果显示丝裂霉素在各浓度下精密度良好。浓度为5 μg/mL的丝裂霉素在温室下放置,分别于1、2、4、6、8、12 h 测定,RSD 为 0.89%。结果显示丝裂霉素在12 h内稳定。
2.5 角膜渗透试验 丝裂霉素在离体角膜中的渗透性能如图2所示。
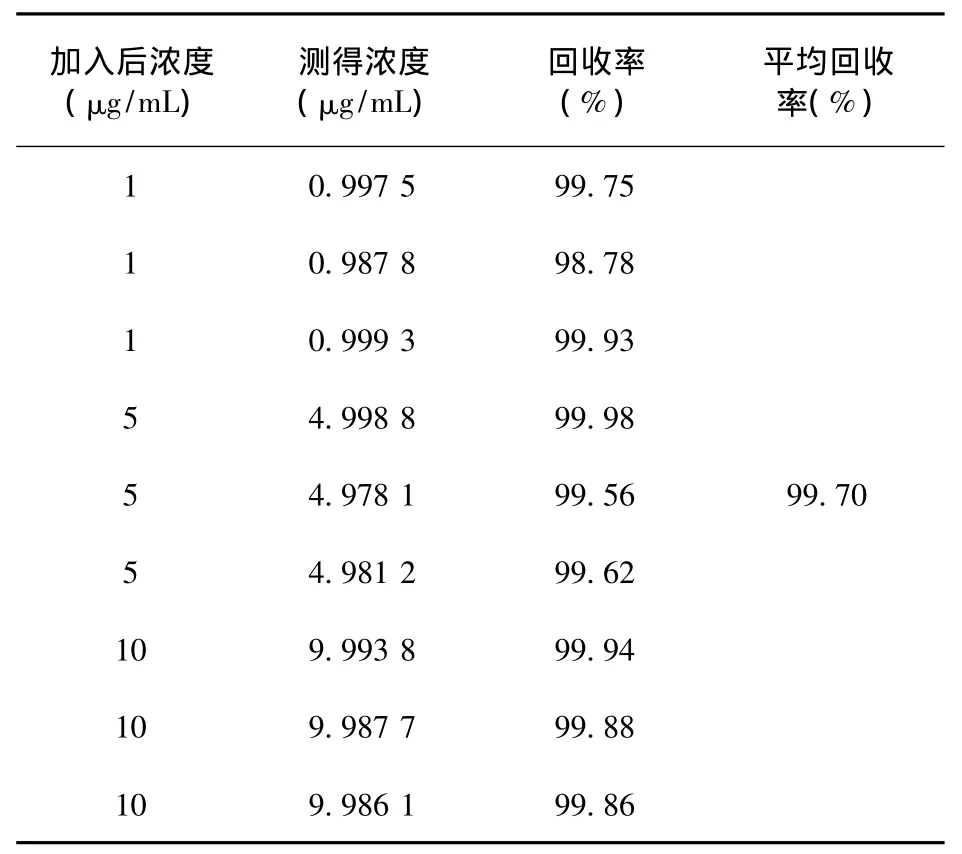
表1 丝裂霉素的回收率
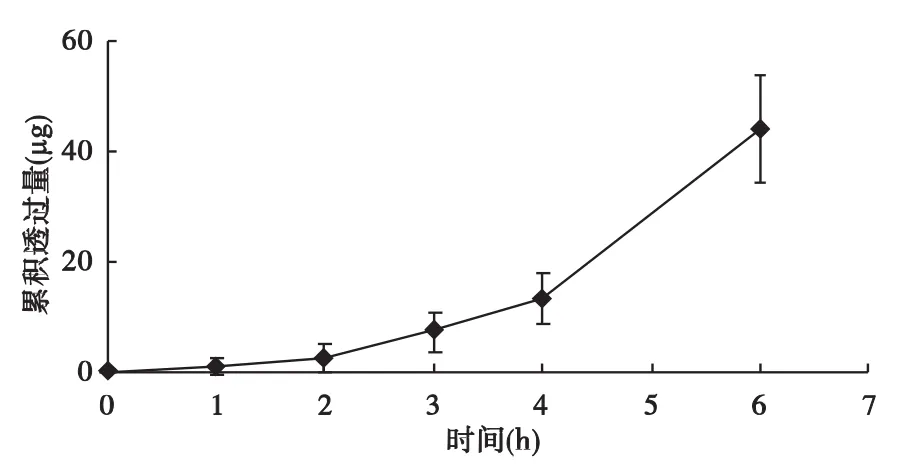
图2 丝裂霉素经过角膜的渗透曲线(n=6)
2.6 分析 将丝裂霉素经过角膜的渗透曲线按照不同的动力学方程进行拟合,结果如表2所示。其中,按照一级动力学方程拟合所获得的相关系数r值最高,故认为丝裂霉素在角膜的渗透符合一级动力学方程。

表2 丝裂霉素渗透特性的拟合结果(n=6)
3 讨论
丝裂霉素紫外吸收较高,一般常采用HPLCUV测定,即可达到精密度和检测限的要求。有文献报道使用梯度洗脱法[9]、缓冲盐溶液作为流动相[10]测定丝裂霉素,操作比较复杂、实验条件要求较高。有报道称使用甲醇和水作为流动相效果良好[11]。本研究采用甲醇∶水(70∶30,v/v)作为流动相,操作简便,而且丝裂霉素在此流动相下保留时间适中,峰形对称,且无杂质干扰,故使用此流动相进行分析。丝裂霉素在水中稳定性差,降解较快[12],故本实验的样品在取样后立即进行测定。稳定性试验的结果显示丝裂霉素在12 h内是稳定的,满足测试的要求。
考察药物在离体角膜中的渗透性能,通常采用透皮扩散池进行试验。对于凝胶等半固体眼用制剂,通常采用直立式扩散池进行考察[13-14]。但是对于药物溶液,若使用直立式扩散池,由于角膜表面的液体流动较慢,形成浓度较低的液层,会降低药物的透角膜速度,故考察药物溶液的角膜渗透特性时常采用水平式扩散池[15]。本研究因此采用水平式扩散池考察丝裂霉素的透角膜特性。
在离体角膜的渗透性研究中,通常采用谷胱甘肽缓冲液作为接收液的主要成分[16],因为角膜在此缓冲液中可维持活性长达6 h[17]。接受液不仅需要能够维持角膜的活性,还需要有容纳药物的能力。为了保持在渗透试验过程中的漏槽条件,通常需要加入乙醇等物质增加药物在接受液中的溶解度[19]。由于丝裂霉素的水溶解性良好,在本实验中,单独使用谷胱甘肽缓冲液即可满足漏槽条件。
对于丝裂霉素在离体角膜中的渗透特性的方程拟合,评价标准是拟合方程的回归系数。回归系数越大,说明拟合优度越好,丝裂霉素越可能是按照此种方式透过角膜。本研究采用了三种药物透过介质常见的模型进行拟合,结果显示丝裂霉素经角膜的渗透过程符合一级动力学方程,说明丝裂霉素在角膜的渗透具有一定的时滞,但随着时间的延长,丝裂霉素的渗透速率逐渐增加。这提示我们在设计靶部位在眼内的给药系统时,应设法延长丝裂霉素在泪液中的滞留时间;反之,设计作用于眼表的给药系统时,则应缩短丝裂霉素在泪液中的滞留时间,以免药物进入眼内引起副作用。
由于制剂给药于眼部后的实际情况比较复杂,影响因素较多,例如结膜囊容量有限、泪液引流引起制剂流失或稀释等,离体角膜的渗透试验不能完全说明丝裂霉素在体内经角膜渗透的真实情况。
[1]Santhiago MR,Netto MV,Wilson SE.Mitomycin C:biological effects and use in refractive surgery[J].Cornea,2012,31(3):311-321.
[2]Abraham LM,Selva D,Casson R,et al.Mitomycin:clinical applications in ophthalmic practice[J].Drugs,2006,66(3):321-340.
[3]徐鸿飞,王泓涛,陈云福.丝裂霉素C联合粘弹剂在青光眼小梁切除术中的应用[J].中国临床医学,2012,19(6):670-671.
[4]Hardten DR,Samuelson TW.Ocular toxicity of mitomycin-C[J].Int Ophthalmol Clin,1999,39(2):79-90.
[5]Rodriguez-Agirretxe I,Vega SC,Rezola R,et al.The PLGA implant as an antimitotic delivery system after experimental trabeculectomy[J].Invest Ophthalmol Vis Sci,2013,54(8):5227-5235.
[6]Shao T,Li X,Ge J.Target drug delivery system as a new scarring modulation after glaucoma filtration surgery[J].Diagn Pathol,2011,6:64.
[7]马珂,俞佳,郑水莲,等.丝裂霉素眼用冻干粉的研制及质量控制[J].中国药学杂志,2011,46(20):1587-1590.
[8]李玉清,王朝,黄绳武.丝裂霉素C温敏性眼用凝胶剂的制备研究[J].江西中医学院学报,2012,24(6):64-67.
[9]卢荣枝,唐干益,宫琦.阿昔洛韦眼用凝胶在兔离体角膜中的渗透释药行为研究[J].中国药房,2006,17(4):258-260.
[10]杨西晓,陈建海,郭丹,等.HPLC法测定丝裂霉素C聚氰基丙烯酸正丁酯纳米粒中丝裂霉素C的含量[J].药物分析杂志,2007,27(5):693-695.
[11]高国敬,王登旭,李艳.RAM-HPLC测定兔眼房水中丝裂霉素C的含量[J].中国现代应用药学,2008,25(6):531-533.
[12]张瑶纾,李佩孚,赵明月,等.丝裂霉素稳定性的研究[J].天津医科大学学报,2001,7(3):344-346.
[13]Ostacolo C,Caruso C,Tronino D,et al.Enhancement of corneal permeation of riboflavin-5'-phosphate through vitamin E TPGS:a promising approach in corneal trans-epithelial cross linking treatment[J].Int J Pharm,2013,440(2):148-153.
[14]张卫,钟华玉,唐瑞嫦,等.氟啶酸眼用缓释凝胶的制备及释药研究[J].广东药学,2005,15(4):28-30.
[15]Yao WJ,Sun KX,Liu Y,et al.Effect of poly(amidoamine)dendrimers on corneal penetration of puerarin[J].Biol Pharm Bull,2010,33(8):1371-1377.
[16]刘睿,刘志东,舒乐新,等.3种渗透促进剂对芒果苷离体角膜透过率的影响[J].中国中药杂志,2010(23):3131-3135.
[17]Saettone MF,Chetoni P,Cerbai R,et al.Evaluation of ocular permeation enhancers:in vitro effects on corneal transport of four$/beta$-blockers,and in vitro/in vivo toxic activity[J].Int J Pharm,1996,142(1):103-113.

