抑肽酶对实验性慢性肝损伤超微结构改变的影响
王 强,王心童,王虹蛟*,孟威宏,颜炜群,任立群
0 引言
关于肝纤维化机制及防治研究,目前是国内外生物学、医学研究的热点之一[1-6]。目前,尚未见到有关抑肽酶对实验性慢性肝损伤肝组织超微结构改变的研究报道。本研究利用四氯化碳(CCl4)建立Wister大鼠慢性肝损伤模型,同时给予抑肽酶,观察其对慢性肝损伤肝组织超微结构改变的保护作用,并对其作用机制进行探讨。
1 材料与方法
1.1 实验动物 Wister大鼠,雌雄兼用,由长春高新医学动物研究中心提供,合格证号:医动字第1055118。
1.2 实验方法
1.2.1 大鼠慢性CCl4肝损伤模型的建立 Wister大鼠,体重190~210 g,雌雄各半,由高新实验动物中心供应。本实验采用新鲜的花生油作为溶剂。将25%CCl4溶解于花生油中混匀。正常对照组仅皮下注射花生油5 mL/kg,其他各组大鼠首次给予CCl4原液5 mL/kg,以后每周2次25%CCl4液(花生油稀释)5 mL/kg皮下注射。禁食,不禁水。
1.2.2 动物分组及给药 (1)第1组为正常对照组:腹腔注射等量生理盐水。(2)第2组为慢性肝损伤模型组:腹腔注射等量生理盐水。(3)第3组为抑肽酶小剂量组:腹腔注射抑肽酶2万KIU/kg。(4)第4组为抑肽酶中剂量组:腹腔注射抑肽酶4万KIU/kg。(5)第5组为抑肽酶大剂量组:腹腔注射抑肽酶8万KIU/kg。(6)第6组为促肝细胞生长素注射液组(阳性组):腹腔注射促肝细胞生长素100 mg/kg。3~5组每天给予抑肽酶一次,连用4周,第6组每天给予促肝细胞生长素1次,连用4周。禁食,不禁水。
1.2.3 肝组织切片制作 固定在4%戊二醛中的肝脏,经过戊二醛-锇酸双重固定,梯度乙醇、丙酮系列脱水,环氧树脂包埋,半薄切片定位,超薄切片,醋酸双氧铀-柠檬酸铅双重染色,透射电镜下观察其超微结构改变。
2 结果
空白对照组肝细胞体积较大,肝细胞面可见细胞连接结构,胆小管两端紧密连接的结构清晰;腔面可见较多微绒毛,肝血窦面微绒毛较多。肝细胞核呈圆形,核仁明显,核内常染色质多。胞质内线粒体、粗面内质网及滑面内质网丰富,可见糖原颗粒和少量溶酶体(图1)。

图1 空白对照组(TEM bar=500 nm)
四氯化碳模型组肝细胞呈肿胀状,细胞界限不清,胆小管两端紧密连接消失;腔面微绒毛减少。肝细胞核呈圆形固缩状;核内异染色质凝聚、趋边;核基质空化。胞质内基质局部空化,细胞器呈絮状或消失,部分线粒体外膜结构模糊,粗面内质网数量减少且呈散在分布(图2)。
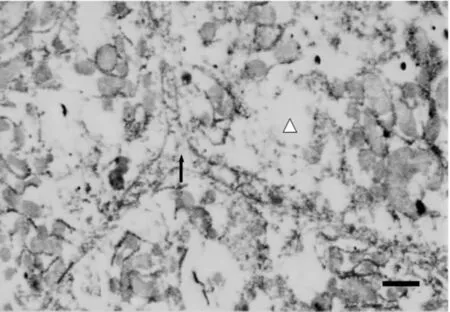
图2 四氯化碳模型组(TEM bar=1μm)
抑肽酶小剂量组肝细胞体积大小不一,个别细胞呈固缩状。胆小管轻度扩张;小管两端连接结构清晰;腔面微绒毛减少,并可见髓样小体。肝细胞核呈圆形,少量异染色质呈块状。胞质内线粒体呈堆分布;粗面内质网较少;部分细胞胞质内可见较多絮状结构、少量脂滴及线粒体肿胀、嵴断裂(图3)。

图3 促肝细胞生长素组(TEM bar=1 μm)
抑肽酶中剂量组肝细胞体积稍大;胆小管两端紧密连接结构清楚;腔面微绒毛较多。核呈圆形,核仁明显,可见少量块状的异染色质。胞质内线粒体数量多;粗面内质网较多且平行排列,呈堆分布;可见大量糖原聚集,偶见脂褐素颗粒(图4)。
抑肽酶大剂量组肝细胞结构接近空白对照组,细胞体积较大,细胞界限清楚;胆小管结构正常。肝细胞核较大,呈圆形,核膜清晰;核内常染色质多,可见少量小块状的异染色质;核仁多个。胞质内可见大量线粒体;粗面内质网丰富,呈平行排列;可见少量糖原颗粒(图5)。

图4 抑肽酶小剂量组(TEM bar=1 μm)

图5 抑肽酶中剂量组(TEM bar=1 μm)
促肝细胞生长素组肝细胞体积大小不等,细胞界限可辨;胆小管腔面微绒毛较多。细胞核呈圆形,核仁1个,呈圆形。胞质内线粒体、粗面内质网较多,可见少量糖原颗粒,偶见呈絮状的细胞器结构(图6)。
3 讨论

图6 抑肽酶大剂量组
肝纤维化是肝硬化病变发展过程中的一个重要环节,肝纤维化的发生机制是复杂的病理过程,肝细胞外基质的合成与降解处于动态失衡,即细胞外基质的合成增多或者降解减少可致细胞外基质沉积,最终诱发肝纤维化的形成。早期的纤维化是可逆的,但到后期有再生结节形成时则不可逆。肝纤维化的高危因素有肾素、血管紧张素系统(Reninangiotensin system,RAS)、基质金属蛋白酶(Matrix metalloproteinase,MMPS)、血小板源性生长因子(Plateletderived growth factor,PDGF)和转化生长 因 子 β (Transforming growth factor-beta,TGFβ)。除此之外,肝硬化的一些病因也是肝纤维化的致病因素,如病毒性肝炎、酒精中毒、高半胱氨酸血症、毒物和一些药物等。肝脏疾病已经被确定为世界健康问题中重要之一,很多因素可以导致肝脏病毒感染,包括药物和毒物,肝缺血再灌注。CCl4是一种传统的肝毒素,在动物实验中被广泛用于诱导肝脏损伤,通过阻断或延缓炎症反应过程和凋亡从而阻止或治疗。氧化应激反应在CCl4诱导肝毒性损伤发挥重要的作用。大量研究表明,CCl4主要用于肝损伤,因为其主要代谢高活性三氯甲基自由基。CCl4诱导肝毒性损伤的另一个重要的病理机制是炎症反应。已有报道在CCl4诱导急性肝毒性损伤中观察到严重的肝细胞凋亡反应[7-14]。抑肽酶是一种有效的抗纤维蛋白溶解酶,其可以抑制多种丝氨酸蛋白酶,特别是血纤维蛋白溶酶、胰蛋白酶、凝乳蛋白酶、凝血酶和激肽释放酶,除此之外,其还可以单独抑制纤维蛋白溶解,具有抗炎作用,能降低白细胞激活作用和抑制细胞因子释放。动物实验结果表明,这种抑制炎性反应甚至可以提高神经反应,但此结果在人体研究中未得到证实。而且人类研究结果表明,其可能会降低中风发生率。广谱抑肽酶在多个丝氨酸蛋白酶凝固和溶解纤维蛋白方面被认为是赖氨酸类似物。抑肽酶于1993年在美国被FDA首次批准使用,用在冠状动脉旁路移植中减少失血作用。德国批注其为抑肽酶,在心脏和非心脏手术中有着非常重要的减少出血的作用[15-18]。本实验结果显示,抑肽酶对大鼠慢性CCl4肝损伤模型具有很好的保护性作用,能明显减轻慢性肝损伤的程度,抑制肝纤维化的发展。其作用机制还不清楚,但从本实验的结果可以认为,是从减轻肝细胞的损伤及抑制肝纤维化的发展两个方面对慢性肝损伤起到保护性作用。
[1]Posadas SJ,Caz V,Caballero I,et al.Effects of mannoprotein E1 in liquid diet on inflammatory response and TLR5 expression in the gut of rats infected by Salmonella typhimurium[J].BMC Gastroenterol,2010,10(1):58.
[2]Greif F,Ben-Ari Z,Taya R,et al.Dual effect of erythropoietin on liver protection and regeneration after subtotal hepatectomy in rats Liver[J].Transpl,2010,16(5):631-638.
[3]Ellett JD,Atkinson C,Evans ZP,et al.Murine Kupffer cells are protective in total hepatic ischemia/reperfusion injury with bowel congestion through IL-10[J].J Immunol,2010,184(10):5849-5858.
[4]王虹蛟,张馨木,常淑芳,等.抑肽酶对小鼠急性肝损伤的保护作用[J].中国实验诊断学,2005,9(3):420-421.
[5]孟威宏,王虹蛟,张馨木,等.口服抑肽酶对大鼠急性肝损伤的保护作用[J].吉林大学学报医学版,2006,32(3):370-372.
[6]王虹蛟,孟威宏,王强,等.抑肽酶对实验性慢性肝损伤的保护作用[J].中国实验诊断学,2008,12(1):4-7.
[7]Haas S.Aprotinin-A Blood-Saving Substance[J].Infus Ther Transfus Med,2002,29:151-155.
[8]Williams R.Global challenges in liver disease[J].Hepatology,2006,44:521-526.
[9]Sun H,Chen L,Zhou W,et al.The protective role of hydrogenrich saline in experimental liver injury in mice[J].J Hepatol,2011,54:471-480.
[10]Jamshidzadeh A,Fereidooni F,Salehi Z,et al.Hepatoprotective activity of Gundelia tourenfortii[J].J Ethnopharmacol,2005,101:233-237.
[11]Dong D,Zhang S,Yin L,et al.Protective effects of the total saponins from Rosa laevigata Michx fruit against carbon tetrachloride-induced acute liver injury in mice[J].Food Chem Toxicol,2013,62C:120-130.
[12]Suresh Kumar SV,Mishra SH.Hepatoprotective effect of Pergularia daemia(Forsk.)ethanol extract and its fraction[J].Indian J Exp Biol,2008,46:447-452.
[13]Geetha S,Jayamurthy P,Pal K,et al.Hepatoprotective effects of sea buckthorn(Hippophae rhamnoides L.)against carbon tetrachloride induced liver injury in rats[J].J Sci Food Agric,2008,88:1592-1597.
[14]Luster MI,Simeonova PP,Gallucci RM,et al.Role of inflammation in chemical-induced hepatotoxicity[J].Toxicol Lett,2001,120:317-321.
[15]Levy JH.Antifibrinolytic therapy:new data and new concepts[J].Lancet,2010,376:3-4.
[16]Graham EM,Atz AM,Gillis J,et al.Differential effects of aprotinin and tranexamic acid on outcomes and cytokine profiles in neonates undergoing cardiac surgery[J].J Thorac Cardiovasc Surg,2012,143:1069-1076.
[17]Ishibashi N,Iwata Y,Zurakowski D,et al.Aprotinin protects the cerebral microcirculation during cardiopulmonary bypass[J].Perfusion,2009,24:99-105.
[18]Turkoz A,Cigli A,But K,et al.The effects of aprotinin and surgery[J].Caudiothorac Vasc Anesth,2001,15(5):603-610.

