吸入布地奈德联合口服乙酰半胱氨酸对特发性肺纤维化细胞因子的影响
楼翰健,吴春玲
0 引言
特发性肺纤维化(IPF)是一种原因不明、出现在成人、局限于肺、进行性致纤维化的间质性肺炎,其组织病理学和放射学表现为普通型间质性肺炎(UIP)。由于其发病机制不清,诊断复杂,迄今对肺纤维化尚无满意的治疗方法。既往治疗IPF的药物以糖皮质激素、细胞毒药物、免疫抑制剂及抗纤维化的药物为主,其中临床应用最广泛的是糖皮质激素。但糖皮质激素长期口服或静脉给药引起的不良反应较多,且治疗效果差。2011年最新特发性肺纤维化诊断和治疗循证指南已经把单用糖皮质激素作为强烈不推荐[1]。
糖皮质激素激素联合乙酰半胱氨酸作为弱不推荐类药物,可以用于IPF的治疗。本研究采用吸入布地奈德气雾剂,并联合口服乙酰半胱氨酸治疗IPF,取得了一定的疗效,报道如下。
1 资料与方法
1.1 一般资料 选取我科2007年1月至2012年12月住院治疗的IPF患者60例,其中男42例,女18例,年龄37~78岁,平均年龄(61.5±9.3)岁,病程1~10年,平均(4.4±0.9)年。在取得患者知情同意下,随机分为治疗组(吸入布地奈德气雾剂和口服乙酰半胱氨酸组)和对照组(口服强的松组)。两组性别构成、年龄、病程差异无统计学意义。入组时两组患者都无继发细菌或病毒等病原体感染存在,所有患者符合中华医学会呼吸病学分会2002年制定的特发性肺间质纤维化诊断标准并确诊,主要临床特征:病因不明;病程>3个月;以干咳和进行性呼吸困难为主要临床表现;双肺底部可闻及吸气相Velcro啰音;胸部高分辨率CT显示肺间质网格状阴影和磨玻璃样改变,部分呈现蜂窝状改变;经组织活检不支持其他肺纤维化改变。
1.2 治疗方法 两组患者均给予常规的氧疗、祛痰等治疗及对症处理,治疗组吸入布地奈德气雾剂(200 μg/喷,100 喷/瓶,阿斯利康制药有限公司)每次2喷,每日4次,同时给予口服乙酰半胱氨酸(浙江康恩贝制药)600 mg/次,3次/d;对照组口服强的松片,0.5 mg/(kg·d),4周后减量至0.25 mg/(kg·d),8 周后 0.125 mg/(kg·d)维持治疗,疗程6个月,分别进行症状、肺功能与血气的评价,并观察不良反应。同时检测细胞因子IFNγ和IL-4水平。
1.3 观察指标 (1)症状的评价:参考Hugh-Jones呼吸困难评分标准,分为5级:0级:各种体力活动与同龄健康人无差别;1级:步行与健康人相似,上楼、爬坡有呼吸困难;2级:不能和健康人用同速走平路,但用自己的速度能行l km;3级:如不边走边歇,则不能行走50 m以上;4级:休息时亦感气短。同时对患者的肺功能进行评价并检测血气、血细胞因子等指标
1.4 统计学方法 采用SPSS 19.0软件进行统计分析,计量资料以±s表示,两组患者采用配对t检验进行治疗前后比较,两组之间对比采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组症状改善情况 治疗前两组患者呼吸困难评分差异无统计学意义(P>0.05)。治疗后两组患者呼吸困难评分均有所改善,与治疗前比较差异有统计学意义(P<0.05),治疗组改善尤为明显,与对照组比较差异有统计学意义(P<0.05),见表1。
2.2 肺功能改善程度 两组患者治疗后肺功能指标均较前有所改善(P<0.05),但两组间治疗前与治疗后比较差异无统计学意义(P>0.05),见表2。
表1 两组患者治疗前后呼吸困难评分比较(±s)
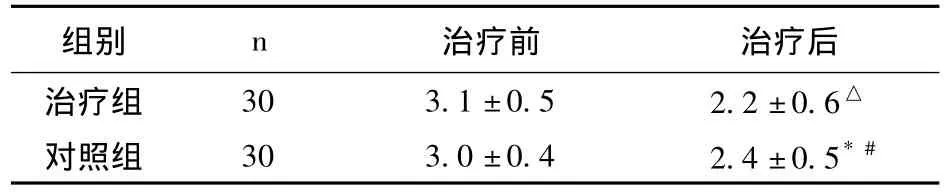
表1 两组患者治疗前后呼吸困难评分比较(±s)
注:与治疗前比较,△t=2.232,△P <0.05,*t=2.193,*P <0.05;与治疗组比较,#t=2.058,P <0.05
组别 n 治疗前 治疗后治疗组 30 3.1±0.5 2.2±0.6△对照组 30 3.0±0.4 2.4±0.5*#
2.3 血气比较 两组患者治疗前血气PaO2水平无明显差异,治疗后两组患者均显著改善,治疗后治疗组与对照组比较,PaO2水平改善尤为明显,差异有统计学意义(P<0.05),见表3。
表2 两组患者治疗前后肺功能指标比较(±s)

表2 两组患者治疗前后肺功能指标比较(±s)
注:与本组治疗前比较,*P<0.05
组别 n TLC(%)治疗前 治疗后FEV1/FVC(%)治疗前 治疗后DLCO(%)治疗前 治疗后治疗组 30 45.8±9.7 65.4±13.7* 56.7±5.3 72.6±6.9* 45.2±6.1 68.3±14.2*对照组 30 46.7±8.6 64.3±12.5* 55.9±6.1 70.8±7.1* 43.6±7.2 66.8±15.1*

表3 两组患者治疗前后血气比较(mmHg)
2.4 细胞因子水平变化 治疗前,IFNγ和IL-4两组患者比较差异无统计学意义,治疗后,两组IFNγ均较治疗前有所下降,治疗组尤其明显,与对照组比较差异有统计学意义。治疗后IL-4水平有所升高,治疗组升高尤其明显,与对照组比较差异有统计学意义,见表4。
2.5 不良反应 对照组出现5例血糖升高,2例消化道出血,3例血压升高,3例电解质紊乱及2例骨质疏松。治疗组出现1例血糖升高,1例高血压,3例胃肠道不适,均无严重不良反应发生。
表4 IFNγ和 IL-4水平比较(±s)

表4 IFNγ和 IL-4水平比较(±s)
注:与本组治疗前比较,*P<0.05;与对照组比较,#P<0.05
组别 n IFNγ(ng/L)治疗前 治疗后IL-4(ng/L)治疗前 治疗后IFNγ/IL-4治疗前 治疗后治疗组 30 202±42 175±48*# 284±82 352±79*# 0.72±0.42 0.48±0.31*#对照组 30 198±37 185±57* 279±67 314±82* 0.72±0.38 0.59±0.44*
3 讨论
在IPF发病机制研究中,越来越多的研究者认为,Thl/Th2失衡在病情的发展中起着至关重要的作用[2-5]。IFNγ是 Thl重要的细胞因子,IL-4是Th2重要的细胞因子。本研究显示,IPF患者在治疗后,不管采用哪种治疗方式,IFNγ水平下降,IL-4水平升高,提示与病情的转归、发展有重要的关系。虽然指南认为除了肺移植,没有哪一种药物能够有效治疗IPF,但也有很多研究证实,某些药物如吡非尼酮、乙酰半胱氨酸等可能对 IPF有利[6]。最新研究表明,氧化-抗氧化失衡可能在IPF的进程中起一定的作用。激活的炎症细胞积聚在下呼吸道并释放大量的活性氧产物,可导致肺实质损伤和间质纤维化。Daniil[7]的研究证实,肺纤维化的程度与机体所处的氧化应激水平呈正相关。还原性谷胱甘肽(GSH)是一种调节因子,作为抗氧化剂发挥作用,但是IPF患者肺泡上皮细胞表面GSH缺乏,由于乙酰半胱氨酸是主要的抗氧化物谷胱甘肽合成的前体,可在体内转化成谷胱甘肽,增加肺内谷胱甘肽的水平,有助于IFP治疗,能够提高IPF患者的综合疗效[8]。欧洲6国的36个中心开展的多中心、随机、双盲、安慰剂对照Ⅲ期试验(IFIGENIA),提示了高剂量NAC并联合泼尼松及硫唑嘌呤,可以通过提高GSH水平改善肺的抗氧化剂保护作用并改善肺功能,比单独标准治疗更好,是IPF患者合理的治疗选择,但是由于有30%的患者未完成试验,三药联合治疗方案存在一定的争议[9]。另外研究发现,IPF患者肺中抗氧化物质(GSH、SOD、CAT)含量明显减少,肺功能与机体氧化应激水平呈负相关,也间接证实了氧化-应激失衡是IPF的重要原因之一[10]。
本病目前尚无特效疗法,肾上腺糖皮质激素和细胞毒药物仍是基层医院主要的治疗药物,而肾上腺糖皮质激素依然是首选,尤其是在IPF早期,糖皮质激素尚能抑制中性粒细胞、淋巴细胞向肺移动,降低免疫复合物水平,改变肺泡巨噬细胞功能,阻止肺泡炎的发展,可能取得一定的临床疗效。但Raghu等[11]认为,单用糖皮质激素治疗IPF的疗效研究的结论,均非糖皮质激素与安慰剂的随机对照试验(RCT),没有高质量的前瞻性研究适合作Meta分析,所以没有临床证据支持单用糖皮质激素治疗IPF的有效性。免疫抑制剂过去常与糖皮质激素联合作为常规用药用于IPF的治疗,另外,抗纤维化药物秋水仙碱、D-青霉胺和吡啶酮类化合物等均被用来治疗IPF,但是均没有取得很好的效果,相比单用糖皮质激素并不对IPF患者增加利益。朱晨等[12]通过动物研究证实,在肺纤维化早期局部使用布地奈德可以明显减少TNF-a和PDGF的生成,在病理片上亦可见肺泡炎减轻明显,羟脯氨酸含量亦减少,提示布地奈德可能是通过抑制巨噬细胞增殖,使包括TNF-a和PDGF等在内的细胞因子的生成减少,从而减少肺组织胶原的沉积并达到其抗纤维化的目的。
本研究方案采用布地奈德吸入,并联合大剂量乙酰半胱氨酸口服,在改善呼吸困难症状与血气PaO2水平上,相对于口服糖皮质激素具有较大的优势,虽然治疗组在改善肺功能上与对照组相比较差异不明显,还是有很好的疗效。患者呼吸困难评分改善,肺功能TLC、FEV1/FVC、DLCO改善较治疗前差异显著(P<0.05)。本研究也显示,吸入布地奈德联合大剂量口服乙酰半胱氨酸能减少IFNγ水平,增加IL-4的水平,改善Thl/Th2失衡,不仅提示细胞因子可能在IPF的发展、转归中起着重要的作用,另一方面也从细胞因子的角度证实本研究方案治疗IPF能够取得一定的疗效,同时,吸入布地奈德及联合口服乙酰半胱氨酸治疗副作用少,患者容易接受。
现阶段 IPF的治疗中,Adamali等[13]认为,在不增加病死率的前提下,能够阻止和延缓IPF的发展,减轻症状,减少并发症及提高生活质量的药物,都应视为对患者有益的探索。本研究显示,吸入布地奈德联合口服乙酰半胱氨酸治疗IPF,不仅能取得较好的疗效,而且能改善Thl/Th2失衡,副反应少,依从性好,能延缓甚至阻止这一疾病的发生发展,提高综合疗效,提高生活质量,值得在临床推广使用。
[1]蔡后荣.2011年特发性肺纤维化诊断和治疗循证新指南解读[J].中国呼吸与危重监护杂志,2011,7(14):313-316.
[2]吴春风,马忠森,王秀丽,等.特发性肺纤维化患者外周血单个核细胞T淋巴细胞亚群及Th1/Th2型细胞因子的检测[J].吉林大学学报(医学版),2008,34(2):282-284.
[3]彭守春,胡旭,魏路清,等.特发性肺纤维化患者辅助性T细胞1/辅助性T细胞2的研究[J].中华内科杂志,2013,52(6):489-493.
[4]赵红,张丽香,田强,等.布地奈德吸入和口服泼尼松龙治疗特发性肺纤维化的疗效比较[J].医学研究杂志,2008,37(7):74-76.
[5]Homer RJ,Elias JA,Lee CG,et a1.Modern concepts on the role of inflammation in pulmonary fibrosis[J].Arch Pathol Lab Med,2011,135(6):780-788.
[6]贾建军,刘瑞娟.特发性肺纤维化的治疗进展[J].临床肺科杂志,2013,18(7):1300-1302.
[7]Daniil ZD.Serum levels of oxidative stress as amarker of disease severity in idiopathic pulmonary fibrosis[J].Pulm Oharmacol T-her,2008,21(1):26-31.
[8]孙英坤,赵琦,邵玉霞.N-乙酰半胱氨酸治疗特发性肺纤维化的临床分析[J].哈尔滨医科大学学报,2012,46(5):465-467.
[9]Behr Jürgen,Demedts Maurits,Buhl Roland,et al.Lung function in idiopathic pulmonary fibrosis-extended analyses of the IFIGENIA trial[J].Respiratory Research,2009,10(1):101.
[10]Gao F.Extracellular superoxide dismutase inhibits inflammation by preventing oxidative fragmentation of hyaluronan[J].Biol Chem,2008,283(10):6058-6066.
[11]Raghu G,Collard HR,Egan JJ,et al.An official ATS/ERS/JRS/ALAT statement:idiopathic pulmonary fibrosis:evidencebased guidelines for diagnosis and management[J].Am J Respir Crit Care Med,2011,183(6):788-824.
[12]朱晨,王鸿程,曾鸣,等.雾化吸入布地奈德对肺纤维化大鼠支气管肺泡灌洗液中肿瘤坏死因子Q及血小板衍生生长因子的影响[J].国际呼吸杂志,2009,29(24):1484-1488.
[13]Adamali HI,Maher TM.Current and novel drug therapies for idiopathic pulmonary fibrosis[J].Drug Des Devel Ther,2012,6:261-271.

