AS1411辐射增敏机理的研究
李东梅 洪承皎 张保国
(苏州大学医学部放射医学与防护学院 江苏省放射医学与防护重点实验室 苏州 215123)
核仁素是核仁中含量最丰富的磷酸化蛋白,它具有多种生物学功能:调控核糖体的合成与成熟,参与细胞增殖、生长、胞质分裂、染色质复制、核仁的发生等。核仁素在正常细胞中分布在细胞内,但在肿瘤细胞和快速分裂细胞的细胞质中过度表达并转移到细胞膜[1-2]。AS1411是核仁素的特异性核酸适配体,可以与肿瘤细胞表面的核仁素特异性结合[3-4]。AS1411是含26个碱基的G4序列核酸,目前已作为抗癌药物进入二期临床试验研究,显示出积极的抗肿瘤细胞增殖活性[5-6]。AS1411通过干扰各种增殖信号以破坏核仁素及其结合伴侣的相互作用来提高它的抗肿瘤细胞增殖作用,这些信号通路有NF-kB通路、PRMT5致癌基因通路和bcl-2抗凋亡途径等[3-7]。本课题组通过克隆形成实验已经证明AS1411联合X射线能够降低照射后HeLa细胞的存活率,且HeLa细胞在AS1411浓度为500 nmol·L-1时的放射增敏比(SER)达到1.89[8]。本研究以人宫颈癌细胞HeLa为对象,从DNA损伤、细胞周期和细胞凋亡检测方面进一步研究 AS1411的辐射增敏机理,为其应用于肿瘤放射治疗提供实验依据。
1 材料与方法
1.1 主要试剂和仪器
AS1411及其对照适配体 cApt(生工生物工程(上海)有限公司),AS1411序列为 5'-TTG GTG GTG GTG GTT GTG GTG GTG GTGg-3',cApt序列为5'-TTC CTC CTC CTC CTT CTC CTC CTC CTC C-3'。DMEM 细胞培养基、小牛血清(美国Gibco公司)、胰酶(苏州恩泰试剂有限公司)、碘化丙啶(Propidium iodide, PI)染料(自美国Sigma公司)、抗γ-H2AX小鼠单克隆抗体(自美国Upstate公司)、二抗(羊抗鼠-FITC)(苏州工业园区博美达试剂仪器有限公司)、BSA(Roche公司)、TritonX100(Amersharm公司)、DAPI染液和抗荧光淬灭封片剂(碧云天生物技术研究所)、Annexin V-FITC细胞凋亡检测试剂盒(南京凯基生物有限公司),激光共聚焦显微镜(TCS SP2,Leica公司),流式细胞仪(Cytomics FC500, Beckman Coulter),CO2培养箱(Thermo Forma3111),酶联免疫检测仪(BIO-TEK公司powerwave xs),倒置显微镜(Olympus CK41)。
1.2 细胞培养
宫颈癌细胞株 HeLa为本实验室保存,置于含有10%小牛血清的DMEM培养基中,在37 ℃、5%CO2培养箱中培养,培养瓶内单层传代培养,取指数生长期细胞进行实验。
1.3 AS1411和cApt储存条件
AS1411和 cApt采用去离子水配制成浓度为1mmol·L-1的储存液,于 4 ℃冰箱保存,使用时用DMEM培养基稀释。
1.4 照射条件
应用美国RADSOURCE公司RS2000PRO型X射线生物照射仪照射细胞,射线能量160 kV,照射剂量率1.15 Gy·min-1。照射时使用直径60mm的一次性塑料培养皿(Gibco),皿内培养液总体积2mL,将培养皿平放于照射区域中央,距X源中心40 cm。
1.5 γ-H2AX免疫荧光法检测DNA损伤
取指数生长期细胞制备单细胞悬液,培养皿中预先放置盖玻片,种植于培养皿中爬片,设置正常对照组、单纯药物组、单纯照射组和照射+药物组,培养8 h至细胞贴壁。在单纯药物组、照射+药物组中加入 AS1411(或 cApt)使终浓度为 500 nmol·L-1和1 μmol·L-1。24 h后,X射线照射单纯照射组、照射+药物组细胞,吸收剂量分别为0 Gy、4 Gy和8 Gy,照后2 h做相应处理:加入抗γ-H2AX小鼠单克隆抗体(1: 500) 4 ℃冰箱中过夜,再于羊抗鼠-FITC二抗(1: 400)室温孵育1 h,加入DAPI染液染核5 min,最后滴加6 μL抗荧光淬灭封片剂,将盖玻片倒置在载玻片上,避光,在激光共聚焦显微镜下观测每个细胞核内 DNA双链断裂所产生的荧光斑点数量。每个视野至少观测100个细胞,记录3个视野。
1.6 细胞周期检测
取指数生长期细胞制备单细胞悬液,培养皿培养8 h至细胞贴壁。换用无血清DMEM培养基,同步化12 h分组:正常对照组、单纯药物组、单纯照射组和照射+药物组。单纯药物组、照射+药物组加AS1411(cApt)使终浓度为 500 nmol·L-1和1μmol·L-1。24 h后,单纯照射组、照射+药物组 X射线照射细胞,照射剂量8 Gy,照射后于24 h时间点收集细胞;制备单细胞悬液,计数细胞调整细胞浓度为(5-10)×105mL-1,离心(1000 r·min-1, 5 min),弃上清,用PBS洗2遍,加入70%冰乙醇1mL,吹打均匀,固定过夜,第2天加50 μɡ·mL-1PI染色液,置4 ℃避光染1 h后流式细胞仪检测细胞周期。
1.7 细胞凋亡检测
取指数生长期细胞制备单细胞悬液,取 105个细胞种植于培养皿中,分设正常对照组、单纯药物组、单纯照射组和照射+药物组,培养8 h至细胞贴壁。单纯药物组、照射+药物组中加入AS1411(cApt)使终浓度为 500 nmol·L-1和 1μmol·L-1。24 h 后,单纯照射组、照射+药物组用X射线照射细胞,吸收剂量分别为0 Gy、4 Gy和8 Gy,照射后24 h用胰酶消化细胞,收集细胞,制备单细胞悬液,计数细胞并调整细胞浓度为(2-5) ×105mL-1,离心(1000 r·min-1, 5 min),悬浮细胞,Annexin V-FITC 和Propidium Iodide染色,避光染30 min后流式细胞仪检测细胞凋亡。
1.8 统计学处理
实验时设 3个平行样,实验重复 3次。应用SAS8.0统计软件进行分析。实验结果用(±s)表示,重复测量采用方差分析,组间比较采用t检验。p<0.05为差异有统计学意义。
2 结果
2.1 AS1411对HeLa细胞DNA损伤的影响
图 1和图 2分别为使用共聚焦显微镜观察AS1411和cApt联合X射线照射对HeLa细胞DNA双链断裂情况,蓝色(DAPI)为细胞核,红色(γ-H2AX)为双链断裂点。图3a、图3b分别是依据图1、图2统计的平均每个细胞核中DNA断裂点数的柱状图。从图3a可以看出,吸收剂量为0 Gy时,AS1411加药组与正常对照组无差别;吸收剂量为4Gy时,对照组、500 nmol·L-1/AS1411 组和 1 μmol·L-1/AS1411组核内双链断裂斑点数分别为(9.681±2.13)个、(16.137±2.03)个和(21.024±2.25)个;吸收剂量为8 Gy时,对照组、500 nmol·L-1/AS1411组和 1 μmol·L-1/AS1411组核内双链断裂斑点数分别为(20.789±2.73)、(45.685±3.04)和 (61.052±2.68)个;即AS1411能够增加辐射对HeLa细胞DNA的双链断裂。从图3b可以得到,吸收剂量为0 Gy时,cApt加药组与正常对照组无差别;吸收剂量为4 Gy时,对照组、500 nmol·L-1/cApt 组和 1μmol·L-1/cApt组核内双链断裂斑点数分别为(9.681±2.13)、(11.011±1.63)和(10.026±1.22)个;吸收剂量为 8 Gy时,对照组、500 nmol·L-1/cApt组和 1 μmol·L-1/cApt组核内双链断裂斑点数分别为(20.789±1.73)、(19.057±1.86)和(21.052±2.16)个;即在同一照射剂量下,各组核内双链断裂斑点数相比较无差别。
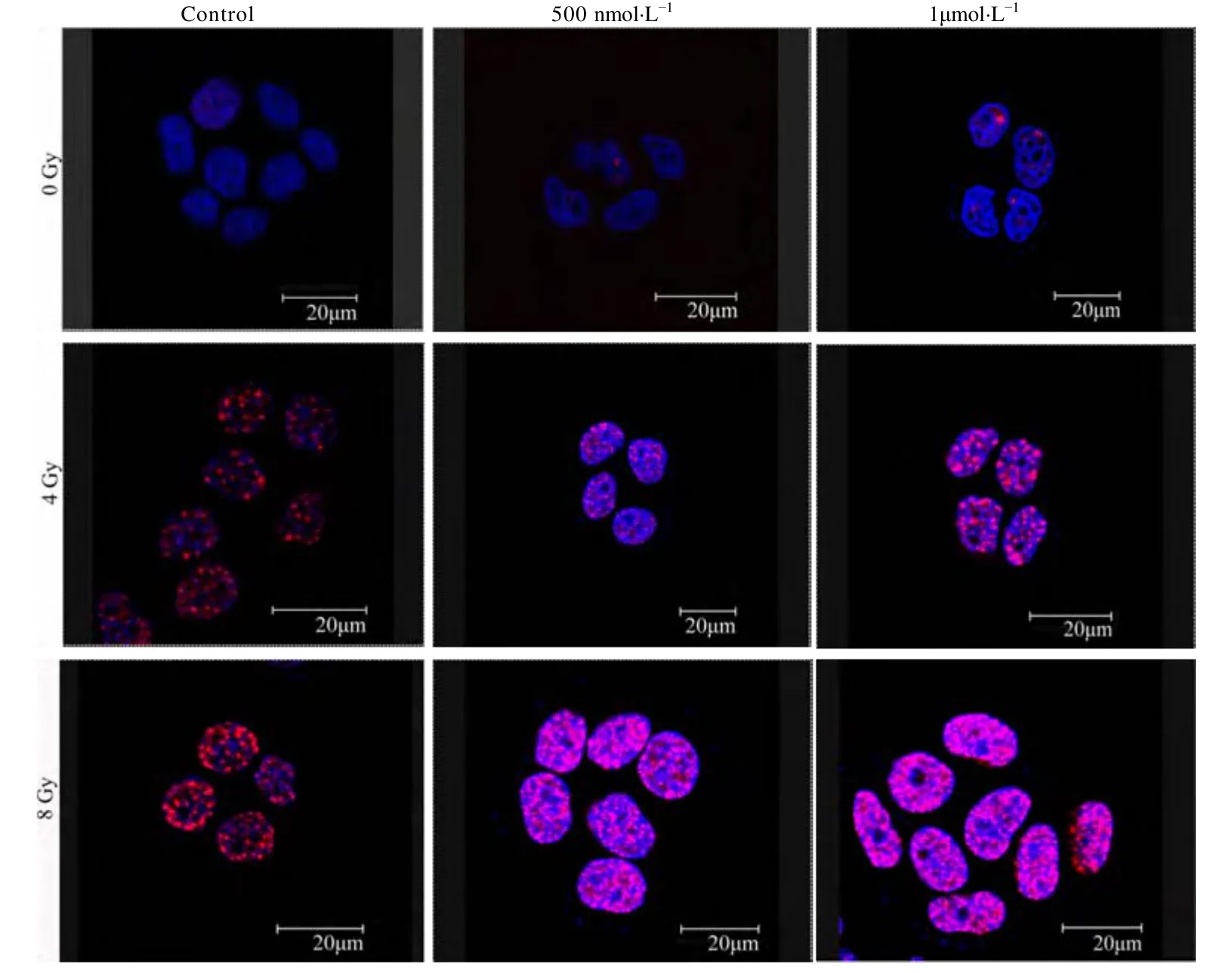
图1 激光共聚焦显微镜观察AS1411联合X-射线照射对HeLa细胞DNA双链断裂的影响Fig.1 Confocal microscopy images of AS1411 combined with X-ray irradiation on HeLa cells DNA double-strand breaks
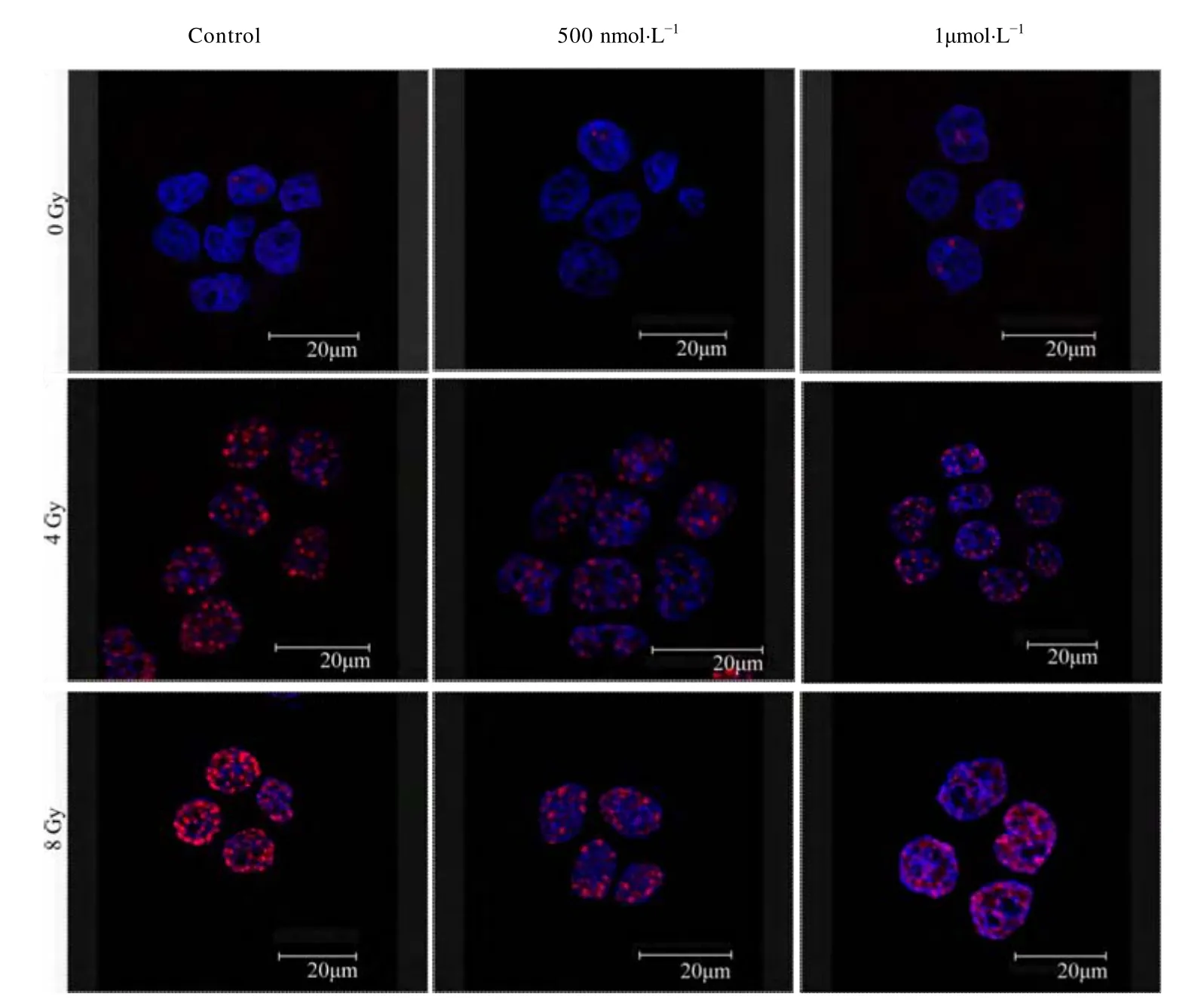
图2 激光共聚焦显微镜观察cApt联合X-射线照射对HeLa细胞DNA双链断裂的影响Fig.2 Confocal microscopy images of cApt combined with X-ray irradiation on HeLa cells DNA double-strand breaks
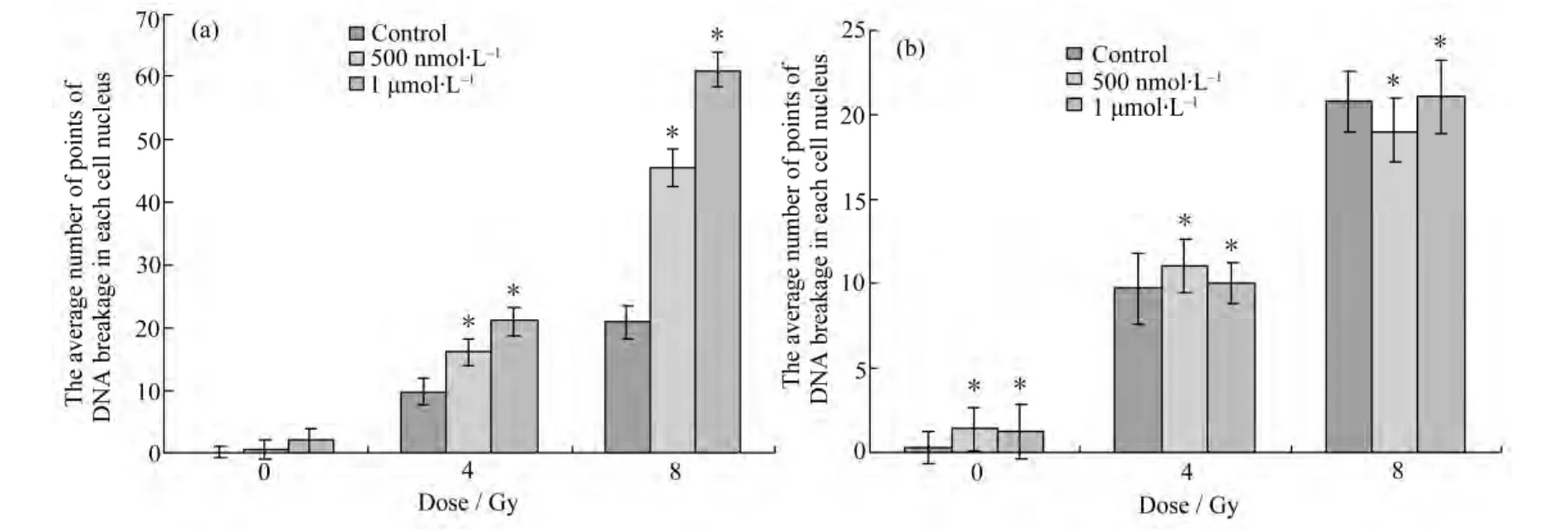
图3 不同浓度AS1411(a)、cApt (b)联合X射线照射下平均每个细胞核中DNA断裂点的数目Fig.3 The average number of DNA breakage points in each cell nucleus treated by AS1411 (a) and cApt (b) of different concentrations combined with X-ray irradiation
2.2 AS1411对HeLa细胞周期的影响
表1和表2分别为流式细胞仪检测AS1411和cApt对HeLa细胞周期分布实验结果。表1可看出,在不接受X射线照射条件下,不同浓度AS1411处理后G0/G1期、S期、G2/M期与正常对照组相比无明显差别;8 Gy X-射线照射后出现G2/M期阻滞,但AS1411预处理并没减少G2/M期阻滞,这表明AS1411增加HeLa细胞辐射增敏的机理与细胞周期无关。表2可看到,不接受X射线照射条件下,不同浓度cApt处理后与正常对照组相比较,各期细胞周期分布没有发生变化;8 Gy X射线照射后出现G2/M期阻滞,cApt处理组与单纯照射组相比无变化,可得出cApt对HeLa细胞周期分布没有影响。
表1 AS1411不同处理组对HeLa细胞周期分布的影响Table 1 The effect of different treatment groups of AS1411 on Hela cell cycle distribution (%,±s)
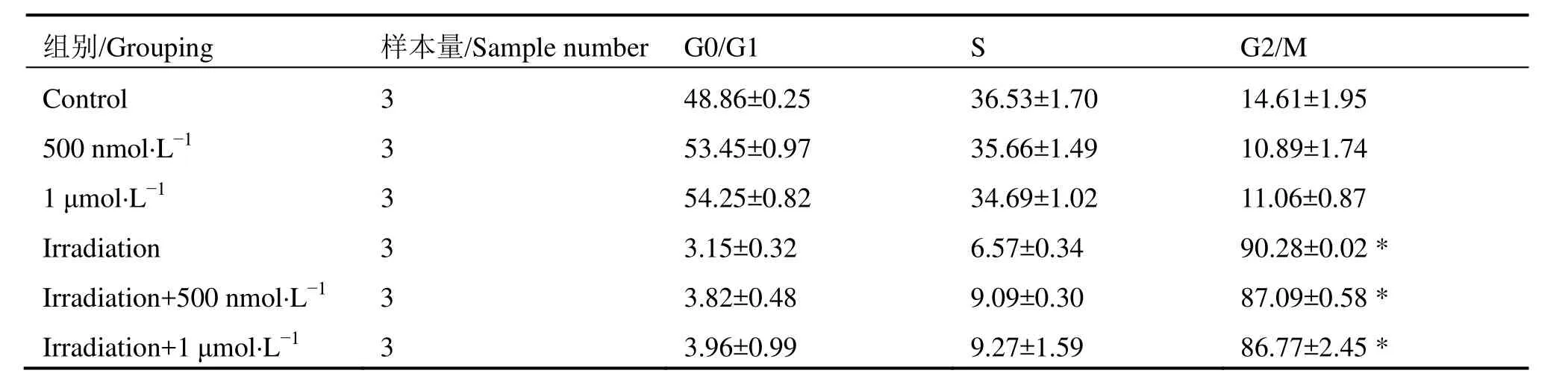
表1 AS1411不同处理组对HeLa细胞周期分布的影响Table 1 The effect of different treatment groups of AS1411 on Hela cell cycle distribution (%,±s)
注: *与单纯对照组相比,p<0.05。Note: *Compared with the control group, p<0.05.
组别/Grouping 样本量/Sample number G0/G1 S G2/M Control 3 48.86±0.25 36.53±1.70 14.61±1.95 500 nmol·L-1 3 53.45±0.97 35.66±1.49 10.89±1.74 1 μmol·L-1 3 54.25±0.82 34.69±1.02 11.06±0.87 Irradiation 3 3.15±0.32 6.57±0.34 90.28±0.02 *Irradiation+500 nmol·L-1 3 3.82±0.48 9.09±0.30 87.09±0.58 *Irradiation+1 μmol·L-1 3 3.96±0.99 9.27±1.59 86.77±2.45 *
表2 cApt不同处理组对HeLa细胞周期分布的影响Table 2 The effect of different treatment groups of cApt on Hela cell cycle distribution (%, ±s)
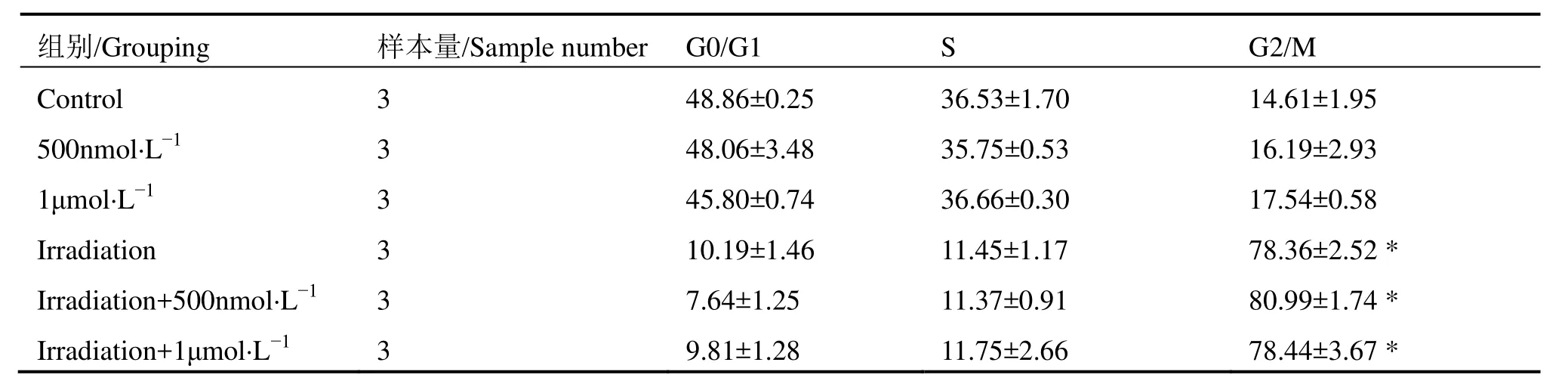
表2 cApt不同处理组对HeLa细胞周期分布的影响Table 2 The effect of different treatment groups of cApt on Hela cell cycle distribution (%, ±s)
注: *与单纯对照组相比,p<0.05。Note: *Compared with the control group, p<0.05.
组别/Grouping 样本量/Sample number G0/G1 S G2/M Control 3 48.86±0.25 36.53±1.70 14.61±1.95 500nmol·L-1 3 48.06±3.48 35.75±0.53 16.19±2.93 1μmol·L-1 3 45.80±0.74 36.66±0.30 17.54±0.58 Irradiation 3 10.19±1.46 11.45±1.17 78.36±2.52 *Irradiation+500nmol·L-1 3 7.64±1.25 11.37±0.91 80.99±1.74 *Irradiation+1μmol·L-1 3 9.81±1.28 11.75±2.66 78.44±3.67 *
2.3 AS1411对辐射诱导HeLa细胞凋亡的影响
表 3、表 4分别为流式细胞仪检测的 AS1411和cApt联合不同剂量X射线照射对HeLa细胞凋亡率的实验结果。由表3可见,在吸收剂量为0 Gy时,随着AS1411浓度的增加,HeLa细胞的凋亡率也逐渐增高,即单独用药可增加细胞凋亡率;在相同照射剂量下,AS1411联合X射线照射组较单纯照射组的细胞凋亡率增加,且与浓度成正比关系,这表明AS1411可增加由辐射所导致的细胞凋亡。由表4可见,cApt对HeLa细胞凋亡率没有影响。
表3 不同浓度AS1411对HeLa细胞凋亡率的影响Table 3 The effect of different concentration of AS1411 on Hela cell apoptosis (%,±s)
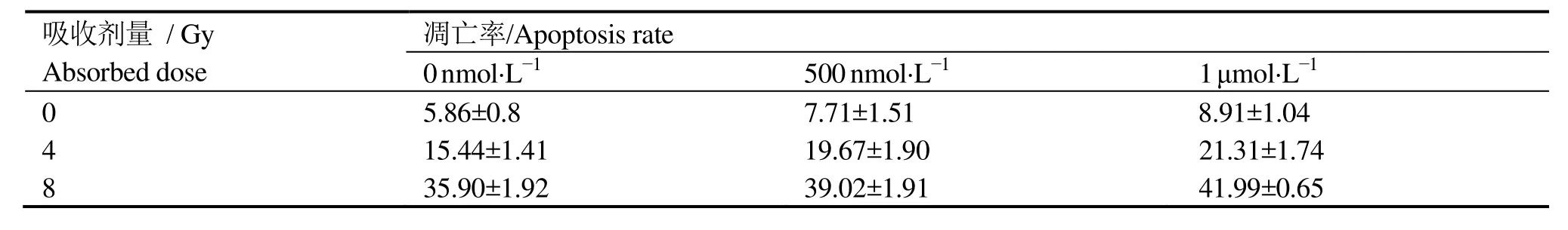
表3 不同浓度AS1411对HeLa细胞凋亡率的影响Table 3 The effect of different concentration of AS1411 on Hela cell apoptosis (%,±s)
吸收剂量 / Gy Absorbed dose凋亡率/Apoptosis rate 0 nmol·L-1 500 nmol·L-1 1 μmol·L-1 0 5.86±0.8 7.71±1.51 8.91±1.04 4 15.44±1.41 19.67±1.90 21.31±1.74 8 35.90±1.92 39.02±1.91 41.99±0.65
表4 不同浓度cApt对HeLa细胞凋亡率的影响Table 4 The effect of different concentration of cApt on Hela cell apoptosis (%, ±s)
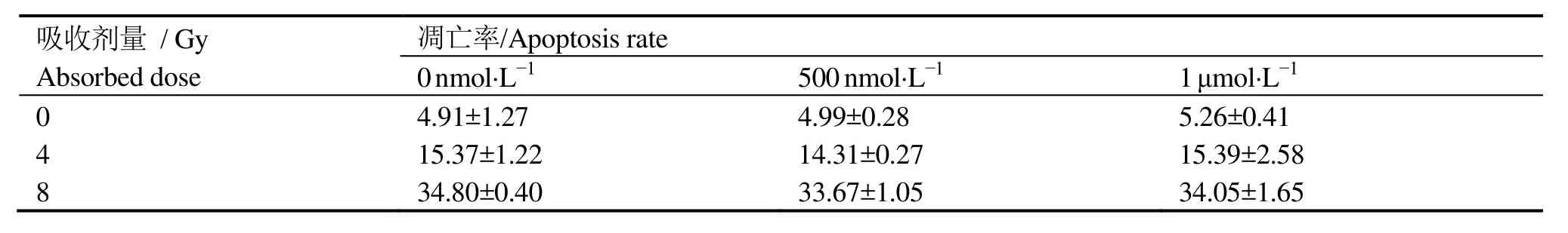
表4 不同浓度cApt对HeLa细胞凋亡率的影响Table 4 The effect of different concentration of cApt on Hela cell apoptosis (%, ±s)
吸收剂量 / Gy Absorbed dose凋亡率/Apoptosis rate 0 nmol·L-1 500 nmol·L-1 1 μmol·L-1 0 4.91±1.27 4.99±0.28 5.26±0.41 4 15.37±1.22 14.31±0.27 15.39±2.58 8 34.80±0.40 33.67±1.05 34.05±1.65
3 讨论
辐射增敏剂(Radiosensitizing agents)的研究是肿瘤放射治疗的一个重要研究方向。辐射增敏剂是能够增强生物体放射敏感性的一类物质,通过选择性地杀伤乏氧肿瘤细胞、抑制放射损伤修复、调节细胞周期等来增强肿瘤细胞的放射敏感性,提高肿瘤治愈率,对于临床治疗具有重要意义。
核酸适配体AS1411具有多种优越性能:亲和力强、特异性高、制备廉价、高效快速、高稳定性、尺寸小、易于修饰、免疫原性小和渗透性好等。核仁素是AS1411与细胞作用的靶点,AS1411能够通过抑制核仁素的多种功能发挥抗肿瘤作用[3-4,9-10],如引起抗-凋亡bcl-2蛋白表达量降低而促进细胞凋亡,抑制NF-κB的活性,阻止DNA的复制等。Bates等[6]已经研究了AS1411对80种人类细胞系的抗增殖活性,发现其几乎对所有的肿瘤细胞增殖都有很好地抑制作用,而对正常细胞的毒性作用小。AS1411具有上述优点,使其可以作为辐射增敏剂比较理想的候选者,本项研究希望进一步证明用AS1411抑制核仁素的功能,来提高肿瘤细胞的辐射敏感性。
双链断裂(DSBs)是电离辐射作用后 DNA最严重的损伤形式,DSBs修复缺陷导致辐射敏感性的显著提高。DNA双链断裂后,断裂点附近的组蛋白H2AX的C末端丝氨酸残基会快速发生磷酸化,形成γ-H2AX。γ-H2AX数目可以用来检测DSBs的数量[11]。由于γ-H2AX与DSB在数量上是l:l的关系,检测γ-H2AX已成为探测DSB数量的金标准[12]。本实验应用激光共聚焦显微镜观察不同浓度 AS1411联合X射线对HeLa细胞DNA损伤的影响,结果显示:剂量为0 Gy时,AS1411加药组与正常对照组相比较无差别;剂量为 4 Gy、8 Gy时,500 nmol·L-1/AS1411 组和 1 μmol·L-1/AS1411 组核内双链断裂斑点数明显多于单纯照射组;这表明AS1411能够增加辐射对细胞DNA的双链断裂,即AS1411对HeLa细胞的辐射增敏机理与其增加DNA损伤作用有关。
细胞的辐射敏感性与多种因素有关,比如DNA双链断裂修复、细胞周期、细胞凋亡、蛋白激酶C、表皮生长因子受体、细胞内谷胱甘肽的含量等[13]。在放射治疗中,肿瘤细胞受到中、高剂量电离辐射照射后引起 DNA损伤,都会发生细胞周期阻滞现象,细胞周期的阻滞与细胞凋亡、分化密切相关,细胞通过G1/S期检查点和G2/M检查点保证细胞的复制[14]。当DNA损伤程度超过细胞的修复能力时,凋亡相关基因将被激活,则促使细胞凋亡。本实验中用流式细胞仪检测细胞周期和凋亡的变化,从细胞周期实验结果可以看出:在不接受X射线照射的条件下,不同浓度AS1411处理后G0/G1期、S期、G2/M期与单纯对照组相比无明显差别;8 Gy X射线照射后出现G2/M期阻滞,但AS1411预处理并没有减少G2/M期阻滞,这表明AS1411增加HeLa细胞辐射敏感性的机理与细胞周期无关。从细胞凋亡实验结果得出,AS1411提高HeLa细胞的凋亡率与药物浓度正相关,表明 AS1411能够促进辐射诱导的HeLa细胞凋亡,这与之前的研究结果一致[4]。本课题组通过克隆形成实验已经证明 AS1411联合X射线可以降低照射后HeLa细胞的存活率,能够提高HeLa细胞的放射敏感性[8],本研究更进一步证明AS1411通过增加辐射对HeLa细胞DNA的双链断裂、促进辐射诱导的 HeLa细胞凋亡率的增加来提高其对 HeLa细胞的辐射增敏作用,将为宫颈癌的放射治疗提供进一步的理论依据和基础实验依据。但是其确切的增敏机制尚不确定,还有待于进一步的深入研究。
1 Dam D H, Lee J H, Sisco P N, et al. Direct observation of nanoparticle cancer cell nucleus interactions [J]. ACS Nano, 2012, 6(4): 3318-3326.
2 贺欣, 宋娜玲, 孟爱民. 穿梭蛋白核仁素的多种生物学功能 [J]. 医学综述, 2012, 18(13): 1961-1964.HE Xin, SONG Naling, MENG Aimin. Biological functions of shuttling protein-nucleolin [J]. Medical Recapitulate, 2012, 18(13): 1961-1964.
3 Bates PJ, Kahlon JB, Thomas SD, et al. Antiproliferative activity ofg-rich oligonucleotides correlates with protein binding [J]. The Journal of Biological Chemistry, 1999,274(37): 26369-26377.
4 Soundararajan S, Chen W, Spicer E K, et al. The nucleolin targeting aptamer AS1411 destabilizes Bcl-2 messenger RNA in human breast cancer cells [J]. Cancer research,2008, 68(7): 2358–2365.
5 Mongelard F, Bouvet P. AS-1411, a guanosine-rich
oligonucleotide aptamer targeting nucleolin for the potential treatment of cancer, including acute myeloid leukemia [J]. Current Opinion in Molecular Therapeutics,2010, 12(1): 107-114.
6 Bates P J, Laber D A, Miller D M, et al. Discovery and Development of theg-rich Oligonucleotide AS1411 as a Novel Treatment for Cancer [J]. Experimental and Molecular Pathology, 2009, 86(3): 151-164.
7 Xu Z, Joshi N, Agarwal A, et al. Knocking down nucleolin expression in gliomas inhibits tumor growth and induces cell cycle arrest [J]. Journal of Neuro-Oncology,2012, 108(1): 59-67.
8 李东梅, 洪承皎, 张保国. AS1411对宫颈癌HeLa细胞放射敏感性的影响 [J]. 辐射研究与辐射工艺学报,2013, 31(4): 040207(1-5).LI Dongmei, HONG Chengjiao, ZHANG Baoguo. Effect of AS1411 on radiosensitivity of uterine cervix cancer HeLa cells [J]. Journal of Radiation Research and Radiation Processing, 2013, 31(4): 040207(5).
9 Soundararajan S, Wang L, Sridharan V, et al. Plasma membrane nucleolin is a receptor for the anticancer aptamer AS1411 in MV4-11 leukemia cells [J]. Molecular Pharmacology, 2009, 76(5): 984-991.
10 Soh K,Kang K,Harrison D, et al. Using Human Observations to Gain Biologic Insights and New Treatments; Discovery of a Quadruplex-Forming DNA Aptamer as an Anticancer Agent [J]. Springer New York,2012: 193-202.
11 Löbrich M, Shibata A, Beucher A, et al. γ-H2AX foci analysis for monitoring DNA double-strand break repair:strengths, limitations and optimization [J]. Cell Cycle,2010, 9(4): 662-669.
12 Fernandez-Capetillo O, Lee A, Nussenzweig M et al.H2AX: the histone guardian of the genome [J]. DNA Repair, 2004, 8(9): 959-967.
13 Martin N M. DNA repair inhibition and cancer therapy [J].Journal of Photochemistry and Photobiology B, 2001,63(1-3): 162-170.
14 高燕, 林莉萍, 丁健. 细胞周期调控的研究进展 [J].生命科学, 2005, 17(4): 318-322.GAO Yan, LIN Liping, DING Jian. A review: cell cycle regulation [J]. Chinese Bulletin of Life Sciences, 2005,17(4): 318-322.

