水热法合成棒束状纳米CeO2粉体及其催化性能
陈 丰,陈志刚,,马娟宁,钱君超,,王盟盟,陆秋月
(苏州科技学院1.化学生物与材料工程学院;2.江苏省环境功能材料重点实验室,苏州 215009;3.江苏大学材料科学与工程学院,镇江 212013)
0 引言
CeO2是一种重要的稀土金属氧化物,因其独特的立方萤石结构、Ce3+/Ce4+变换能力和氧化还原能力,被广泛应用于固体氧化物燃料电池、汽车尾气催化、发光材料、电子陶瓷、气体传感器等[1-2]。制备具有可控尺寸和形貌的纳米CeO2一直受到人们的密切关注,近年来,研究人员合成了各种结构和形貌的 CeO2,如 CeO2的纳米线[3]、纳米片[4]、纳米管[5]、纳米立方体[6]和纳米中空球[7]等。目前,制备特殊形貌 CeO2的方法主要有溶胶-凝胶法[8-9]、模板法[10]、静电纺丝技术[11]和水热法[12]等。
水热法是在密闭反应器中,以水、乙醇或甲苯等为溶剂,利用相对高温、高压的反应环境,使难溶或不溶的物质溶解后重结晶,进而合成无机材料的一种特殊方法[13-15]。铈的离子价态、反应温度及时间对 CeO2形貌有较大影响[6,16],且棱柱状 CeO2材料具有较多的氧缺陷,能有效提高其催化活性[17]。此外,与传统的制备方法相比,水热法具有工艺简单、沉淀杂质少等优势,是当前制备特殊形貌CeO2的主要方法之一。故而作者采用水热法,以聚氧乙烯-聚氧丙烯-聚氧乙烯(P123,PEO20PPO70PEO20)为模板合成了棒束状纳米CeO2,研究了反应温度、Ce(NO3)3·6H2O和C2H2O4·2H2O物质的量比、溶液pH以及反应时间等工艺参数对CeO2颗粒的影响,以确定最佳的合成工艺参数;然后将在最佳工艺参数下制备的CeO2应用于废水染料酸性品红溶液的催化降解,并与普通块体CeO2的催化降解性能进行了对比。
1 试样制备与试验方法
1.1 试样制备
称取 1 g P123(分子量 5 500,美国 Sigma-Aldrich公司)溶于15 mL无水乙醇和5 mL去离子水的混合溶液中,磁力搅拌使其充分溶解,之后加入Ce(NO3)3·6H2O(分析纯,国药试剂公司)和C2H2O4·2H2O(分析纯,国药试剂公司),搅拌均匀后转移至反应釜中,于不同温度下水热反应不同时间,以NaOH调节溶液的pH;然后自然冷却至室温进行抽滤洗涤,于80℃干燥后再将产物在400℃下煅烧7 h得到浅黄色粉体,即为CeO2。具体试验参数如表1所示,其中 nCH为 Ce(NO3)3·6H2O和C2H2O4·2H2O物质的量比。
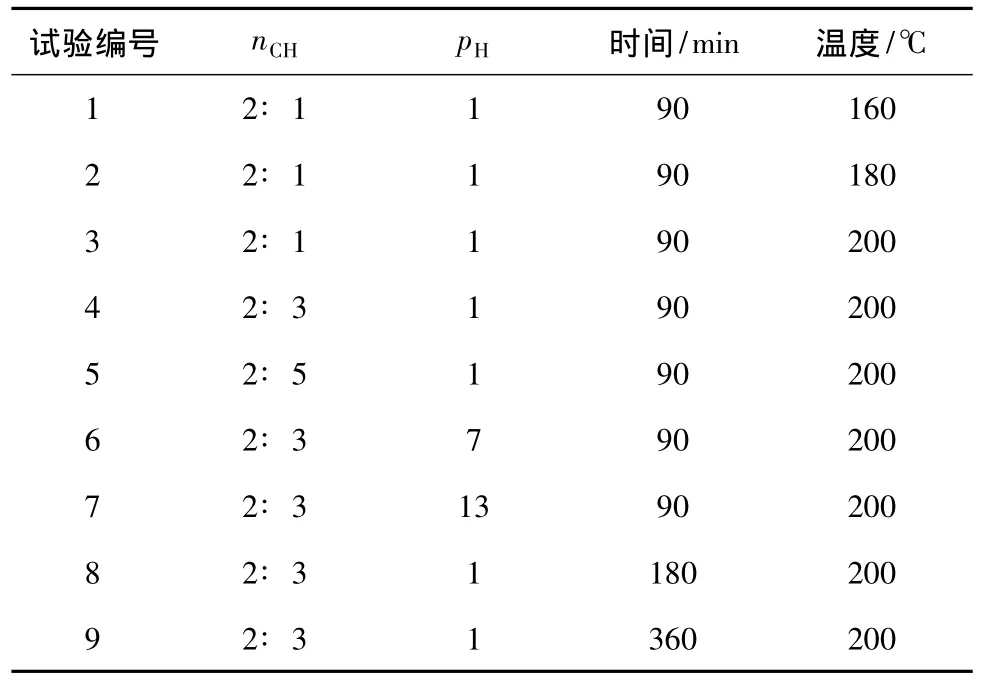
表1 反应参数Tab.1 Reaction param eters
1.2 试验方法
采用D/max2500PC型X射线衍射仪(XRD)对粉体进行物相分析,测试温度为室温;采用铜靶Kα(λ =0.154 056 nm),扫描角度 2θ 范围为 10°~80°;采用Hitachi S-4800型场发射扫描电镜(SEM)和JEM-2100型透射电镜(TEM)观察粉体颗粒的粒径及形貌;采用ASAP-2010C型自动吸附仪,在77 K的氮气环境下进行吸附测定,比表面积S由BET(Brunauer-Emmett-Teller)方法计算得到,用 BJH(Barrett-Joyner-Halenda)模型拟合吸附等温线得到试验3,4,5制备CeO2的孔径分布。
对染料降解的催化试验:配制20 mg·L-1的酸性品红溶液,各取100 mL分别放入3个锥形瓶中,再分别加入3 mL H2O2;然后向其中的一个加入0.2 g棒束状纳米CeO2(在最佳工艺参数下制备),另一个加入0.2 g块状CeO2(分析纯,国药试剂公司),最后一个不加催化剂;将3个锥形瓶放入恒温振荡器中反应,水浴温度为30℃,每隔一定时间取样,离心分离后取上部清液,采用UV-2450型紫外-可见分光光度计在波长545 nm处测定酸性品红溶液的吸光度,然后按式(1)计算品红溶液的脱色率C r。
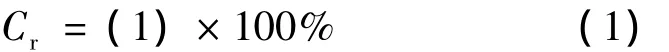
式中:A0为酸性品红溶液未降解时的吸光度;A为酸性品红溶液降解后的吸光度。
2 试验结果与讨论
2.1 反应温度对CeO2粉体的影响
当Ce(NO3)3·6H2O和C2H2O4·2H2O混合时即产生草酸铈沉淀,水热反应后抽滤洗涤,将前驱体烘干煅烧后即可生成淡黄色CeO2粉体。上述过程涉及的化学反应可表述如下:
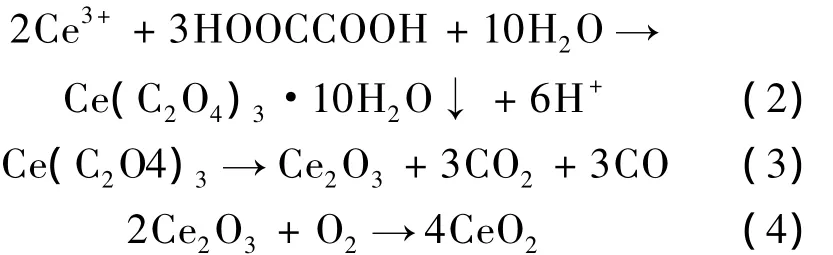
按试验1~3制备CeO2粉体的XRD谱和SEM形貌分别如图1,2所示。由图1可知,在三种水热反应温度下制备的粉体均为立方萤石结构的CeO2。这说明反应温度对粉体的晶型没有影响。另外,水热反应温度从160℃升至200℃后,衍射峰的强度降低,且明显宽化,这表明CeO2粉体的粒径逐渐减小。
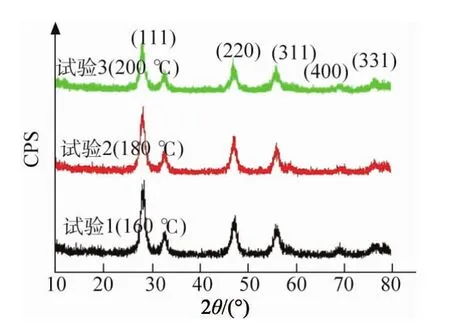
图1 不同水热反应温度下制备CeO2粉体的XRD谱Fig.1 XRD patterns of CeO2 powders prepared by hydrothermal reaction at different tem peratures
由图2可知,水热反应温度为160℃时,制备的CeO2粉体颗粒不规则,大小不均匀;当反应温度升至180℃时,CeO2粉体颗粒的形状趋于球形,且分布均匀,颗粒表面较160℃下制备的更光滑;当反应温度升至200℃时,单个颗粒形状类似胶囊,呈棒束状,且沿着某些方向生长,表面越来越光滑且并出现团聚现象。由此可见,随着水热温度的升高,CeO2粉体颗粒的形貌逐渐由散碎的颗粒状向棒束状转变。

图2 不同水热反应温度下制备CeO2粉体的SEM形貌Fig.2 SEMimages of CeO2 powders prepared by hydrothermal reaction at different temperatures

图3 不同水热反应温度下制备CeO2粉体的TEM形貌和衍射花样Fig.3 TEMimages(a,c)and corresponding diffraction patterns(b,d)of CeO2 powders prepared by hydrothermal reaction at different temperatures
图3为试验2,3制备的CeO2粉体的TEM形貌及衍射花样。可见,当水热反应温度为180℃时,制备的CeO2粉体为无规则的多晶,印证了XRD的结果。随着水热反应温度升至200℃,CeO2粉体逐渐变为单晶,并处于多晶和单晶之间的过渡态。通过以上分析可知,水热反应温度为200℃时所制备的CeO2颗粒相对规整、光滑,且结晶度高,因此该温度为制备棒束状CeO2粉体的最佳温度。
2.2 n CH对CeO2粉体物相,N2吸脱附性能及孔径的影响
由图 4 可知,在衍射角 2θ 为 28.5°,33.1°,47.5°,56.3°,69.1°,76.6°处均出现了明显的衍射峰,这些峰对应于立方萤石结构CeO2(JCPDS 34-0394)的(111),(200),(220),(311),(400)和(331)晶面的特征峰,并且各衍射峰较强,峰形尖锐,说明生成的CeO2晶粒较大。利用谢乐方程可知 nCH为 2∶1,2∶3,2∶5 时,在(111)衍射峰处CeO2的晶粒尺寸分别为 10.7,9.5,10.2 nm。可见改变nCH不影响产物的直径。
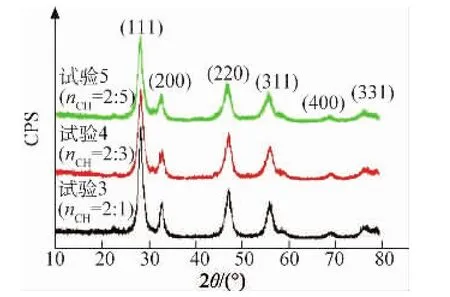
图4 不同n CH下制备CeO2粉体的XRD谱Fig.4 XRD patterns of CeO2 powders prepared at different mole ratios of Ce(NO3)3·6H2O to C2H 2O4·2H 2O
由图5(a)可知,不同nCH下合成CeO2的吸脱附等温线均为Ⅳ型曲线,回滞环为H2型,是典型的介孔材料的特征等温线。由图5(b)可知,不同nCH下制备CeO2粉体的孔径均集中在2~4 nm,而nCH=2∶3时的孔径最为集中,平均孔径约为3.7 nm。
结合图4,5可知,nCH=2∶3时制备的CeO2粉体尺寸较小、孔结构较为规整且孔直径集中。因此,选取nCH=2:3作为制备棒束状CeO2的最佳配比条件。
2.3 溶液pH对CeO2粉体形貌的影响
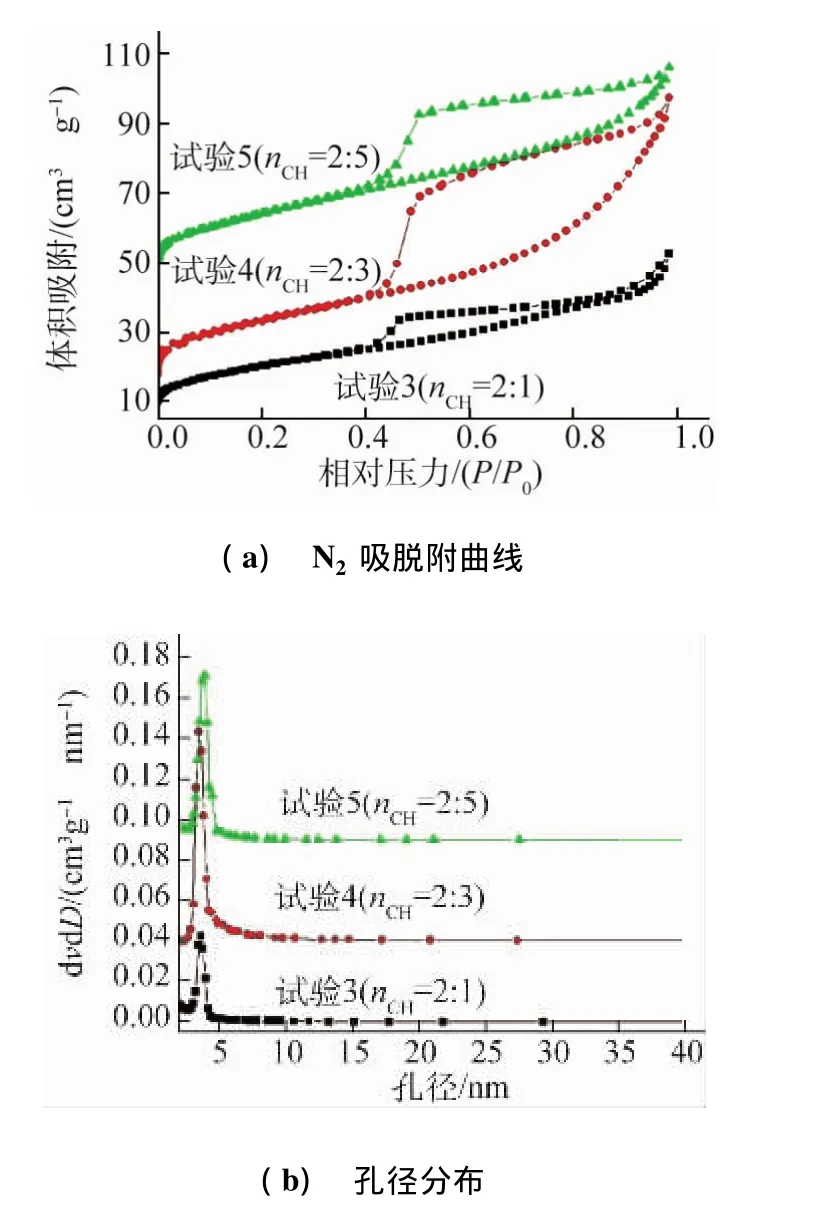
图5 不同n CH下制备CeO2粉体的N2吸脱附等温线和孔径分布Fig.5 Nitrogen adsorption-desorption isotherms(a)and corresponding pore size distribution curves(b)for CeO2 powders prepared at differentmole ratios of Ce(NO3)3·6H2 O to C2 H2 O4·2H2 O
根据试验4,6,7制备CeO2粉体的SEM形貌如图6所示。可见,当pH=1时,CeO2粉体的颗粒近似块状,表面光滑且尺寸均匀。随着pH的不断增大,CeO2粉体颗粒的数量逐渐减少,且表面出现了明显的脱落现象。Shinryo[18]等认为形貌各异的棒状和球状CeO2粒子与溶液pH有密切关系,而且主要依赖于Ce3+氧化成Ce4+(Ce3+/Ce4+的转化)期间溶液的pH。从电化学角度考虑,酸性条件下的电池电动势小于碱性条件下的,说明Ce3+/Ce4+转变在酸性溶液中较碱性溶液中更易进行,因此酸性环境下更有利于Ce3+/Ce4+转化。基于上述结论推测,在反应初期,Ce(NO3)3·6H2O和C2H2O4·2H2O很快发生反应生成Ce(C2O4)3结晶核,根据热力学和晶体自发均相生长原则可知,此时生成的Ce(C2O4)3结晶核会趋于球形以减小其表面能。在酸性条件下,晶核氧化反应的速度大于晶粒生长的速度,所以Ce(C2O4)3没有足够的时间长成其它形貌;而在碱性条件下,由于氧化反应速度低使得没有足够的时间生成Ce(C2O4)3结晶核,因此碱性条件下CeO2颗粒的数量相对较少。因此,选取低pH(pH=1)的溶液有利于棒束状纳米CeO2的生成。
2.4 反应时间对CeO粉体形貌的影响

图6 在不同pH溶液中制备CeO2粉体的SEM形貌Fig.6 SEMimages of CeO2 powders prepared in different pH solutions:(a)(c)(e)at low magnification and(b)(d)(f)at high magnification

图7 不同反应时间下制备CeO 2粉体的SEM形貌Fig.7 SEMimages of CeO2 pow ders prepared at different reaction times
根据试验4,8,9制备CeO2粉体的SEM形貌如图7所示。可见,当反应时间为90 min时,CeO2粉体颗粒处于分散状态,形状规则;当反应时间延长至180 min时,有个别棒束状CeO2颗粒出现,而且棒束状颗粒由很多单个细棒组成的;当反应时间延长至为360 min时,棒束状颗粒较180 min时的更短,且形状更加规整,单个细棒平行排列聚集成大的棒束状,另有部分颗粒呈团聚状态而未形成棒束状;从棒束状粒子的横截面可以看出颗粒长度匀称,且形成了孔结构。基于以上结果,选取360 min为最佳的反应时间,此时将获得形貌尺寸均较好的棒束状CeO2粉体。
2.5 催化性能
由图8可以看到,块状CeO2对酸性品红溶液的催化效果较差,催化效率低,在120 m in后的脱色率只有50%左右,仅比未加催化剂的反应效果略好,这说明CeO2可以提高对酸性品红溶液的催化效果。而采用较佳工艺制备的棒束状纳米CeO2粉体在30 m in内的脱色率就已经达到45%,120 m in后的脱色率基本达到95%。这是由于棒束状CeO2的纳米结构有助于增加材料中的氧缺陷并提高其催化效率,使得材料具有吸附催化一体化的优势,同时较大的比表面积间接提高了材料表面的的催化活性,宏观上表现为对酸性品红溶液的脱色率大大增加。
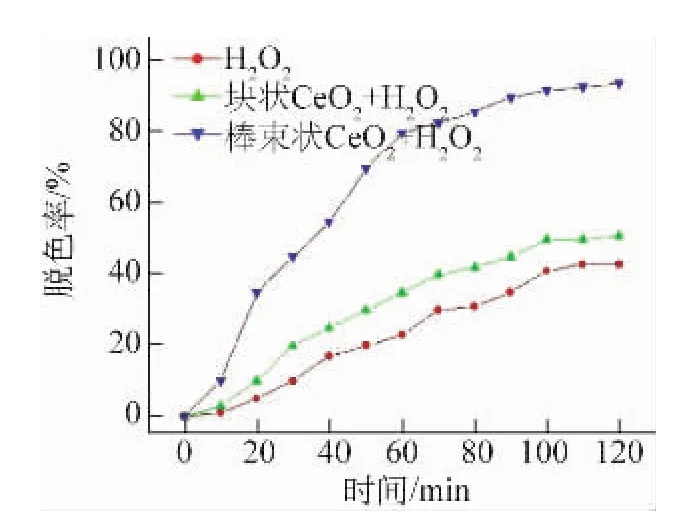
图8 不同试样对酸性品红溶液的催化降解曲线Fig.8 Catalytic degradation curves of differnet sam p les in acid fuchsin solution
3 结论
(1)反应温度、原料比、溶液pH和反应时间都会影响水热法制备CeO2粉体的结构;在反应温度为200℃、铈盐与草酸物质的量比为2∶3、溶液pH为1、反应时间为360 min的条件下合成的棒束状纳米CeO2粉体最佳。
(2)与块体CeO2相比,以较佳条件制备的棒束状纳米CeO2粉体对酸性品红溶液具有较高的催化脱色率。
[1]王炜,陈志刚,陈丰,等.以鱼鳞为模板制备氧化铈分级多孔材料[J].机械工程材料,2012,36(12):17-20,24.
[2]陈杨,隆仁伟,陈志刚,等.不同壳厚聚苯乙烯/氧化铈复合磨料的合成及其抛光特性[J].机械工程学报,2011,47(14):70-75.
[3]LIY Y,DONG X,GAO J,et al.A highly sensitive γ-radiation dosimeter based on the CeO2nanowires[J].Phys E:Low-Dimensional SysNanostruct,2009,41(8):1550-1553.
[4]PAN C S,ZHANG D S,SHI L Y.CTAB assisted hydrothermal synthesis,controlled conversion and CO oxidation properties of CeO2nanoplates,nanotubes,and nanorods[J].J Solid State Chem,2008,181(6):1298-1306.
[5]ZHANG D S,PAN C S,SHIL Y,et al.A highly reactive catalyst for CO oxidation:CeO2nanotubes synthesized using carbon nanotubes as removable templates[J].Micropor Mesopor Mater,2009,117(1/2):193-200.
[6]YANG Z J,YANG Y Z,LIANG H,etal.Hydrothermal synthesis ofmonodisperse CeO2nanocubes[J].Mater Lett,2009,63(21):1774-1777.
[7]GUO ZY,JIAN F F,DU F L.A simplemethod to controlled synthesis of CeO2hollow microspheres[J].Scr Mater,2009,61(1):48-51.
[8]LIX Z,CHEN F,LU X W,et al.Modified-EISA synthesis of mesoporous high surface area CeO2and catalytic property for CO oxidation[J].JRare Earths,2009,27(6):943-947.
[9]LA R J,HU Z A,LIH L,et al.Template Synthesis of CeO2Ordered Nanowire Arrays[J].Mater Sci Eng:A,2004,368(1/2):145-148.
[10]CHEN F,WANGW,CHEN ZG,et al.Biogenic synthesis and catalysis of porous CeO2hollow microspheres[J].JRare Earths,2012,30(4):350-354.
[11]CUIQ Z,DONG X T,WANG JX,et al.Direct fabrication of cerium oxide hollow nanofibers by electrospinning[J].J Rare Earths,2008,26(5):664-669.
[12]YANGX H,SHAOC L,LIU Y C,etal.Nanofibersof CeO2via an electrospinning technique[J].Thin Solid Films,2005,478(1/2):228-231.
[13]仲维卓,华素坤.晶体生长形态学[M].北京:科学出版社,1999:45-57.
[14]徐如人,庞文琴.无机合成与制备化学[M].北京:高等教育出版社,2006:128-163.
[15]栾宝平,余锡宾,刘洁,等.不同形貌的CeO2的水热法制备及表征[J].上海师范大学学报:自然科学版,2011,40(2):157-162.
[16]位忠斌,崔育倩,郭培志,等.二氧化铈八面体的水热合成与表征[J].无机化学学报,2011,27(7):1399-1404.
[17]LU X W,LIX Z,CHEN F,et al.Hydrothermal synthesis of prism-likemesocrystal CeO2[J].JAlloys Comp,2009,476(1/2):958-962.
[18]YABE S,SATO T.Cerium oxide for sunscreen cosmeties[J].Journal of Solid State Chemistry,2003,171:7-11.

