环氧合酶2表达与结直肠癌预后关系的Meta分析
,,
(青岛大学医学院流行病与卫生统计学教研室,山东 青岛 266021)
环氧合酶2表达与结直肠癌预后关系的Meta分析
谢竹田,张彧飞,姜文洁
(青岛大学医学院流行病与卫生统计学教研室,山东 青岛 266021)
目的探讨环氧合酶2(COX-2)的表达水平与结直肠癌预后的关系。方法检索PubMed、中国知网(CNKI)、中国生物医学文献数据库(CBM)以及万方数据库从建库开始至2013年8月期间,关于COX-2表达与结直肠癌预后关系研究的文献。根据异质性高低选择分析模型,若I2<50%,采用固定效应模型进行数据合并,否则采用随机效应模型。对纳入数据进行Meta回归、敏感性分析和发表偏倚分析。所有统计分析采用Stata 10.0软件。结果本研究共纳入18篇文献,结直肠癌病人2 710例。Meta分析结果显示,COX-2高表达与结直肠癌术后的总生存率以及无瘤生存率均呈负相关,其合并效应值HR及95%可信区间分别为:1.40(1.07~1.83)和1.79(1.32~2.43)。敏感性分析后结果与总结果一致。结论COX-2表达与结直肠癌术后病人预后情况呈负相关。
结直肠肿瘤;环氧化酶2;Meta分析;预后
结直肠癌是常见的消化系统肿瘤,严重威胁人类的健康。我国结直肠癌的发病率和死亡率与其他国家相比虽处于较低水平,但呈逐年上升的趋势[1]。尽管目前结直肠癌治疗取得了很大的进展,但是结直肠癌病人术后长期预后仍然未有显著的改善[2]。大量的研究结果表明,结直肠癌术后预后情况受多种因素的共同作用影响,如基因突变、表观遗传改变、慢性炎症以及饮食和生活方式等[3-4]。环氧合酶-2(COX-2)是前列腺素生物合成过程中的限速酶,其过度表达与多种上皮性肿瘤的发生[5],尤其是结直肠癌的发生有密切的关系。一些文献对COX-2表达水平与结直肠癌预后的关系进行了研究[6-23],然而这些研究结果之间存在不一致的情况,不能确定COX-2表达水平与结直肠癌病人术后长期预后的关系。本文采用Meta分析的方法,探讨COX-2表达水平对结直肠癌术后病人预后的意义。
1 资料与方法
1.1检索方法
分别检索PubMed、中国生物医学文献数据库(CBM)、中国知网(CNKI)以及万方数据库从建库开始至2013年8月期间,关于COX-2表达与结直肠癌预后关系研究的文献。以“colorectal cancer”、“cyclooxygenase-2”、“COX-2”、“PTGS-2”及“survival”为英文关键词,以“结直肠癌”、“癌症”、“环氧合酶2”以及“预后”作为中文关键词,以人类为研究对象进行检索。同时,手工检索原始文献的参考文献或相关综述。
1.2文献入选标准
入选标准如下:①所有病例均经病理学检查确认为结直肠癌;②所有研究都对COX-2表达与预后的关系进行了评价;③肿瘤组织中COX-2的表达皆由免疫组织化学法(IHC)或者逆转录-聚合酶链反应(RT-PCR)法测得;④生存风险比(HR)通过原始文献直接得到或者可以通过原始数据计算得到。
1.3数据的提取
由两名调查员按照统一的标准分别提取数据,并进行核对,若存在分歧,则通过讨论解决或咨询专家解决。提取的主要数据有:第一作者的姓名、发表年份、国家、样本量、平均年龄、平均随访时间、COX-2表达阳性和阴性的人数、生存分析以及HR值、95%可信区间(95%CI)。若文献未直接报道HR及95%可信区间,相关数据通过生存曲线获得。
1.4统计学方法
应用Stata 10.0软件进行统计学分析,采用Q检验对纳入的文献进行异质性检验,以I2评价异质性的大小,检验水准α=0.05。若I2<50%,说明研究间无统计学异质性,采用固定效应模型计算合并效应HR及95%CI;若I2≥50%,则采用随机效应模型。采用Meta回归探讨研究间异质性的潜在来源。采用敏感性分析降低研究间的异质性。采用BEGG等[24]方法进行发表偏倚的评估。
2 结 果
2.1文献纳入结果及基本特征
共有18篇文献纳入本次Meta分析。其中10篇提供了完整的生存数据,其余8篇生存数据从生存曲线中获得。本研究共纳入行结直肠癌根治术的病人2 713例。其中,1篇文献[16]中病人术前接受放疗与化疗,1篇文献[17]中病人术前接受放疗,4篇文献[9,13,18-19]中病人术前未接受任何辅助治疗,而其他文献均未表明术前是否接受其他辅助治疗。所有文献中病人术后均未接受辅助治疗。见表1。
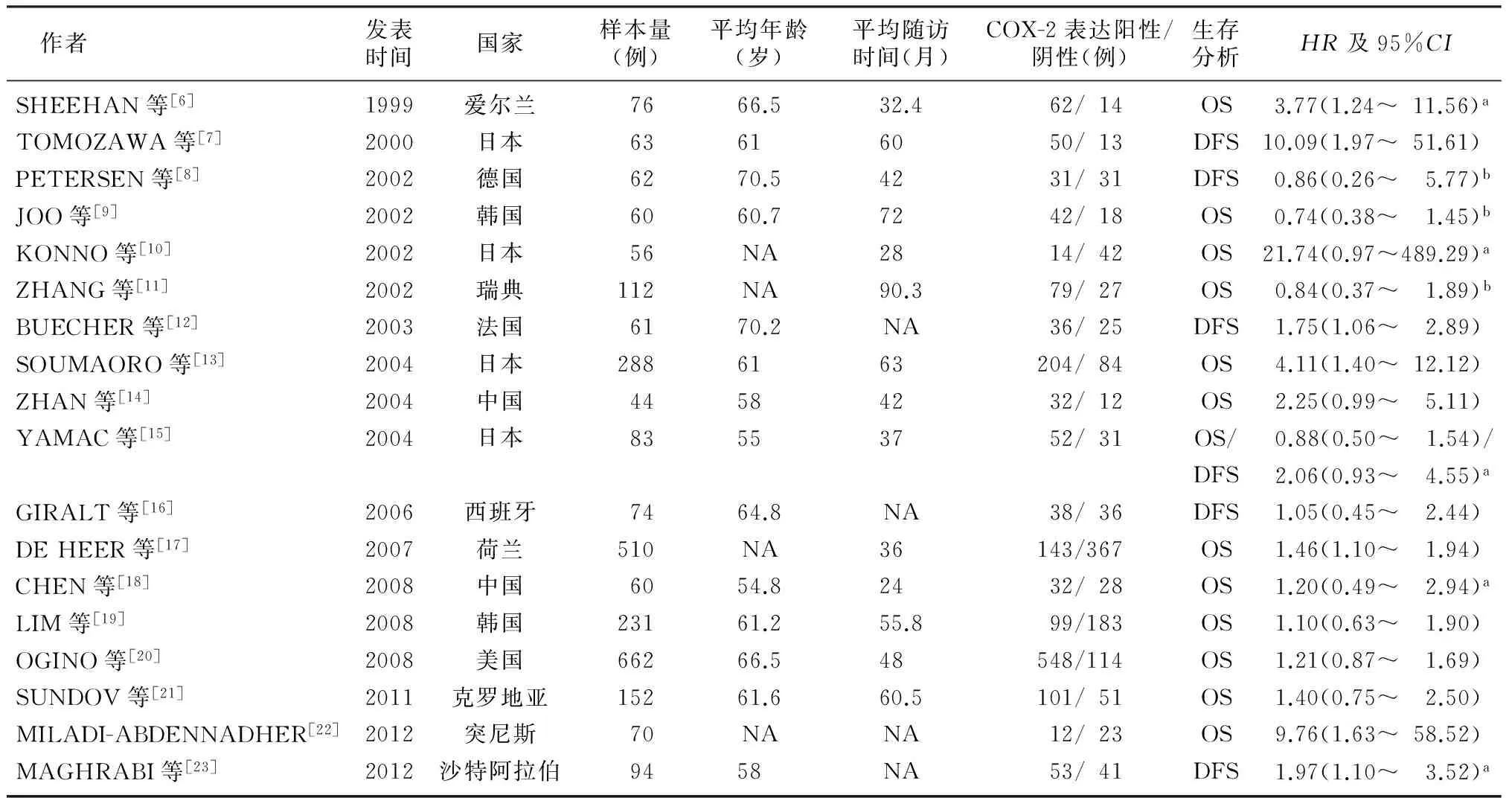
表1 纳入文献的基本情况
注:NA,未描述;OS,总生存率;DFS,无瘤生存率;a,95%CI通过HR和P值计算得到;b,HR和95%CI通过生存曲线计算得到。
2.2Meta分析
2.2.1COX-2表达与结直肠癌病人总生存率的关系 异质性分析I2=51%,表明各研究间存在明显的异质性,随机效应模型分析表明,COX-2高表达与结直肠癌病人预后呈负相关,合并的HR为1.40,95%CI为1.07~1.83。以种族为分层变量进行亚组分析,结果显示,高加索人COX-2高表达与总生存率呈负相关,HR为1.39,95%CI为1.15~1.69;亚洲人COX-2高表达与总生存率无关,合并效应值HR为1.36,95%CI为0.85~2.18(图1)。敏感性分析显示,对异质性产生显著影响的文献主要为文献[10]和[22]。在去掉这两篇文献后,异质性降低至39.5%,合并的效应值HR为1.29,95%CI为1.10~1.52,虽然合并的效应值有所减小,但结果没有明显改变。
2.2.2COX-2表达与无瘤生存率的关系 异质性分析结果I2=27.8%,说明各研究之间异质性较低,应采用固定效应模型进行数据合并,合并的效应值HR为1.79,95%CI为1.32~2.43。经敏感性分析去掉文献[7]之后,异质性降低为0(I2=0),合并效应值HR为1.68,95%CI为1.23~2.30,结果仍然具有统计学意义。
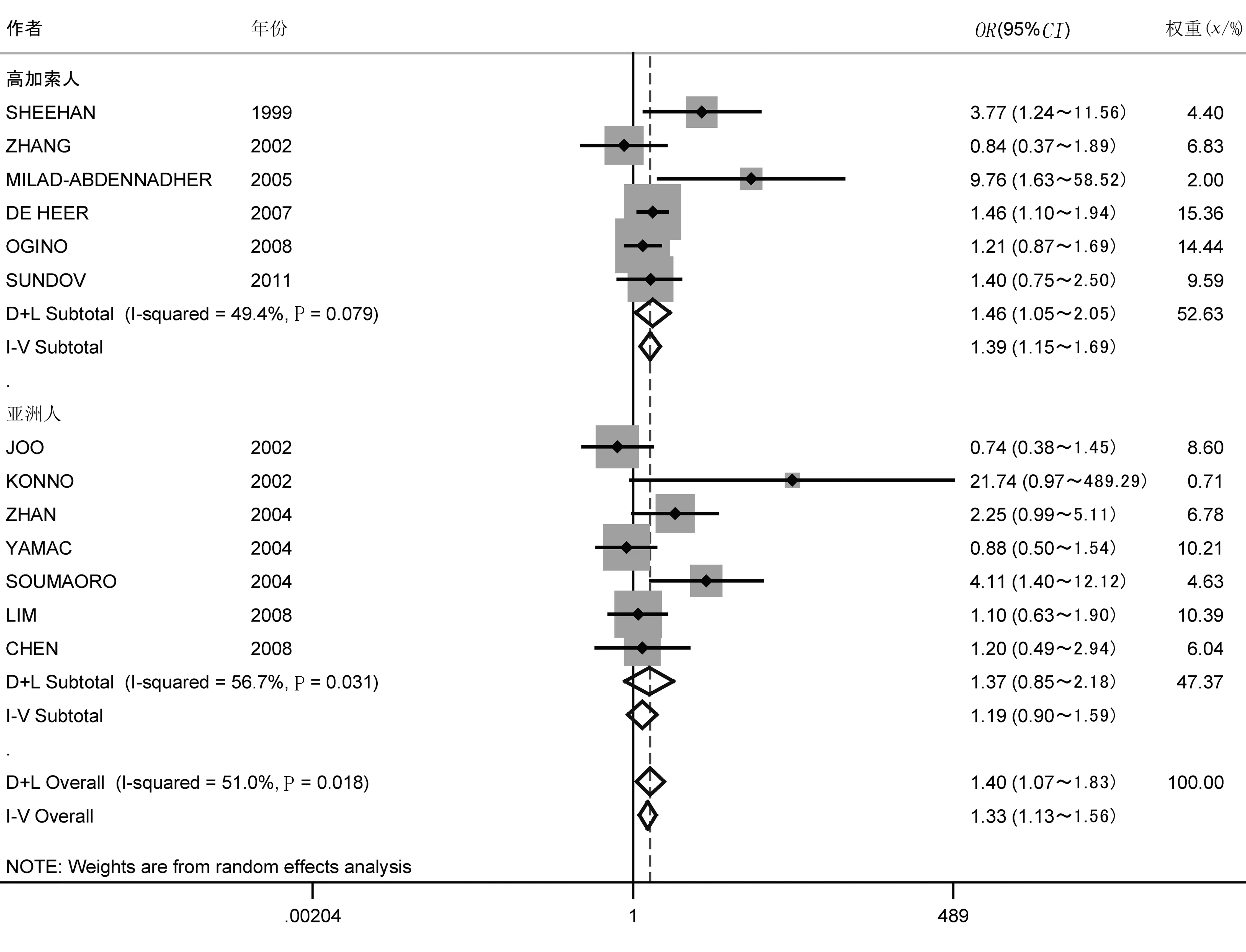
图1 COX-2表达与总生存率关系的森林图
2.3异质性分析
为了了解异质性的来源,对文献发表时间、研究对象种族、随访时间、性别、免疫组化临界值以及统计学方法进行单因素Meta回归分析,结果显示上述因素并不是研究间异质性的来源。
2.4发表偏倚分析
对于总生存率和无瘤生存率的发表偏倚分析显示,均未发现发表偏倚。
3 讨 论
COX是前列腺素生物合成过程中的限速酶,迄今为止,已经发现两种不同形式的COX,即结构型COX-1和诱导型COX-2[25]。COX-1和COX-2虽然在氨基酸水平上具有60%~65%的一致性,但是由两条不同染色体上的两个不同的基因编码,因此其功能和作用也不相同。COX-1持续在广泛的细胞和组织中表达,产生参与维持体内平衡的前列腺素;COX-2除了在胎盘、大脑和肾脏等一小部分组织中表达,在正常生理状态下几乎不表达,通常在炎症因子如白细胞介素-1、肿瘤坏死因子-1、脂多糖的刺激诱导下大量表达,其表达水平可增高8~10倍[26]。尽管COX-2可以引起一些生理反应(如排卵),但它大部分在病理状态下(主要是炎症反应和肿瘤形成)表达。目前研究认为,COX-2是与结直肠癌发生发展相关的最重要的酶之一。COX-2高表达已被证实能使肿瘤细胞增殖,抑制肿瘤细胞凋亡,影响细胞周期以及增加新血管生成,从而赋予肿瘤细胞一种生存优势[27-28]。已有研究显示,与癌周正常黏膜组织相比,结直肠癌组织中COX-2的表达升高。各种证据表明,COX-2是判断结直肠癌预后的一个非常有吸引力的分子标志物。但是,目前尚无研究能提供确凿的证据。
目前,关于COX-2表达水平与结直肠癌预后关系的单个研究样本量较小且得到的结论不一致,本文采用Meta分析的方法,将相关研究结果数据进行合并,通过增大样本量,提高检验效能,以期了解COX-2表达是否可以作为临床预后判断的一个指标。结果表明,高表达的COX-2与术后结直肠癌病人的预后呈负相关。在以敏感性分析去掉引起较大异质性的文献后,Meta分析的结果依然具有统计学意义,表明本研究结果是稳定的。研究间异质性是Meta分析的一个关键问题,因此,了解研究间的潜在异质性是本研究的一个重要方面。尽管纳入的研究结果调整了年龄、性别等常见的影响因素,但尚有一些因素存在于各研究间(如发表偏倚等),可能是异质性的来源。本文Meta回归结果显示,潜在的异质性来源(发表年份、种族和随访时间)对研究结果并无影响,研究间异质性可能是由其他因素引起的,如生活习惯和环境因素等。提示COX-2高表达是结直肠癌不良预后的一个独立的预测因素。
然而,在以后的研究中尚需要采用更好的设计、标准化的方法以及盲法收集临床数据,在同种类型的结直肠癌病人中进行前瞻性队列研究,以准确评估COX-2表达水平对结直肠癌预后的预测作用。
[1] 陈琼,刘志才,程兰平,等. 2003~2007年中国结直肠癌发病与死亡分析[J]. 中国肿瘤, 2012,21(3):179-182.
[2] RATTO C, SOFO L, IPPOLITI M, et al. Prognostic factors in colorectal cancer.Literature review for clinical application[J]. Dis Colon Rectum, 1998,41(8):1033-1049.
[3] DAHM C C, KEOGH R H, LENTJES M A, et al. Intake of dietary fats and colorectal cancer risk: prospective findings from the UK Dietary Cohort Consortium[J]. Cancer Epide-miol, 2010,34(5):562-567.
[4] WANG D, DUBOIS R N. The role of COX-2 in intestinal inflammation and colorectal cancer[J]. Oncogene, 2010,29(6):781-788.
[5] 罗波,孙立江. 膀胱移行细胞癌组织VEGF和COX-2表达及意义[J]. 青岛大学医学院学报, 2009,45(1):29-31,34.
[6] SHEEHAN K M, SHEAHAN K, O'DONOGHUE D P, et al. The relationship between cyclooxygenase-2 expression and colorectal cancer[J]. JAMA, 1999,282(13):1254-1257.
[7] TOMOZAWA S, TSUNO N H, SUNAMI E, et al. Cycloox-
ygenase-2 overexpression correlates with tumour recurrence, especially haematogenous metastasis, of colorectal cancer[J]. Br J Cancer, 2000,83(3):324-328.
[8] PETERSEN S, HAROSKE G, HELLMICH G, et al. COX-2 expression in rectal carcinoma: immunohistochemical pattern and clinical outcome[J]. Anticancer Res, 2002,22(2B):1225-1230.
[9] JOO Y E, KIM H S, MIN S W, et al. Expression of cyclooxygenase-2 protein in colorectal carcinomas[J]. Int J Gastrointest Cancer, 2002,31(1/3):147-154.
[10] KONNO H, BABA M, SHOJI T, et al. Cyclooxygenase-2 expression correlates with uPAR levels and is responsible for poor prognosis of colorectal cancer[J]. Clin Exp Metastasis, 2002,19(6):527-534.
[11] ZHANG H, SUN X F. Overexpression of cyclooxygenase-2 correlates with advanced stages of colorectal cancer[J]. Am J Gastroenterol, 2002,97(4):1037-1041.
[12] BUECHER B, HEYMANN M F, LIEVRE A, et al. Cyclo-oxygenase-2 over-expression in sporadic colorectal carcinoma without lymph node involvement[J]. Aliment Pharmacol Ther, 2003,18(7):731-740.
[13] SOUMAORO L T, UETAKE H, HIGUCHI T, et al. Cyclooxygenase-2 expression: a significant prognostic indicator for patients with colorectal cancer[J]. Clin Cancer Res, 2004,10(24):8465-8471.
[14] ZHAN J, LIU J P, ZHU Z H, et al. Relationship between COX-2 expression and clinicopathological features of colorectal cancers[J]. Chin Med J (Engl), 2004,117(8):1151-1154.
[15] YAMAC D, CELENKOGLU G, COSKUN U, et al. Prognostic importance of COX-2 expression in patients with colorectal cancer[J]. Pathol Res Pract, 2005,201(7):497-502.
[16] GIRALT J, NAVALPOTRO B, HERMOSILLA E, et al. Prognostic significance of vascular endothelial growth factor and cyclooxygenase-2 in patients with rectal cancer treated with preoperative radiotherapy[J]. Oncology, 2006,71(5/6):312-319.
[17] DE HEER P, GOSENS M J, DE BRUIN E C, et al. Cyclooxygenase 2 expression in rectal cancer is of prognostic significance in patients receiving preoperative radiotherapy[J]. Clin Cancer Res, 2007,13(10):2955-2960.
[18] CHEN S, LIU J, LI G, et al. Altered distribution of beta-catenin and prognostic roles in colorectal carcinogenesis[J]. Scand J Gastroenterol, 2008,43(4):456-464.
[19] LIM S C, LEE T B, CHOI C H, et al. Prognostic significance of cyclooxygenase-2 expression and nuclear p53 accumulation in patients with colorectal cancer[J]. J Surg Oncol, 2008,97(1):51-56.
[20] OGINO S, KIRKNER G J, NOSHO K, et al. Cyclooxygenase-2 expression is an independent predictor of poor prognosis in colon cancer[J]. Clin Cancer Res, 2008,14(24):8221-8227.
[21] SUNDOV Z, KUNAC N, CAPKUN V, et al. Cyclooxygenase-2 in dukes B colon cancer[J]. Hepatogastroenterology, 2011,58(17/18):763-768.
[22] MILADI-ABDENNADHER I, ABDELMAKSOUD-DAMMAK R, AYED-GUERFALI D B, et al. Expression of COX-2 and E-cadherin in Tunisian patients with colorectal adenocarcinoma[J]. Acta Histochem, 2012,114(6):577-581.
[23] AL-MAGHRABI J, BUHMEIDA A, EMAM E, et al. Cyclooxygenase-2 expression as a predictor of outcome in colorectal carcinoma[J]. World J Gastroenterol, 2012,18(15):1793-1799.
[24] BEGG C B, MAZUMDAR M. Operating characteristics of a rank correlation test for publication bias[J]. Biometrics, 1994,50(4):1088-1101.
[25] 罗波,张劲峰. 环氧化酶-2蛋白在膀胱移行细胞癌中的表达及意义[J]. 青岛大学医学院学报, 2005,41(3):235-236,239.
[26] MASFERRER J L, ZWEIFEL B S, SEIBERT K, et al. Selective regulation of cellular cyclooxygenase by dexamethasone and endotoxin in mice[J]. J Clin Invest, 1990,86(4):1375-1379.
[27] TSUJII M, DUBOIS R N. Alterations in cellular adhesion and apoptosis in epithelial cells overexpressing prostaglandin endoperoxide synthase 2[J]. Cell, 1995,83(3):493-501.
[28] TSUJII M, KAWANO S, TSUJI S, et al. Cyclooxygenase regulates angiogenesis induced by colon cancer cells[J]. Cell, 1998,93(5):705-716.
(本文编辑 黄建乡)
ASSOCIATIONOFEXPRESSIONOFCYCLOOXYGENASE-2WITHTHEPROGNOSISOFCOLORECTALCANCERAMETA-ANALYSIS
XIEZhutian,ZHANGYufei,JIANGWenjie
(Department of Epidemiology and Health Statistics, Qingdao University Medical College, Qingdao 266021, China)
ObjectiveTo assess the correlation between cyclooxygenase-2 (COX-2) status and the prognosis of colorectal cancer (CRC).MethodsEligible studies concerning the correlation between COX-2 and prognosis of CRC were collected by searching Pub Med, China National Knowledge Infrastructure (CNKI), China Biological Medical literature database (CBM), and Wanfang database up to August 2013.I2was used to evaluate heterogeneity between studies. IfI2<50%, the fixed-effect model was adopted as the pooling method; otherwise, the random-effect model would be used. Meta-regression and sensitivity analysis were performed,and publication basis was estimated.ResultsA total of 18 studies with 2 713 patients were included in this study. The result showed that high COX-2 expression was associated with poor prognosis of overall survival (OS) (HR=1.40,95%CI=1.07-1.83) and disease free survival (DFS) (HR=1.79,95%CI=1.32-2.43) after surgery for CRC. The results of sensitivity analysis were consistent with the overall results.ConclusionThe expression of COX-2 is negatively correlated with the prognosis of patients after surgery for colorectal cancer.
colorectal neoplasms; cyclooxygenase 2; Meta-analysis; prognosis
2013-09-04;
2014-04-25
谢竹田(1987-),女,硕士研究生。
姜文洁(1965-),女,副教授,硕士生导师。
R181.2;R735.34
A
1008-0341(2014)03-0192-04

