环孢素A对严重创伤失血性休克大鼠的治疗作用
杨光明,彭小勇,李 涛,徐 竞,刘良明 (第三军医大学大坪医院野战外科研究所第二研究室,创伤、烧伤与复合伤国家重点实验室,重庆 400042)
环孢素A(cyclosporin A,CsA)是一种由11个氨基酸组成的环状多肽,作为一种免疫抑制剂,已广泛应用于抑制器官移植术后的排斥反应和自身免疫性疾病的治疗。CsA能够抑制线粒体通透性转换孔(mitochondrial permeability transition pore,MPTP)的开放,在缺血缺氧再灌注引起的心、脑等器官损伤中发挥保护作用[1-2]。线粒体MPTP是位于线粒体内外膜间的多蛋白孔道,在线粒体功能调节和细胞缺血缺氧性损伤过程中发挥着重要作用[3-4]。但是,在休克状态下,通过抑制线粒体MPTP能否改善病理条件下的心血管功能,实现对休克动物的保护作用,目前尚不清楚。我们采用大鼠创伤失血性休克模型,观察不同剂量CsA对休克大鼠存活时间、24 h存活率、平均动脉血压及血流动力学指标的影响,以明确CsA是否对创伤失血性休克大鼠具有保护作用及其适宜的治疗剂量。
1 材料与方法
1.1 实验动物
SD大鼠144只,雌雄各半,体质量180~220 g,由第三军医大学野战外科研究所实验动物中心提供。
1.2 实验分组及方法
1.2.1 CsA对创伤失血性休克大鼠24 h存活率和存活时间的影响 实验分6组,分别为正常对照组、休克对照组、乳酸林格氏液(LR)复苏组、CsA 1 mg/kg组、CsA 5 mg/kg组、CsA 10 mg/kg组。每组16只动物。创伤失血性休克模型的建立方法[5]:用3%戊巴比妥钠麻醉动物,右侧股动脉和股静脉插管,分别用于观察血压、放血和给药复苏,经插管注射肝素钠生理盐水(500 U/kg)抗凝。用老虎钳折断左侧股骨,通过股动脉插管10 min内放血至血压40 mmHg,维持3 h。各实验组的给药复苏方法:LR复苏组给予2倍失血量的LR输注,CsA 1、5、10 mg/kg组分别在2倍失血量的LR中加入CsA 1、5、10 mg/kg后输注。复苏均使用输液泵,输注速度为20 mL/h,约30 min输注完毕。休克对照组在休克模型建立后不予复苏治疗。复苏完毕后拔除各血管插管,结扎血管,缝合伤口,肌肉注射青霉素和链霉素(105U/kg),给予正常饮食,观察动物存活情况至24 h,记录存活时间并计算存活率。
1.2.2 CsA对创伤失血性休克大鼠血流动力学的影响 实验分组同上,每组8只动物,模型的复制及复苏方法同上。经右颈动脉插管至左心室,连接血流动力学测定仪(Power Lab,澳大利亚AD Instrument公司),分别在休克前、休克末、复苏1 h、2 h测定血流动力学指标[6],包括左心室收缩压(LVSP)、左心室舒张末压(LVEDP)、左心室压力最大上升/下降速率(±dp/dtmax)和心率(HR)。
1.3 统计学处理
2 结果
2.1 对创伤失血性休克大鼠存活情况的影响
正常对照组中全部大鼠存活均超过24 h;休克对照组大鼠在休克后8 h内全部死亡,平均存活时间约为3 h;LR复苏组24 h存活率为25%,平均存活时间为11.4 h;CsA 1 mg/kg输注后,大鼠存活时间和24 h存活率分别为12.8 h和31.2%,略高于LR组;CsA 5 mg/kg和10 mg/kg输注可明显改善休克动物的存活情况,存活时间分别为 17.9、17.3 h,24 h存活率均为56.3%(图1)。
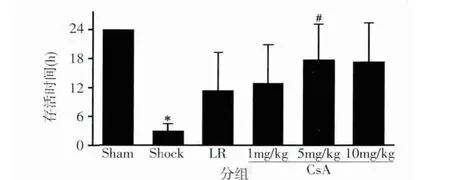
图1 CsA对创伤失血性休克大鼠存活时间的影响
2.2 对创伤失血性休克大鼠MAP和HR的影响
休克后大鼠MAP显著降低,复苏后MAP均有不同程度升高。不同剂量的CsA输注后都能升高创伤失血性休克大鼠MAP,高于LR复苏组。在复苏2 h时,休克对照组、LR复苏组、CsA 1 mg/kg、5 mg/kg、10 mg/kg 组大鼠 MAP 分别为(40.8±12.3)(51.1 ±9.7)(62.3 ±12.0)(67.1 ±6.3)(66.3 ± 5.8)mmHg,分别为正常对照组的 37.3%、46.7%、56.9%、61.3%、60.5%,其中CsA 5 mg/kg和10 mg/kg组与LR组之间存在统计学差异(P<0.05)。CsA输注也恢复了休克后降低的HR,但CsA各剂量组与LR组之间无统计学差异。
2.3 对创伤失血性休克大鼠LVSP和LVEDP的影响
休克后各组LVSP均明显降低,输注LR后LVSP回升至(73.6 ±14.3)mmHg,但显著低于正常对照组(127.1 ±14.2)mmHg(P<0.01)。CsA 5 mg/kg和10 mg/kg输注可明显升高LVSP,在输液后2 h时LVSP分别为(121.2±14.4)mmHg和(119.9±15.2)mmHg,明显高于LR组(P<0.05),并接近正常水平;CsA 1 mg/kg输注也升高了休克大鼠LVSP,但与LR组比较无显著差异。各组间LVEDP无统计学差异。
2.4 对创伤失血性休克大鼠±dp/dtmax的影响
休克后各组的±dp/dtmax均明显下降,各剂量CsA输注可使降低的±dp/dtmax明显回升,其中CsA 5 mg/kg组和10 mg/kg组的效果较为显著。在输液后2 h时,LR复苏组的±dp/dtmax分别为(5 118.0±892.0)mmHg/s和 (-4 689.1±531.1)mmHg/s,而 CsA 5 mg/kg 组 分 别 为 (6 424.2 ±674.1)mmHg/s、(-5 783.6 ± 721.7)mmHg/s,CsA 10 mg/kg组的 ±dp/dtmax分别为(6 343.0 ±618.9)mmHg/s、(-5 737.5±522.2)mmHg/s,明显高于 LR 复苏组(P <0.05),并接近正常水平;CsA 1 mg/kg输注的效果与LR组比较无显著性差异。
3 讨论
线粒体通透性转换是损害性刺激(如氧化应激、钙超载、缺氧和细胞毒性药物等)引起线粒体膜通透性发生突然升高的一种现象,它在线粒体损伤及随后的细胞功能障碍、细胞凋亡或坏死中扮演重要角色[7]。目前认为线粒体通透性转换是由线粒体通透性转换孔(MPTP)开放所引起。MPTP是横跨线粒体内、外膜之间的非选择性通道,但其具体组成尚不完全清楚,通常认为它是由位于线粒体内、外膜上多种蛋白组成的复合孔道,主要由外膜的电压依赖性阴离子通道(VDAC)、内膜的腺苷酸转移酶(ANT)和基质的亲环蛋白D(CyP-D)组成[8-9]。近来研究表明,MPTP开放在组织细胞的缺血性、氧化性损害中起着重要作用。采用MPTP的抑制剂环孢素A(CsA)处理,可明显减轻缺血-再灌注和缺氧-复氧所引起的心肌和脑组织损伤[1,2,10]。采用 CsA 抑制线粒体 MPTP 开放能否改善休克动物的心血管功能、发挥抗休克作用目前尚不清楚。本研究采用大鼠创伤失血性休克模型研究CsA对休克动物存活时间、24 h存活率、平均动脉血压及血流动力学指标的影响。结果发现,CsA可明显延长休克大鼠的存活时间,提高24 h存活率,改善休克后血流动力学指标MAP、LVSP、±dp/dtmax,表明CsA对创伤失血性休克有较好的治疗作用。
环孢素A(CsA)作为一种强效免疫抑制剂,已广泛用于器官移植术后的排斥反应,随着研究的深入,CsA在自身免疫性疾病、血液病、皮肤病和呼吸系统疾病等方面的治疗作用也逐步被发现。但是,在临床应用中,CsA在用药剂量过大或用药时间过长时会引起严重的不良反应,包括肝毒性、肾毒性、神经毒性和胃肠道反应等[11]。因此,选择适宜的剂量和给药方式对发挥CsA的治疗作用、减少不良反应十分重要。本实验采用静脉一次性给药的方式,观察3种剂量的CsA(1、5、10 mg/kg)的抗休克作用,发现 5 mg/kg和10 mg/kg的CsA均有明显的改善血流动力学、提高休克动物存活率的作用,而CsA 1 mg/kg的治疗作用与LR组相比无统计学差异。结果提示,5 mg/kg和10 mg/kg的CsA都显示了较好的抗休克作用,且两者的治疗效果无明显差异,那么在临床应用中 CsA 5 mg/kg可能是较好的选择,采用这一剂量能在发挥CsA治疗作用的同时减少其不良反应。
本实验结果表明环孢素A具有较好的抗创伤失血性休克作用,其中以5 mg/kg和10 mg/kg的效果较为明显。这一研究发现为以线粒体MPTP为调节靶点、将MPTP抑制剂CsA应用于创伤休克的治疗提供了理论基础,但CsA对重要生命器官功能的影响如何,需要进一步研究证明。
[1]Gill RS,Lee TF,Manouchehri N,et al.Postresuscitation cyclosporine treatment attenuates myocardial and cardiac mitochondrial injury in newborn piglets with asphyxia-reoxygenation[J].Crit Care Med,2013,41(4):1069-1074.
[2]Hausenloy DJ,Boston-Griffiths EA,Yellon DM.Cyclosporin A and cardioprotection:from investigative tool to therapeutic agent[J].Br J Pharmacol,2012,165(5):1235 -1245.
[3]Vianello A,Casolo V,Petrussa E,et al.The mitochondrial permeability transition pore(PTP)-an example of multiple molecular exaptation[J].Biochim Biophys Acta,2012,1817(11):2072 -2086.
[4]Assaly R,de Tassigny Ad,Paradis S,et al.Oxidative stress,mitochondrial permeability transition pore opening and cell death during hypoxiareoxygenation in adult cardiomyocytes[J].Eur J Pharmacol,2012,675(1-3):6-14.
[5]杨光明,李 涛,徐 竞,等.细胞外信号调节激酶在失血性休克后活性变化及其在血管反应性调节中的作用[J].中华实验外科杂志,2011,28(6):907 -910.
[6]Li T,Lin X,Zhu Y,et al.Short-term,mild hypothermia can increase the beneficial effect of permissive hypotension on uncontrolled hemorrhagic shock in rats[J].Anesthesiology,2012,116(6):1288 -1298.
[7]Ruiz-Meana M.Ischaemic preconditioning and mitochondrial permeability transition:a long-lasting relationship[J].Cardiovasc Res,2012,96(2):157-159.
[8]Elrod JW,Molkentin JD.Physiologic functions of cyclophilin D and the mitochondrial permeability transition pore[J].Circ J,2013,77(5):1111-1122.
[9]Giorgio V,von Stockum S,Antoniel M,et al.Dimers of mitochondrial ATP synthase form the permeability transition pore[J].Proc Natl Acad Sci USA,2013,110(15):5887 -5892.
[10]Diaz RJ,Fernandes K,Lytvyn Y,et al.Enhanced cell-volume regulation in cyclosporin A cardioprotection[J].Cardiovasc Res,2013,98(3):411-419.
[11]张 燊,张治明,苏泽轩.钙蛋白酶抑制剂E-64对于环孢素A诱发小鼠肾脏损伤的保护作用[J].中华实验外科杂志,2011,28(12):2083-2085.

