乳腺癌术后骨转移患者血清差异蛋白的质谱分析*
张 朋,锡林宝勒日,白靖平,江仁兵,陈勇忠,黄 哲,李 星
(1.南京军区福州总院四七六医院骨科,福州350000;2.新疆医科大学附属肿瘤医院骨与软组织肿瘤科,乌鲁木齐830011;3.凡星博奥北京科技有限公司,北京100080)
术后肿瘤复发和转移是乳腺癌患者死亡的主要原因,其中骨转移的发生率为65%~75%,首发症状为骨转移的患者占27%~50%[1-2]。乳癌患者一旦发生骨转移,5年生存率仅为20%,并且还可引起一系列的并发症,比如骨痛、骨损伤以及骨相关事件(SEEs)[1],是目前临床上降低乳腺癌患者生活质量和影响患者生存的重要因素。本研究采用Clinprot液体芯片飞行时间质谱系统(ClinprotTMMALDI-TOF MS)分析并筛选乳腺癌术后骨转移与无转移患者的血清差异蛋白,为寻找乳腺癌骨转移相关的血清标志物提供实验依据,同时为进一步阐明乳癌骨转移的分子机制以及开发逆转骨转移的靶向药物提供理论研究基础,现报道如下。
1 资料与方法
1.1 一般资料 收集2009年2月至2010年10月在新疆医科大学附属肿瘤医院住院复查的女性乳腺癌改良根治术后患者36例,术后病理组织学诊断均为乳腺浸润性导管癌。分组:(1)乳腺癌改良根治术术后单纯骨转移(M组)共18例。其中原发乳癌分期Ⅱ期6例,Ⅲ期12例。年龄37~77岁,平均(52.72±11.89)岁;术后至骨转移时间为9~122个月,平均33.7个月;所有患者均已行足疗程化疗,其中5例ER(+)、PR(+),9例ER/PR(+)均行内分泌治疗。入组者均经ECT及局部CT、MRI 3项检查诊断,其中4例因椎体破坏疼痛剧烈行经皮穿刺椎体成形术,术后病灶组织病理结果支持诊断;且经B超等相关检查未发现重要脏器转移。抽血时间为诊断次日晨。(2)乳腺癌改良根治术术后无转移组(S组),共18例。组织学病理分期及术后时间均与M组相匹配的患者,年龄34~74岁,平均(52.89±12.37)岁;所有患者均已行足疗程化疗,其中6例ER(+)、PR(+),9例ER/PR(+)均行内分泌治疗。入组者均经骨放射性核素扫描(ECT)检查未见明显异常;B超等相关检查未发现重要脏器转移。两组患者年龄等一般资料差异无统计学意义(P>0.05),具有可比性,本研究经患者知情同意和并经新疆医科大学伦理委员会通过。
1.2 主要试剂与仪器 丙酮、乙腈、乙醇、醋酸铵(NH4Ac)、Peptide Calibration Standard、Protein Calibration StandardⅠ、弱阳离子交换磁珠(MB-WCX)、三氟乙酸(TFA)、Tris-HCL等均购自Sigma公司;MALDI-TOF-MS质谱仪及配套的Clin-ProTools分析软件购自Bruker Daltonik公司。
1.3 方法
1.3.1 标本采集及处理 空腹抽取36例患者全血3mL,室温下静置1h,3 000r/min离心5min,取上清液加入对应标号的冷冻管中,每20μL一管分装,-80℃保存。
1.3.3 试验方法
1.3.3.1 弱阳离子磁珠(MB-WCX)的处理 (1)取10μL磁珠和10μL磁珠结合缓冲液(BB),混匀;(2)加入5μL血清,吹打混均;(3)置于磁珠分离器,静置1min,移去上清液;(4)加入100μL磁珠清洗缓冲液(WB),静置1min,移去上清液;(5)重复步骤(4)2次;(6)加入5μL磁珠洗脱缓冲液(EB),混匀;静置2min,将洗脱液移入样品管;(7)向洗脱液中加入5μL磁珠稳定缓冲液(SB)混匀,-20℃保存至质谱分析。
1.3.3.2 标准血清质控 标准血清经磁珠处理得到洗脱液,用质谱采集数据,每批数据采集完毕,与数据库已有对应的相同磁珠相同采集方法的标准血清数据比较,变异系数(CV)<30%。
1.3.3.3 样品点靶 取5μL的0.4mg/mL HCCA基质,加入1μL的样品洗脱液,吹打混匀;取1μL上述混合液体,点在600μm Anchorchip上,室温干燥。
1.3.3.4 样品谱图的生成 采用Clinprot液体芯片飞行时间质谱系统获取两组患者血清肽质量指定图谱(PMF)。(1)在Clinprot Standard校正方法下,对累加标准品图谱进行校正,平均分子质量偏差应小于100ppm。(2)将样品靶板放入Microflex质谱仪,设定采集范围:(1~20)×103Da,激光能量:采用高激光能量轰一下结晶点8shots,再用低于高激光能量10%~20%的能量采集50shots;(3)同一样品同一结晶点,调整采集点,累加8个点的数据(400shots)。保存累加的PMF。
1.4 统计学处理 采用ClinProTools软件分析前先对样品原始质谱图进行处理,然后选择软件内嵌的统计算法对数据进行统计学分析,获得两组血清的差异表达蛋白,计量资料以x±s表示,以P<0.05为差异有统计学意义。
2 结 果
2.1 质谱检测的重复性验证 试验前将所有标本分成2份,5 d后重复检测,试剂材料、方法步骤同前。结果显示两次PMF基本一致,随机选择4个蛋白峰计算CV均小于30%,该系统具有良好的可重复性,见图1、2。
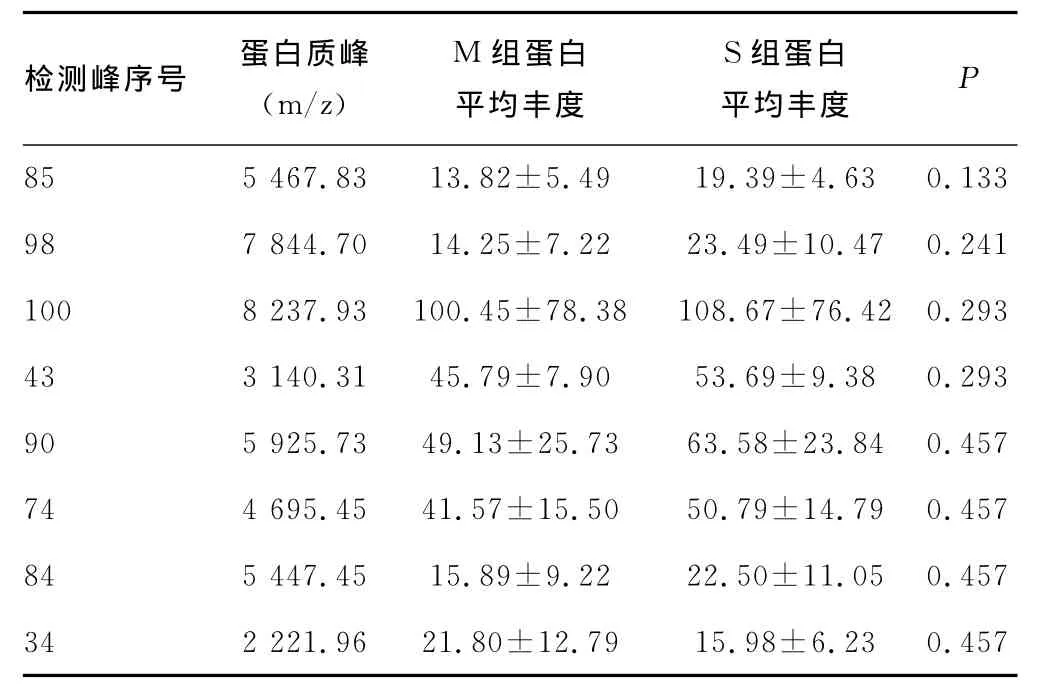
2.2 蛋白质谱分析 采用Biomarker Wizard软件进行数据分析,未检测到有统计学意义的蛋白质峰谱差异,未能建立诊断模型,见表1。
续表1 蛋白质谱统计学分析

图1 M组2次重复试验的PMF

图2 S组2次重复试验的PMF
2.3 对差异最显著的M8063.25Da和M9772.81Da进行分析
在M组各个样品谱图中M8063.25Da和M9772.81Da的丰度大部分低于S组。平均图谱中M组的M8063.25Da和M9772.81Da蛋白峰明显低于S组,但差异无统计学意义(P>0.05),见图3~5。

图3 两组样本中M8063.25Da和M9772.81Da的质谱堆积图

表1 蛋白质谱统计学分析
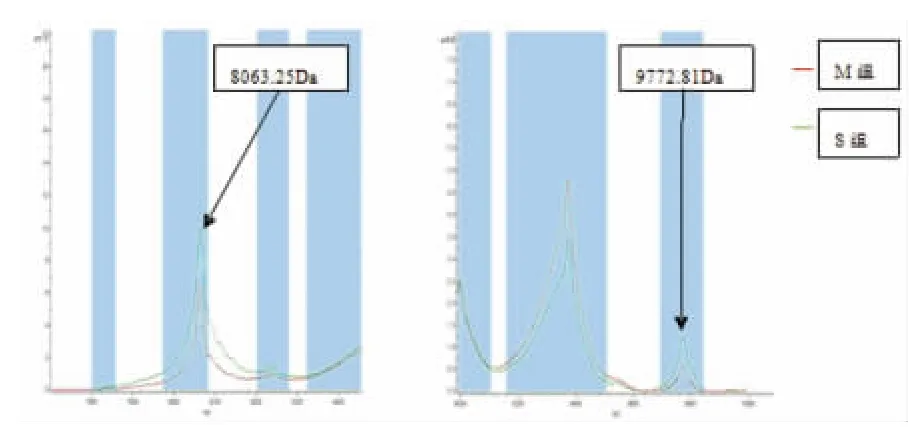
图4 两组样本中M8063.25Da和M9772.81Da的平均质谱图
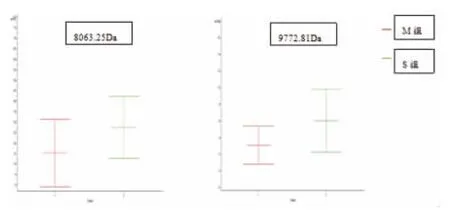
图5 两组样本中M8063.25Da和M9772.81Da的平均值标准差比较图
3 讨 论
ClinprotTM液体芯片飞行时间质谱系统由功能磁珠、基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)、ANCHORCHIP技术和ClinProTools的生物信息学方法组成,已广泛应用于肿瘤标志物的筛选、鉴定和疾病诊断模型的建立,如口腔癌[3]、卵巢癌[4]、肾细胞癌[5]、肺癌[6]、食管癌[7]、胃癌[8]、胰腺癌[9]、头颈部恶性肿瘤[10]等疾病,并获得了令人满意的效果。
本研究采用Clinprot系统获得乳腺癌术后骨转移与无转移患者血清PMF,发现两组血清蛋白的表达在一定程度上存在差异,但差异无统计学意义(P>0.05)。
本研究没有检测到两组间的差异蛋白,未能建立乳腺癌骨转移的诊断模型。分析其原因可能为:(1)骨髓微转移(BMM)的影响。BMM理论:乳腺癌是一种全身性疾病,肿瘤细胞在早期就经血流播散出现远处转移,即便原发肿瘤被切除,隐匿在体内的微小转移癌灶仍继续发展。患者常无任何临床表现,常规影像学检查及常规病理检查均难以发现。Slade等[11]对23例原发性乳腺癌外周血及骨髓进行微转移检测,外周血阳性率为13%,骨髓检出率为61%。提示在乳腺癌BMM的诊断中,外周血的检出率明显低于骨髓检出率,外周血检测不能替代骨髓检测。之后,Slade等[12]报道应用定量PCR及免疫组织化学检查外周血细胞角蛋白19(CK-19)发现,手术前51%患者存在BMM。收集的91例标本中,采用定量PCR、免疫组织化学分别发现87%和65%的患者在随访期间出现BMM现象。因本研究患者均由CT、MRI或ECT等常规检查确定诊断,不排除BMM对试验结果的影响。(2)全身化疗的影响。化疗可减少或消灭微转移灶,抑制微转移灶的扩展,减少生长刺激因子的释放,减少甚至杀灭肿瘤细胞。国内外均有试验证实乳腺癌患者化疗后外周血微转移因子水平明显下降。Manhani等[13]利用 RT-PCR检测乳腺癌患者 CK-19,阳性率由化疗前的43.0%降至14.3%(3周期化疗)和18.9%(6周期化疗)。Zheng等[14]采用巢式RT-PCR方法检测乳腺癌患者外周血中泌乳素诱导蛋白(PIP)mRNA的表达变化发现,PIP表达阳性的患者中有76.5%化疗后转为阴性。Zhang等[15]经半定量 RT-PCR检测乳腺癌患者 CK-20mRNA,化疗后31.8%转为阴性,47.7%表达明显下降。本研究中两组患者均已接受化疗,均可能对试验结果产生一定影响。(3)内分泌治疗的影响。乳腺癌的发生与雌激素的水平有关,内分泌治疗可改变激素依赖性肿瘤生长所需的内分泌微环境,使肿瘤细胞增殖停滞于G0或G1期,从而抑制肿瘤细胞的生长、增殖。两组中均有部分患者接受内分泌治疗,不排除治疗对试验结果的影响。(4)由于研究经费及时间限制,有限的血清样品只重复检测了2次。
综上所述,乳腺浸润性导管癌改良根治术后单纯骨转移与无转移患者不存在血清差异蛋白,不能通过检测外周血的方法筛选乳腺癌骨转移差异蛋白。通过上述研究,为笔者下一步加入骨髓进行对照检测,增加样本量及重复检测次数奠定了基础。笔者希望能够筛选出敏感性高、特异性强的肿瘤标志物,最终能广泛应用于乳腺癌骨转移的筛查。
[1]孙燕,于世英,江泽飞,等.恶性骨肿瘤骨转移及骨相关疾病临床诊疗专家共识[M].北京:北京大学医学出版社,2010:1-10.
[2]Akhtari M,Mensuri J,Newman KA,et al.Biology of breast cancer bone matastasis[J].Cancer Biol Ther,2008,7(1):3-9.
[3]Cheng AJ,Chen LC,Chien KY,et al.Oral cancer plasma tumor marker identified with bead-based affinity-fractionated proteomic technology[J].Clin Chem,2005,51(12):2236-2244.
[4]Ziganshin RKh,Alekseev DG,Arapidi GP,et al.Serum proteome profiling for ovarion cancer diagnosis using ClinProt magnetic bead technique and MALDI-TOF mass spectrometry[J].Biomed Khim,2008,54(4):408-419.
[5]Chinello C,Gianazza E,Zoppis I,et al.Serum biomarkers of renal cell carcinoma assessed using aprotein profiling approach based on ClinProt technique[J].Urology,2010,75(4):842-847.
[6]Du J,Yang S,Lin X,et al.Use of anchorchip-time-offlight spectrometry technology to screen tumor biomarker proteins in serum for small cell lung cancer[J].Diagn Pathol,2010,5:60.
[7]Liu LH,Shan BE,Tian ZQ,et al.Potential biomarkers for esophageal carcinoma detected by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry[J].Clin Chem Lab Med,2010,48(6):855-861.
[8]Liu W,Gao X,Cai Q,et al.Identification of novel serum biomarkers for gastric cancer by magnetic bead[J].Front Biosci(Elite Ed),2010,2:961-971.
[9]Kojima K,Asmellash S,Klug CA,et al.Applying proteomic-based biomarker tools for the accurate diagnosis of pancreatic cancer[J].J Gastrointest Surg,2008,12(10):1683-1690.
[10]Freed GL,Cazares LH,Fichandler CE,et al.Differential capture of serum proteins for expression profiling and biomarker discovery in pre-and posttreatment head and neck cancer samples[J].Laryngoscope,2008,118(1):61-68.
[11]Slade MJ,Smith BM,Sinnett HD,et al.Quantitative polymerase chain reaction for the detection of micrometastases in patients with breast cancer[J].J Clin Oncol,1999,17(3):870-879.
[12]Slade M,Singh A,Smith BM,et al.Persistence of bone marrow micrometastases in patients receiving adjuvant therapy for breast cancer:results at 4years[J].Int J Cancer,2005,14(1):94-100.
[13]Manhani AR,Manhani R,Soares HP,et al.CK-19expression by RT-PCR in the peripheral blood of breast cancer patients correlates with response to chemotherapy[J].Breast Cancer Res Treat,2001,66(3):249-254.
[14]Zheng ZD,Yu GZ,Wang JJ.Research on changes of PIP mRNA expression in the peripheral blood of patients with breast cancer before and after adjuvant chemotherapy[J].Chinese Clin Oncol,2009,14(3):203-206.
[15]Zhang JL,Wang L,Ling R,et al.Clinical significance of circulating tumor cells in blood of patients with breast cancer before and after neoadjuvant chemotherapy[J].Chin J Cancer Prev Treat,2008,15(1):44-46.

