不同剂量四氯化碳诱导家兔肝纤维化模型的建立*
丁 可,刘满荣,吴奇新,唐建华,曾阳东,马 宇
(1.广西壮族自治区南宁市第二人民医院放射科 530031;2.桂林医学院附属医院放射科,广西桂林541001;3.广西壮族自治区南宁市第二人民医院超声科 530031;4.桂林医学院附属医院超声科,广西桂林541001)
肝纤维化主要表现为肝脏内纤维结缔组织的异常增生和沉积,是慢性肝病的重要病理特征,也是各种慢性肝病向肝硬化发展的必经阶段。肝纤维化向肝硬化发展是一个潜隐渐进而可逆的过程[1-2],晚期肝硬化则难以逆转,因此,及时阻断肝纤维化发展成为慢性肝病防治中的关键问题[3]。肝纤维化动物模型的建立是开展肝纤维化防治研究的重要手段,也是进行人体研究的前提[4]。因饲养简单及肝脏大小适中,家兔为常用的肝纤维化动物模型;以CCl4诱导肝纤维化模型为国内应用最多的造模方法[5],但不同剂量CCl4的造模效果有所不同。本实验拟探讨CCl4诱导建立家兔纤维化模型的最佳剂量,以期为相关研究提供参考。
1 材料与方法
1.1 材料 选用6个月龄雄性健康新西兰大白兔50只,体质量2.0~2.5kg,由桂林医学院实验动物中心提供。随机分为5组,每组10只。所有家兔均饲养在层叠式不锈钢丝笼中,饲喂由桂林医学院实验动物中心提供的基础颗粒状饲料,自由饮用自来水。兔房通风良好,保持清洁,温度20~29℃,空气湿度50%~70%。
1.2 方法
1.2.1 实验试剂及肝穿刺活检枪 实验试剂:分析纯CCl4(含量≥99.5%),广东西陇化工股份有限公司生产。肝穿刺活检枪:半自动型活检针,规格型号“18GL-130mm”,制造厂商为日本TSK株式会社。
1.2.2 模型制作 分笼正常喂养适应环境1周后开始进行造模。将实验家兔分为5组:0.2、0.5、1.0、2.0、5.0mL/kg剂量组,根据体质量分别给予相应剂量的分析纯CCl4进行每周2次的皮下注射。分别于给药后的第4、8周,在B超引导下行肝右前叶穿刺活检术,注意避开肝脏大的血管和胆管,标本长约1.5~2.0cm。造模中途死亡的家兔立即取其肝组织进行病理学检查。造模后的第12周,采用耳缘静脉注射空气栓塞法处死存活的所有实验兔,取大小约1.5cm×1.0cm×0.3cm的肝脏标本送病检。

表1 各组家兔用药后1~12周死亡情况
1.2.3 病理学检查 对所有肝脏标本分别进行苏木精-伊红(HE)及Masson三色染色病理学检查。以2000年西安会议方案为标准[6],根据纤维组织增生情况,将肝纤维化分为S0~S45期,动态观察CCl4诱导建立家兔肝纤维化模型过程中的肝组织病理学变化。
1.3 统计学处理 采用SPSS 17.0统计软件进行分析。各组家兔死亡率及肝纤维化成模率的比较采用χ2检验,组间行χ2分割计算,以P<0.05为差异有统计学意义。
2 结 果
2.1 各组家兔用药后的死亡情况 各组家兔用药后1~12周死亡情况见表1。CCl4的给予剂量大于1.0mL/kg时,家兔死亡率显著增高(≥70%),与前两组比较差异有统计学意义(P<0.01);26只家兔死亡发生在3周之内,5周之后趋于稳定。实验发现25只家兔死亡发生在给药后24~48h,其余6只则发生于肝穿刺后的数天。死亡兔的肝脏病理显示:0.5 mL/kg剂量组第5周死亡兔的肝脏伴有脂肪变,1.0mL/kg剂量组8周死亡兔的肝脏可见纤维化形成,2.0mL/kg剂量组9周死亡兔的肝脏显示肝纤维化,5.0mL/kg剂量组7周死亡兔的肝脏可见大片坏死伴有纤维化,其余死亡家兔仅可见不同程度的肝细胞肿胀、坏死,均无肝纤维化形成。
2.2 各组家兔用药后肝纤维化只数及建模成功率 0.2mL/kg组第12周存活兔最多,但只有6只可见肝纤维化形成,建模成功率为60%,其中仅有2只发展为肝硬化(G4S4),另外4只中,2只为 G1S1,G1~2S2和 G3S3各1只。0.5mL/kg剂量组第12周存活兔为7只,但7只均成功建立起肝纤维化模型,故建模成功率最高,达70%,且其中的5只已经发展至肝硬化(G4S4),2只家兔中 G2~3S2和 G3S3各1只)。其余3组建模成功率都较低,且剂量越大成功率越低。后3组肝纤维化成模率显著低于前2组,差异有统计学意义(P<0.05),见表2。
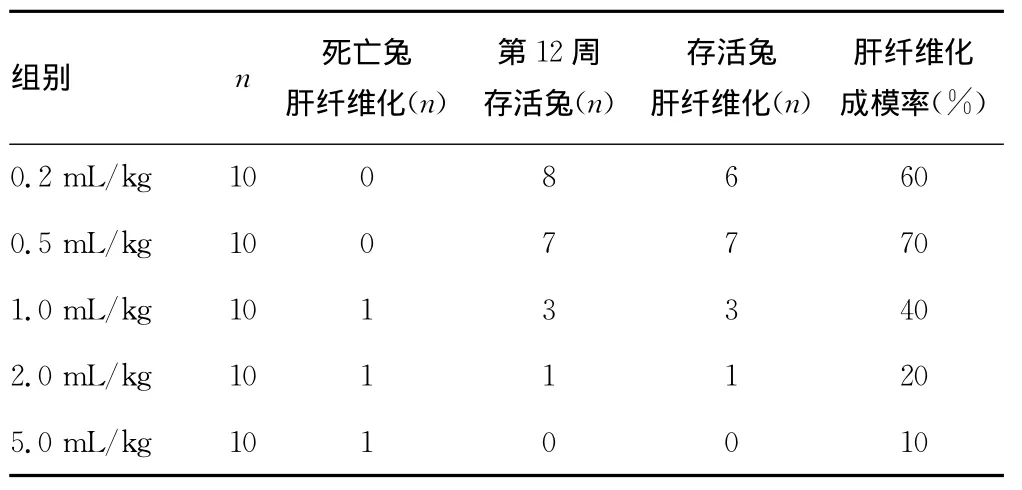
表2 各组家兔用药后肝纤维化只数及建模成功率
3 讨 论
氯化烷烃类化合物CCl4是一种选择性肝毒性药物,给予长期反复的CCl4刺激可诱导肝纤维化形成[7]。用CCl4诱导的肝纤维化模型具有成模时间短、简便、价廉、重复性好及病理特征稳定可靠等特点,在形态学和病理生理学的某些方面与人肝纤维化相似,如两者均有肝细胞坏死后的再生,实验动物表现的体征及肝功能异常与人慢性肝病进展为肝硬化时相似,因而成为国内应用最多的造模方法[5]。本研究显示,家兔肝纤维化的严重程度与炎症关系密切,肝纤维化的程度(病理分期)越重,其炎症活动度(病理分级)也就越大,说明家兔肝纤维化模型的病理学分级与病理分期呈正相关关系,这与人的慢性肝病--肝纤维化的病理学特点相似,可见CCl4诱导建立家兔肝纤维化模型的良好效果。用CCl4诱导的肝纤维化动物模型可广泛应用于肝纤维化发生机制、血清学标志物与组织病理的相关性及抗纤维化药物的筛选等研究。
CCl4诱导建立肝纤维化模型的途径有口服、腹腔注射和皮下注射等,多位学者采用皮下注射的方法成功建立起大鼠的肝纤维化/肝硬化模型[8-9]。周贤等[9]将 Wistar大鼠随机分成血清组、CCl4皮下注射组、CCl4腹腔注射组进行肝纤维化造模,研究显示CCl4皮下注射组制备肝纤维化模型的动物死亡率较低,肝纤维化形成时间较短,是一种制作肝纤维化模型较好的方法。刘满荣等[10]通过不同给药途径建立家兔肝纤维化模型的对比研究亦认为,皮下注射法CCl4造模是制作肝纤维化模型的最佳给药途径。CCl4进入体内15min即可引起肝细胞损害,至48h达到高峰,随后进入修复阶段。1~2d给药一次容易导致动物急性中毒死亡,而给药间隔超过4~5d时,肝脏可通过较强的肝细胞再生等修复机制迅速恢复肝功能,因此,有效维持CCl4肝损伤效果的最适合给药间隔时间为3 d[11]。结合文献报道,本研究采用皮下注射的方法进行造模,并确定给药频率为每周2次。
CCl4为选择性肝剧毒药物,其肝毒性作用迅速而剧烈,进入体内48h肝细胞损害达到高峰,易导致动物急性中毒而死亡,故实验中家兔死亡多发生于给药后的1~2d。经过一段时间的适应期,动物对CCl4的耐受性相对增强,所以家兔死亡多发生在造模后3周之内,5周之后趋于稳定。另有6只家兔于肝穿刺后的数天死亡,穿刺前的实验室检查均显示肝功能下降明显,病理标本可见不同程度肝细胞肿胀、坏死伴有出血,故考虑与实验兔受药后体质下降,肝功能损害导致易出血倾向或穿刺后急性创伤有关。
CCl4成模时间由给药途径和剂量决定,一般造模时间为8周至4个月[12]。Chang等[13]的研究表明,CCl4诱导小鼠肝硬化形成的时间主要取决于CCl4的剂量,增加剂量可以缩短造模时间,但同时使死亡率大大增加,因而在常用且安全有效的皮下注射造模法中,探讨建立肝纤维化模型的最佳CCl4剂量实属必要。1.0、2.0、5.0mL/kg剂量组的家兔死亡率都很高,至12周时的死亡率分别高达70%、90%和100%,显著高于0.2mL/kg剂量组的20%和0.5mL/kg剂量组的30%,可见CCl4的肝脏毒性作用随着剂量的增加而增大,安全造模的CCl4给予剂量应该小于1.0mL/kg体质量,否则极易导致家兔急性中毒而死亡。由于死亡率较高,故1.0、2.0、5.0mL/kg剂量组的肝纤维化成模率都较低,仅分别为40%、20%和10%,显著低于0.2mL/kg剂量组的60%和0.5mL/kg剂量组的70%成模率。实验结果还显示,0.5mL/kg剂量组的肝纤维化和肝硬化成模时间都要短于0.2mL/kg剂量组,由此可见,在安全有效造模的前提下,0.5mL/kg剂量的CCl4更易诱导建立肝纤维化/肝硬化模型,可视为建立家兔纤维化模型的最佳CCl4剂量。
[1]Ramachandran P,Iredale JP.Reversibility of liver fibrosis[J].Ann Hepatol,2009,8(4):283-291.
[2]Ismail MH,Pinzani M.Reversal of liver fibrosis[J].Saudi J Gastroenterol,2009,15(1):72-79.
[3]Fallowfield JA,Iredale JP.Reversal of liver fibrosis and cirrhosis-an emerging reality[J].Scott Med J,2004,49(1):3-6.
[4]刘平,高云华.肝纤维化动物模型的建立[J].世界华人消化杂志,2002,10(6):693-695.
[5]周伟,沈微.肝细胞增殖、凋亡与肝纤维化关系的实验研究[J].重庆医学,2007,36(11):1062-1064.
[6]中华医学会传染病与寄生虫病学分会,肝病学分会.病毒性肝炎防治方案[J].中华传染病杂志,2001,19(1):56-62.
[7]Wang L,Potter JJ,Rennie-Tankersley L,et al.Effects of retinoic acid on the development of liver fibrosis produced by carbon tetrachloride in mice[J].Biochim Biophys Acta,2007,1772(1):66-71.
[8]Sato R,Maesawa C,Fujisawa K,et al.Prevention of critical telomere shortening by oestradiol in human normal hepatic cultured cells and carbon tetrachloride induced rat liver fibrosis[J].Cut,2004,53(7):1001-1009.
[9]周贤,刘翼,夏国栋,等.肝纤维化动物模型探讨[J].四川动物,2010,29(1):114-115.
[10]刘满荣,丁可,唐建华,等.四氯化碳不同给药途径建立家兔肝纤维化模型的比较[J].广东医学,2013,34(4):525-527.
[11]张海燕,温韬,卢静,等.四氯化碳诱导大鼠慢性肝损伤模型方法的探讨[J].实用肝脏病杂志,2009,12(3):161-163.
[12]Simeonova PP,Gallucci RM,Hulderman T,et al.The role of tumor necrosis factor-αin liver toxicity,inflammation,and fibrosis induced by carbon tetrachloride[J].Toxicol Appl Pharmacol,2001,177(2):112-120.
[13]Chang ML,Yeh CT,Chang PY,et al.Comparison of murine cirrhosis models induced by hepatotoxin administration and common bile duct ligation[J].World J Gastroenterol,2005,11(27):4167-4172.

