益艾康胶囊对无症状期HIV感染者T淋巴细胞亚群的影响*
刘萍萍,李倩如△,轩小燕,董子明,王 哲,杜 英
(郑州大学基础医学院:1.微生物学与免疫学教研室;2.病理生理学教研室,郑州 450001;3.河南省疾病控制中心性病艾滋病研究所,郑州 450016)
获得性免疫缺陷综合征(acquired immunodeficiency syndrome,AIDS)即艾滋病是由人类免疫缺陷病毒(human immunodeficiency virus,HIV)引起的免疫缺陷型疾病,导致CD4+T细胞数量进行性减少,机体免疫功能缺失,最终引起机体各种机会性感染和肿瘤以致死亡。机体感染HIV后发展为AIDS的过程可大致分为3个阶段:急性感染期、无症状期、AIDS期。目前,对AIDS的预防尚缺乏有效的特异性疫苗,世界普遍公认的有效治疗手段是高效抗逆转录病毒疗法(highly active antiretroviral therapy,HAART),但对无症状 HIV感染者,因尚未达到HAART疗法应用标准,现无合适药物可用。若任病情逐渐进展,不利于疾病的早期控制。基于此种原因,充分发挥中医药的优势,对无症状HIV感染者进行中医药早期干预治疗,以延缓感染者发病进程,提高感染者生存质量,具有重大现实意义。益艾康胶囊由人参、黄芪等多种中药组成,具有健脾补胃,益气养血、化痰解毒之功效,能增加机体免疫功能。故本研究通过检测HIV早期无症状感染者经益艾康胶囊干预治疗后CD4+、CD8+T细胞亚群的表达,探讨益艾康药物对T细胞亚群功能的影响,试图寻找到能准确、敏感反映病情进展和药物疗效的指标。
1 资料与方法
1.1 一般资料 60例无症状HIV感染者(HIV抗体阳性、并经确认试验证实,CD4+T细胞介于200~500个/μL之间,仅表现为淋巴结肿大,未出现机会感染和肿瘤),其中,男34例,女26例,年龄35~45岁,均系河南确山县及尉氏县经有偿献血感染者。将上述60例感染者随机分为两组:益艾康干预组30例,接受益艾康胶囊干预治疗6个月;对照组30例,未接受任何抗病毒治疗。益艾康胶囊主要药物组成:人参、黄芪、炒白术、茯苓、当归、川芎、白芍、黄芩等。由河南省中医药研究院研制,规格:0.5g/粒,60粒/瓶,每次3.0g,每日3次。
1.2 主要试剂和仪器 10mL乙二胺四乙酸(EDTA)抗凝负压真空采血管、免洗溶血剂、CD4/CD8/CD3三色单抗标记试剂盒,FITC-CD4、FITC-CD8、PE-CD45RA、PE-CD45RO、PECD95、PE-CD28和PE-CD38单抗及同型对照抗体、流式细胞仪FASCAN,均为Becton Dicknson公司产品。
1.3 标本采集 用10mL EDTA抗凝真空负压采血管采集受试者静脉血5mL,4℃冷藏保存运输。
1.4 细胞绝对值计数 将20μL CD4/CD8/CD3三色单抗加入绝对计数管中,加入50μL抗凝全血,室温避光15min,加入免洗溶血素450μL室温避光15min,流式细胞仪检测,FACSMULTISET软件自动分析,得到CD4+、CD8+、CD3+淋巴细胞绝对值、百分比及CD4/CD8比值。
1.5 淋巴细胞亚群检测 取5mL抗凝静脉血加入红细胞裂解液2mL,振荡混匀后继续孵育15min,1 500r/min离心5 min收集细胞,用PBS溶液洗2次,去上清液,再重悬于PBS溶液中,取100μL细胞悬液,加入相应的荧光标记抗体各5 μL,室温避光孵育30min,离心后弃上清液,每管加0.5mL PBS液,上流式细胞仪检测,每管收集5 000个细胞进行分析。
1.6 统计学处理 采用SPSS10.0进行统计学处理,采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 益艾康胶囊治疗前、后病毒载量变化情况 益艾康干预组干预后感染者病毒载量与药物干预前相比有所下降(P<0.05),见表1。
2.2 益艾康胶囊干预对外周血CD4+T淋巴细胞亚群的影响益艾康干预前,干预组和对照组CD4计数经t检验,差异无统计学意义(P>0.05);干预6个月后干预组CD4计数与对照组比较差异有统计学意义(P<0.05),见表2。无症状HIV感染者接受益艾康胶囊干预后外周血CD4+CD45RA+、CD4+CD45RO+、CD4+CD28+、CD4+CD95+细胞比例显著高于对照组,差异有统计学意义(P<0.05),见表3。
表1 益艾康胶囊干预前、后两组患者病毒载量比较±s)

表1 益艾康胶囊干预前、后两组患者病毒载量比较±s)
*:P<0.05,与干预组干预前比较。
病毒载量(log 10copy/mL)组别干预前 干预后干预组 4.55±1.25 3.47±0.79*对照组4.37±0.87 4.78±1.14
表2 两组患者干预前、后CD4计数比较±s,个/μL)

表2 两组患者干预前、后CD4计数比较±s,个/μL)
*:P<0.05,与对照组干预后比较。
时间 干预组 对照组干预前437.64±64.12 431.25±65.67干预后 546.23±87.65*406.48±75.81
表3 两组患者外周血CD4+T淋巴细胞亚群比例比较[s),%]

表3 两组患者外周血CD4+T淋巴细胞亚群比例比较[s),%]
*:P<0.05,与对照组比较。
组别 CD4+ CD4+CD45RA+ CD4+CD45RO+ CD4+CD28+ CD4+CD95+干预组 25.81±3.21* 9.21±1.24* 12.69±2.53* 12.05±2.67* 17.41±3.08*对照组 13.43±1.85 4.17±0.87 9.80±2.14 9.04±1.78 8.56±1.74
2.3 益艾康胶囊干预对外周血CD8+T淋巴细胞亚群的影响
益艾康胶囊干预组CD8+、CD8+CD38+T细胞比例显著低于对照组(P<0.05);而两组CD8+CD95+T细胞比例比较差异无统计学意义(P>0.05),见表4。
表4 两组患者外周血CD8+T淋巴细胞亚群比例比较±s),%]
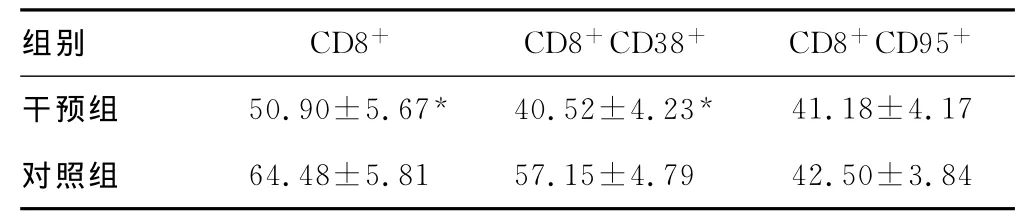
表4 两组患者外周血CD8+T淋巴细胞亚群比例比较±s),%]
*:P<0.05,与对照组比较。
组别 CD8+ CD8+CD38+ CD8+CD95+干预组 50.90±5.67* 40.52±4.23*41.18±4.17对照组64.48±5.81 57.15±4.79 42.50±3.84
3 讨 论
AIDS是由HIV感染引起的以细胞免疫缺陷为主的继发性免疫缺陷病。HIV感染属慢发病毒感染,一般有较长潜伏期。但是,一旦发病,疾病往往呈进行性加重。目前,HAART疗法主要是针对AIDS期患者,而HIV感染后的无症状期持续时间长,感染者数量最多。根据中医学“未病先防、既病防变”的学术思想,可把无症状期作为中医药治疗AIDS的切入点,对此期感染者进行免疫学和病毒学指标的监控,有利于及时了解病情并采取相应的治疗方案,控制疾病进展[1-2]。近年来,国内外对于中医药治疗艾滋病进行了多方面探索,中医药在改善临床症状、减轻病痛、延缓病情进展、维护免疫功能的稳定、减轻西医联合抗病毒治疗药物的毒副作用等方面展现出较大的优势[3],但其机制多不明了。
外周血CD4细胞的绝对值对于HIV感染状况、临床分期、预测机会性感染的可能性和治疗效果的评价具有极其重要的作用[4]。本研究结果显示,经过益艾康胶囊干预6个月后,患者CD4+T淋巴细胞绝对值上升,与干预前相比,差异有统计学意义(P<0.05),并且与对照组相比CD4+T的百分率显著提高,提示HIV感染无症状期服用益艾康胶囊可以明显稳定或减缓CD4+T淋巴细胞的下降幅度,促进免疫功能重建,同时通过抑制病毒复制或其他作用途径,降低或稳定病毒载量。
外周循环CD4+T细胞主要有两类:幼稚细胞(CD45RA+T)和记忆细胞(CD45RO+T),HIV感染后,无论是未经抗原刺激的幼稚细胞,还是接触过抗原刺激的记忆细胞都不断减少[5]。本研究结果显示,益艾康胶囊干预后,CD45RA+T细胞和CD45RO+T百分比与对照组相比均显著升高(P<0.05)。同时观察到CD4+CD28+T和CD4+CD95+T的比例均较对照组升高(P<0.05)。CD28和CD95分别是T细胞表面的共刺激分子和细胞凋亡分子,与CD25分子一样,能在一定程度上反映CD4+T细胞的活化、凋亡及其功能状态[6-7],说明活化T细胞下降幅度减缓,提示益艾康胶囊干预能提高CD4+T细胞的输出和促进其活化,有助于恢复HIV感染者的免疫功能,有利于免疫重建。
CD8+T淋巴细胞是特异性细胞免疫的效应细胞,能通过特异性识别病毒感染的靶细胞,并对其产生杀伤作用,是机体内直接杀伤 HIV病毒的主要免疫细胞[8]。CD8+CD38+T细胞是一群激活的亚群,在HIV感染时能发生扩增,是评价HIV感染者免疫激活的又一指标[9],本研究显示益艾康干预6个月后,CD8+T细胞百分比减少的同时,CD8+CD38+T细胞百分比也下降,与对照组比较差异有统计学意义(P<0.05),提示通过益艾康胶囊干预可以使HIV感染者异常的免疫激活得到抑制。
[1]彭勃,李华伟.中医药治疗获得性免疫缺陷综合征的思路和切入点[J].中医杂志,2006,47(6):412-414.
[2]郭会军,王丹妮,刘学伟.中医药治疗艾滋病应重视对无症状HIV感染期的早期干预[J].上海中医药杂志,2006,40(7):17-18.
[3]李勇,王阶,林洪生,等.中医“治未病”思想在艾滋病早期免疫重建中的作用[J].辽宁中医杂志,2010,37(11):2117-2119.
[4]Phillips AN,Lundgren JD.The CD4lymphocyte count and risk of clinical progression[J].Current Opinion in HIV &AIDS,2006,1(1):43-49.
[5]Srinivasula S,Lempicki RA,Adelsberger JW,et al.Differential effects of HIV viral load and CD4counts on proliferation of naive and memory CD4and CD8Tlymphocytes[J].Blood,2011,118:262-270.
[6]Choi BS,Park YK,Lee JS,et al.The CD28/HLA-DR expressions on CD4+T but not CD8+T cells are significant predictors for progression to AIDS[J].Clin Exp Immunol,2002,127(1):137-144.
[7]Krueger A,Fas SC,Baumann S,et al.The role of CD95in the regulation of peripheral T-cell apoptosis[J].Immunol Rev,2003,193:58-69.
[8]McDermott AB,Koup RA.CD8+T cells in preventing HIV infection and disease[J].AIDS,2012,26(10):1281-1292.
[9]Glencross DK,Janossy G,Coetzee IM,et al.CD8/CD38 activation yields important clinial information of effective antiretroviral therapy findings from the first year of the CIPRA-SA cohort[J].Cytometry,2008,74(1):131-140.

