兔富血小板血浆液制备及CaCl2诱导的比较
毕衡,杨立丁,包可,叶国裕,赵文韬,姚哓
(云南省中医医院骨伤科,昆明 650021)
富血小板血浆(PRP)是通过离心自体全血所得到的血小板浓缩物,当血小板聚集激活后,释放出多种与骨再生有关的生长因子,这些生长因子具有促进细胞增殖、分化、趋化和刺激血管化等多方面作用。利用血小板生长因子刺激周围骨再生,修复周围骨缺损是国际医学界研究的热点。PRP因其制备简单、易获取、无免疫原性及疾病传播的风险等优点在骨再生研究中受到越来越多的重视[1,2]。目前报道的PRP制备方法种类繁多,所制得的PRP中血小板浓度也有差别。本实验将采用3种简单的手工离心方式获得PRP液,通过血小板计数、白细胞计数,探讨其相关性,测定活化前后PRP中血小板衍化生长因子(PDGF)、转化生长因子β1(TGF-β1)水平,评价不同方法所得PRP的活性。
1 材料和方法
1.1 实验动物
实验在昆明医科大学动物实验室完成,15只大耳白兔(许可合格证号:scxk(111)2008-24),体质量2.1~2.6kg。
1.2 实验设备及试剂
XE-2100血液分析仪及配套设备,低速常温离心机(ThermoIEC CL40、美国),倒置显微镜(上海、TS100),酶标仪(北京普朗酶标仪DNM-9602G),移液器,枸橼酸钠,CaCl2,EDTA-K2抗凝管,PDGF、TGF-β1酶联免疫分析试剂盒(上海生物科技有限公司)。
1.3 实验方法
咪达唑仑液0.5mg/kg耳缘静脉缓注,待动物麻醉起效后固定于手术台。使用20mL无菌注射器和装有枸橼酸钠5mL试管,心脏抽取血液至18 mL,将血液分别放入4个5mL离心管,每管4mL,其余2mL做全血对照,室温静置6h。采用一次离心法,即每管4mL对称放置于离心机,用250g×10min离心,离心后吸取全部上清液移至另一EDTA-K2管,将白膜层交界面上下3mm移至另一离心管,即为PRP液。二次离心法用Landesberg法和 Aghaloo法进行制备[3]。Landesberg法:第1次以200g×10min离心,取离心后白膜层以上及其下血浆3mm,置于另一离心管,再以200g×10 min进行第2次离心,收集上清即贫血小板血浆,移至另一EDTA-K2离心管中,剩余0.4mL即PRP。Aghaloo法:第1次以215g×10min离心,第2次以863g×10min离心,余操作同上。
1.4 血小板浓度测量
PRP制备前后分别取全血及PRP各0.2mL,用全自动血细胞分析仪分别计数全血、一次离心PRP、二次离心Landesberg法和 Aghaloo法PRP中的血小板数量,反复两次取平均值,并通过手工计数复核,同时记录白细胞计数。
1.5 PDGF、TGF-β1水平测定
PRP制备后10~15min,用10%CaCl2作为诱导剂,诱导剂1∶1(v/v)与PRP混合,室温静止10 min,酶联免疫分析法(ELISA)测定激活前后正常血浆、PRP中PDGF、TGF-β1水平,将收集的各组样本按照ELISA说明书进行检测。主要观察指标:3种方法制备的PRP中血小板计数、白细胞计数;3组PRP液CaCl2诱导前后,PRP中PDGF、TGF-β1水平。
1.6 统计学方法
采用SPSS 17.0软件对所得数据进行分析。实验数据以均数±标准差(±s)表示,组间血小板计数、白细胞计数、PDGF、TGF-β1水平比较使用方差分析(ANOVA),并对有统计学意义的指标进行两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 三种方法制备PRP中血小板计数的比较
正常兔全血血小板计数为(255.33±47.07)×109/L,3种制备方法所得PRP中血小板计数比较,差异有统计学意义(P<0.001)(见表1)。
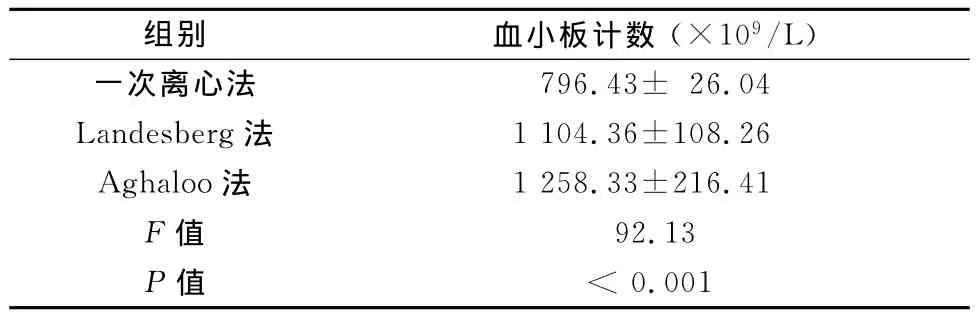
表1 PRP中血小板计数比较
2.2 三种方法制备PRP中白细胞计数的比较
正常兔全血白细胞计数为(5.62±1.03)×109/L,兔全血白细胞数受体温影响较大,3种制备方法所得PRP中白细胞计数比较,差异有统计学意义(P<0.001)(见表2)。
2.3 PRP中PDGF比较
样品稀释后,用纯化的兔PDGF 48孔抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入PDGF,再与辣根过氧化物酶(HRP)标记的PDGF抗体结合,形成抗体-抗原-酶标抗体复合物。用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中兔PDGF浓度。激活前3种离心方法组间比较,差异无统计学意义(P>0.05);CaCl2激活后,3种离心方法组间比较,差异有统计学意义(P<0.01),且Aghaloo法PDGF含量最高。Landesberg法、Aghaloo法激活前后比较,差异有统计学意义(P<0.05)(见表3)。

表2 PRP中白细胞计数比较
表3 PRP中PDGF比较(±s,μg/L)
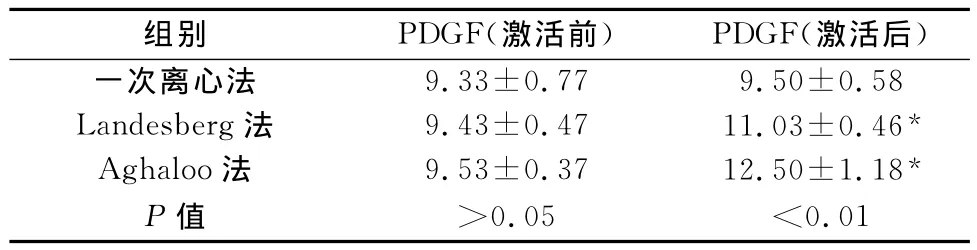
表3 PRP中PDGF比较(±s,μg/L)
与激活前比较,*P<0.05
组别 PDGF(激活前) PDGF(激活后)9.33±0.77 9.50±0.58 Landesberg法 9.43±0.47 11.03±0.46*Aghaloo法 9.53±0.37 12.50±1.18*P值 >0.05 <一次离心法0.01
2.4 PRP中TGF-β1比较
激活前3种离心方法组间比较,差异无统计学意义(P>0.05),激活后3种离心方法组间比较,差异有统计学意义(P<0.01),且 Aghaloo法 TGF-β1含量最高。Landesberg法、Aghaloo法激活前后比较,差异有统计学意义(P<0.05)(见表4)。
表4 PRP中TGF-β1的比较(±s,μg/L)

表4 PRP中TGF-β1的比较(±s,μg/L)
与激活前比较,*P<0.05
组别 TGF-β1(激活前) TGF-β1(激活后)48.02±3.31 74.20± 8.34 Landesberg法 47.89±3.50 105.04±10.46*Aghaloo法 47.93±4.08 125.16±23.97*P值 >0.05 <一次离心法0.01
3 讨论
目前PRP的提取和制备方法呈现多样化和成熟化,成熟的制备方法由于设备成本昂贵,对于小成本实验研究来说,手工制备方法仍然使用比较多,但存在血小板质量容易波动的风险。完善的操作程序有助于质量控制,从本实验来看程序应该包括:1)釆血的准确。本实验采用心脏取血,力求一针成功,可以得到足够的全血,用于制备;2)实验室稳定的温度。室温应该在20~25℃,抽血器及试管应该接近实验动物体温,这样可以防止血液中出现凝血块,影响血小板分离;3)第1次离心非常重要。离心过程如果不能形成分层(白膜层形成),则分离失败,因此,第1次离心时间不能太长,防止离心出现凝块,影响分离质量;4)取白膜层上下3mm的血液。人工制备由于条件差,程序控制非常重要。
对于富血小板的有效浓度,目前认为应该为全血血小板的3~4倍。本实验3种离心方法,其中Aghaloo法所获得的血小板数最高;一次离心法稍低于其有效浓度,但是一次离心法手工操作最稳定,重复实验率较低;而Landesberg法、Aghaloo法受手工操作的程序影响,有时需要重复实验。
PRP液主要成分包括血小板、白细胞和纤维蛋白,其中白细胞含量较大,为正常全血的4~6倍。大量的白细胞具有防止感染及免疫调节作用,同时白细胞具有很强的黏附能力,能使多种因子在其表面形成多格结构,不容易脱落[4-6]。PRP液激活可以产生大量的细胞因子,如 PDGF、TGF-β1、VEGF、EGF和IGF等[7,8],而激活剂一直倍受争议。自然的凝固是对富血小板血浆液影响最小的方法,采用CaCl2拮抗枸橼酸钠使血液自行凝固,血小板自发的被激活,释放生长因子,而在常温下激活的生长因子的衰减与体内有些相似[2,9,10]。从本组实验来看使用Aghaloo法、Landesberg法中所得的生长因子在激活后是有效的。因此,将PRP液置入机体内,产生凝血现象,自身也可以激活并释放生长因子,印证了临床使用PRP液不需要添加激活剂,仍能起到治疗作用。
PRP液的机理研究非常复杂,但其作用是肯定的,采用不干扰其生物机能的方法进行研究将是今后的一个方向。
[1]范志勇,张英泽,马维,等.富血小板血浆对大鼠乳鼠颅骨成骨细胞增殖和分化的影响[J].中国组织工程研究与临床康复,2007,11(32):6321-6325.
[2]王悦,朱喆,刘昕鸣,等.富血小板血浆提取方法的探讨[J].实用口腔医学杂志,2011,27(5):643-648.
[3]康健,袁文.富血小板凝胶制备方法的比较与优选[J].中国组织工程研究,2014,18(3):476-481.
[4]Carola C,Giuseppe F,Erminia M,etal.Comparison of Platelet-Rich Plasma Formulations for Cartilage Healing:An in Vitro Study [J].J Bone Joint Surg Am,2014,96(5):423-429.
[5]Magalon J,Bausset O,Serratrice N,etal.Characterization and comparison of 5platelet-rich plasma preparations in a singledonor model[J].Arthroscopy,2014,30(5):629-638.
[6]Kim HJ,Yeom JS,Koh YG,etal.Anti-inflammatory effect of platelet-rich plasma on nucleus pulposus cells with response of TNF-αand IL-1 [J].J Orthop Res,2014 ,32(4):551-556.
[7]Tsuzuki N,Seo JP,Yamada K,etal.The effect of a gelatinβtricalcium phosphate sponge loaded with mesenchymal stem cells(MSC),bone morphogenic protein-2,and platelet-rich plasma(PRP)on equine articular cartilage defect[J].Can Vet J,2013,54(6):573-580.
[8]张长青,袁霆.富血小板血浆制作技术和临床应用[M].上海:上海科学技术出版社,2011:17-20.
[9]罗涛,李放,张宁,等.不同抗凝剂和激活剂联合应用对富血小板血浆凝胶释放生长因子影响的比较[J].中国组织工程研究,2012,16(16):2893-2897.
[10]Hokugo A,Sawada Y,Hokugo R,etal.Controlled release of platelet growth factors enhances bone regeneration at rabbit calvaria[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2007,104(1):44-48.

