基于Hg2+诱导DNA双链形成的汞离子检测试纸条研制*
杜 娟, 娄新徽, 金庆辉, 赵建龙
(1.中国科学院 上海微系统与信息技术研究所 传感技术联合国家重点实验室,上海200050;
2.首都师范大学,北京 100048; 3.中国科学院大学,北京100049)
0 引 言
Hg是一种高毒性的全球环境污染物,由于其具有高迁移性、不可降解性、生物富集性和食物链放大性的特点,即便是极微量的存在于环境中,也会对动植物和人类的健康造成极大的威胁[1, 2]。Hg以多种形式存在于环境中,水溶性的Hg2+是汞污染最常见和最稳定的形式之一。传统的Hg2+检测方法主要有:原子吸收法、原子荧光法、高效液相色谱法以及电感耦合等。尽管能够得到比较精确的检测结果,但这些技术依赖大型仪器设备、耗费耗时、检测成本高,很难满足产地现场快速检测的要求[3]。随后又发展了一些基于有机发色团[4]、有机荧光小分子[5]以及共轭聚合物[6]的传感技术,相对于传统方法,这些方法具有简单、经济、快速的优势,但是却有水溶性差、灵敏度低、选择性局限的缺点。因此,人们迫切需要简便、快速、经济、准确的Hg2+检测分析方法。
近年来的研究表明[7, 8],Hg2+能特异性地与2个胸腺嘧啶碱基(T)共价结合形成稳定的T-Hg2+-T结构。基于Hg2+的这一特性,已发展了各种检测方法,如纳米金比色法[9~14]、荧光分析法[8, 15~21]、电化学法[22~24]等。层析试纸检测技术是20世纪80年代初发展起来的一种快速检测技术,由于其具有快捷、灵敏、成本低廉等显著优点,在快速检测技术领域中被广泛应用。本文利用Hg2+与T形成T-Hg2+-T结构的这一特性,以层析试纸为检测平台,设计了一种可用于现场快速检测溶液中Hg2+浓度的检测试纸条,检测结果裸眼观察可见,并可通过金标条阅读仪进行分析。
1 实验部分
1.1 仪器与试剂
双维平面划膜仪和全自动斩切机(上海金标生物科技公司);DGG—9053A型恒温干燥箱(韩国Sumsung公司);QimageRetiga 2000R数码相机(日本Olympus公司);DJM—4金标条阅读仪(中国科学院上海光学精密机械研究所);V—670紫外—可见分光光度计(美国Jasco公司);JEM—21O0透射电子显微镜(TEM,日本电子公司);Centrifuge5804R高速离心机(德国Eppendorf公司)。
纳米金溶液由本实验室自行制备;金标稀释液(30 %蔗糖,0.25 %吐温20,0.25 % SDS,pH=7.2);MOPS缓冲液(100 mmol/L NaNO3, 10 mmol/L MOPS,pH=7.2);DNA探针由上海生物工程技术有限公司合成(见表1);二水合双(对—磺酰苯基)苯基膦化二钾盐(bis(p-sulfonatophenyl)phenylphosphinedihydratedipotassium,BSPP)、三(2—羧乙基)膦盐酸盐(Tris(2—carboxyethyl)phosphine hydrochloride,TCEP)、3—吗啉代丙磺酸(3—(N-morpholino) propanesulfo-nic,MOPS)均购自美国Sigma-Aldrich公司;链亲和素(美国New England Biolabs公司);标准汞储存液(美国AccuStandard公司);其它试剂为分析纯。
层析试纸条材料:结合垫(SB06玻璃纤维)、样品垫、硝酸纤维素膜(180 s)、吸水垫(CH27吸水纸)和聚氯乙烯(PVC)背板、塑料外壳均购于上海快灵生物科技公司。

表1 核酸探针序列
1.2 实验方法
1.2.1 纳米金颗粒的制备
采用柠檬酸三钠还原法制备直径约为13 nm的纳米金颗粒溶胶。待用玻璃器皿和磁力搅拌子用王水(HCl∶HNO33∶1)浸泡并用去离子水冲洗干净,置于烘箱内直至干燥。将250 mL的1 mmol/L的四氯金酸(HAuCl4)溶液均匀加热至沸腾10 min。在高速搅拌下快速加入38.8 mmol/L的柠檬酸三钠溶液25 mL,继续加热搅拌15 min。停止加热后继续搅拌,自然冷却至室温。经0.22 μm滤膜过滤后,4 ℃下保存备用。
1.2.2 纳米金探针的标记
将10 mL的13 nm的纳米金原液与20 mg BSPP混合,摇床剧烈震动过夜,加入5 mol/L NaNO3直至纳米金变成蓝色,将混合溶液在25 ℃,13 000 rpm,15 min离心至纳米金颗粒完全凝聚,弃上清,加入5 mL的 mg/mL BSPP水溶液,4 ℃保存备用。将6 μL的1 mol/LTCEP溶液加入600 μL的5 μmol/L巯基修饰的检测探针溶液(PB缓冲液)中混合均匀,室温放置30 min,后加入600 μL制备好的BSPP—纳米金溶液,混匀后在4 ℃冰箱内静止16 h,逐步分次加入1 mol/L NaNO3,10 mmol/L PBS直至最终混合溶液Na+浓度达到150 mmol/L,在4 ℃冰箱内静止48 h,放入离心机在4 ℃,9 000 rpm,50 min离心,弃上清,加入150 mmol/L NaNO3和10 mmol/L PBS重复洗脱2次,最后储存于金标稀释液中。
1.2.3 捕获探针的制备
将100 μmol/L生物素修饰的捕获探针溶液(Probe1/2/3)分别与1 g/L链亲和素等体积混合,室温静止1 h后作为捕获探针备用。
1.2.4 试纸条的制作
用双维平面划膜仪将捕获探针以1 μL/cm的浓度分别固定在NC膜上,间隔为5 mm,作为检测线T1,T2和控制线C,干燥后封闭备用;用金标稀释液将纳米金探针稀释后喷涂在结合垫上,37 ℃干燥过夜。在PVC背板上依次粘贴硝酸纤维素膜(NC膜)、结合垫、样品垫和吸水垫,然后用全自动斩切机切成宽度为3.5 mm的试纸条,压入塑料外壳中,密封干燥保存。
1.2.5 灵敏度与选择性测试
在MOPS缓冲液中标准添加Hg2+原液,配置不同浓度的Hg2+溶液,将50μL Hg2+溶液加入试纸条加样孔,水平静止5 min,待纳米金探针完全由结合垫迁移至吸收垫,即可用观察条带颜色变化,然后将试纸条放入DJM—4金标条阅读仪进一步分析检测结果。
在MOPS缓冲液中标准添加常见二价重金属离子,配制Cu2+,Ni2+,Mg2+,Zn2+,Pb2+溶液用于选择性测试。
1.2.6 饮用水中的Hg2+检测
饮用水来源于实验室,在饮用水中标准添加一定量的Hg2+原液,配制不同浓度的Hg2+溶液,将检测结果与MOP缓冲液中Hg2+检测结果对照。
1.2.7 稳定性测试
将制备好的试纸条置于室温放置的干燥器中,分别在第1,2,4,8周取出测定,观察条带的颜色和试纸条的灵敏度的变化。
2 结果与讨论
2.1 实验原理
本研究旨在构建一种灵敏快速的试纸条,用于现场检测溶液中Hg2+浓度。该试纸主要由样品垫、结合垫、硝酸纤维素膜以及吸收垫四部分组成,包含2条测试线T1,T2和1条控制线C,试纸条结构如图1(a)所示。探针序列设计见表1。根据检测序列,标记在纳米金上的AuNP Probe中的一段序列(A20)与测试线T1捕获探针Probe1完全互补,Probe1为寡核酸链T20,对Hg2+具有识别作用。检测探针另一段序列与控制线C捕获探针Probe2完全互补,同时与测试线T2捕获探针Probe2构成对Hg2+具有特异性的识别探针。检测原理如图1(b)所示,当待测样品中无Hg2+存在时,纳米金探针被Probe1和Probe3捕获,T1线和C线显红色。当待测样品中存在Hg2+时,介导T—T错配形成比A-T稳定的T-Hg2+-T结构,Probe1自身形成双链结构而导致捕获的纳米金探针量减少,T1线颜色变淡至消失;Probe2在Hg2+的介导作用下捕获纳米金探针,T2线显红色并随Hg2+浓度提高颜色加深;Probe3捕获纳米金探针不受Hg2+影响,C线始终显红色,指示试纸条是否正常工作。
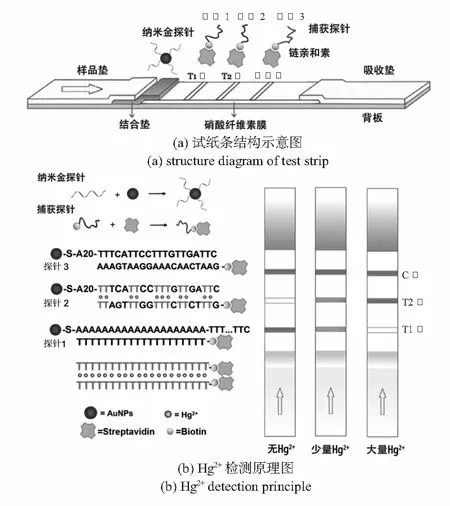
图1 试纸条结构示意图和Hg2+检测原理图
2.2 纳米金探针制备与分析
将制备好的纳米金溶液用透射电子显微镜(TEM)观察,其结果如图2所示,制备的纳米金粒子平均粒径为13±3 nm,大小均匀,形态稳定。
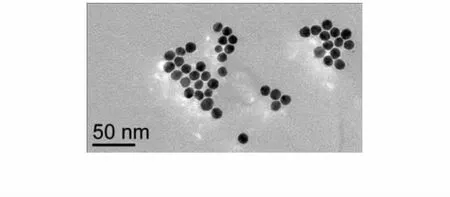
图2 纳米金溶液TEM图像
纳米金原液与纳米金探针经紫外—可见分光光度计扫描,图3(a)显示纳米金原液A在520 nm波长附近有最大吸收峰,BSPP纳米金(B)最大吸收峰在522 nm处,而标记了单链DNA后的纳米金探针C最大吸收峰在525 nm处,较原液红移了约5 nm。图3(b)所示为琼脂糖电泳图,纳米金原液A聚集在点样孔并在电泳液中盐离子浓度下发生聚集而变蓝;BSPP纳米金B稳定性增强,未发生聚集,有明显条带;标记了单链DNA的纳米金探针C由于DNA的牵制导致其电泳速率比BSPP纳米金缓慢。综上所述,单链DNA标记纳米金探针是成功的。

图3 紫外—可见吸收谱和琼脂糖电泳图
2.3 标准缓冲液中Hg2+检测结果
用试纸条分别对MOPS缓冲液中浓度为0,0.1,1,10,100 μmol/的Hg2+进行检测,结果分别如图4(a)所示,T1线颜色随Hg2+浓度升高而减弱直至消失,T2线颜色随Hg2+浓度升高增强,裸眼可见检测灵敏度约为100 nmol/L。用DJM—4金标条阅读仪分析检测结果,以测试线与控制线信号强度比值(T1/C,T2/C)作为衡量标准,绘制曲线如图4(b)所示,可见该试纸的检测结果在10 nmol/L~10 μmol/L范围内具有较好的线性关系。
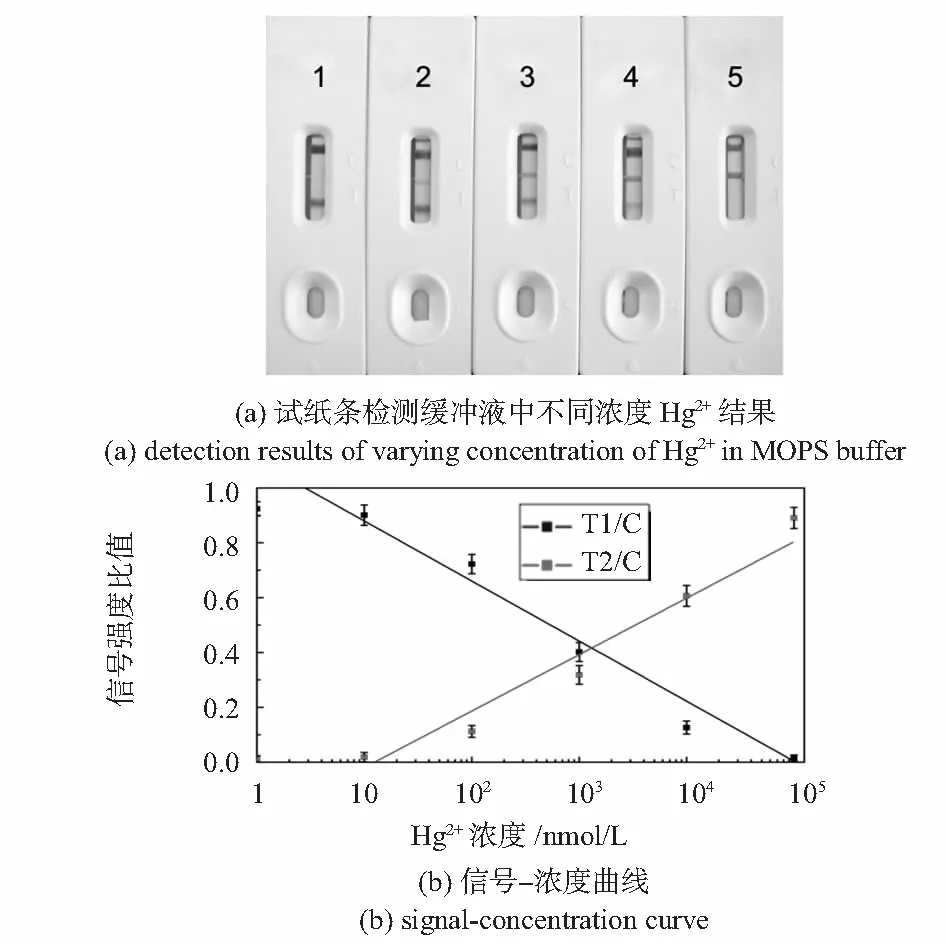
图4 试纸条检测缓冲液中不同浓度Hg2+结果和信号—浓度曲线图
2.4 对其他重金属离子的选择性
用试纸条分别对MOPS缓冲液中1 μmol/L的Cu2+,Ni2+,Mg2+,Zn2+,Pb2+以及Hg2+进行检测,检测结果照片和金标条阅读仪扫描信号分别如图5(a)和图5(b)所示,可见该试纸对常见二价重金属离子具有良好的选择性。
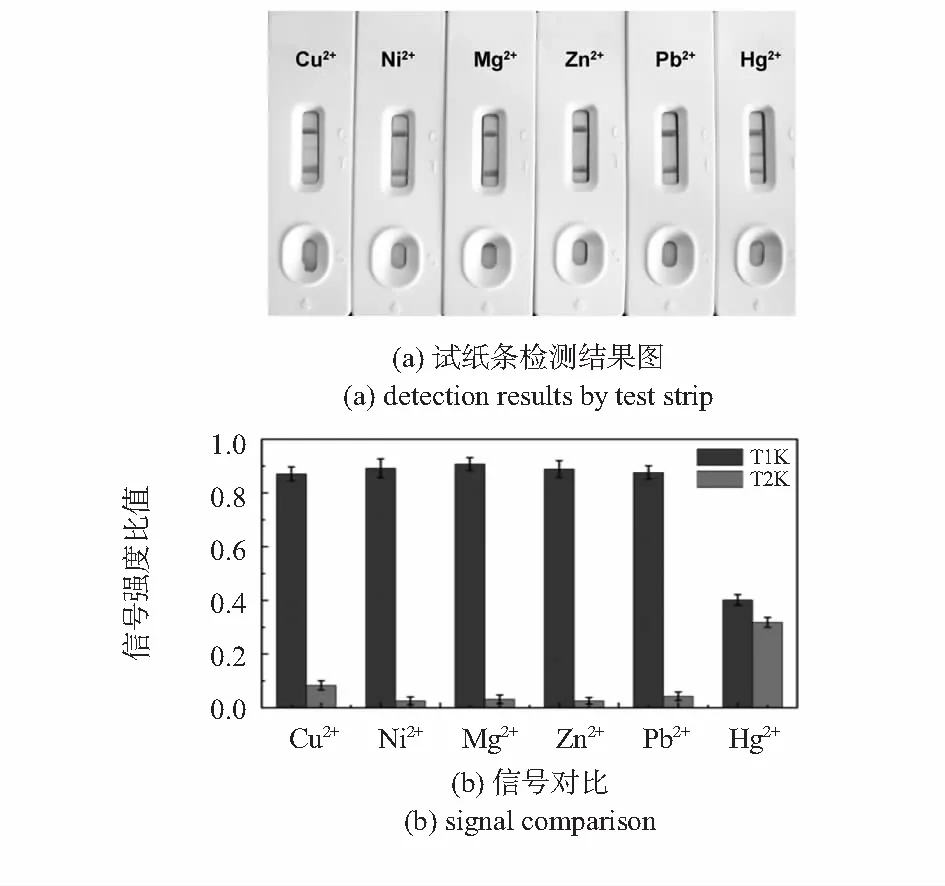
图5 试纸条检测1 μmol/L Cu2+,Ni2+,Mg2+,Zn2+,Pb2+,Hg2+结果图和信号对比
2.5 饮用水中的Hg2+检测结果
用试纸条分别对饮用水中浓度为0,0.1,1,10,100 μmol/L的Hg2+进行检测,结果分别如图6(a)所示。分别取0,1,100 μmol/L饮用水中Hg2+检测结果与MOPS缓冲液中Hg2+检测结果对比,金标条阅读仪器分析结果如图6(b)所示,检测结果基本无差别,因此,该试纸可用于饮用水中的Hg2+快速检测。
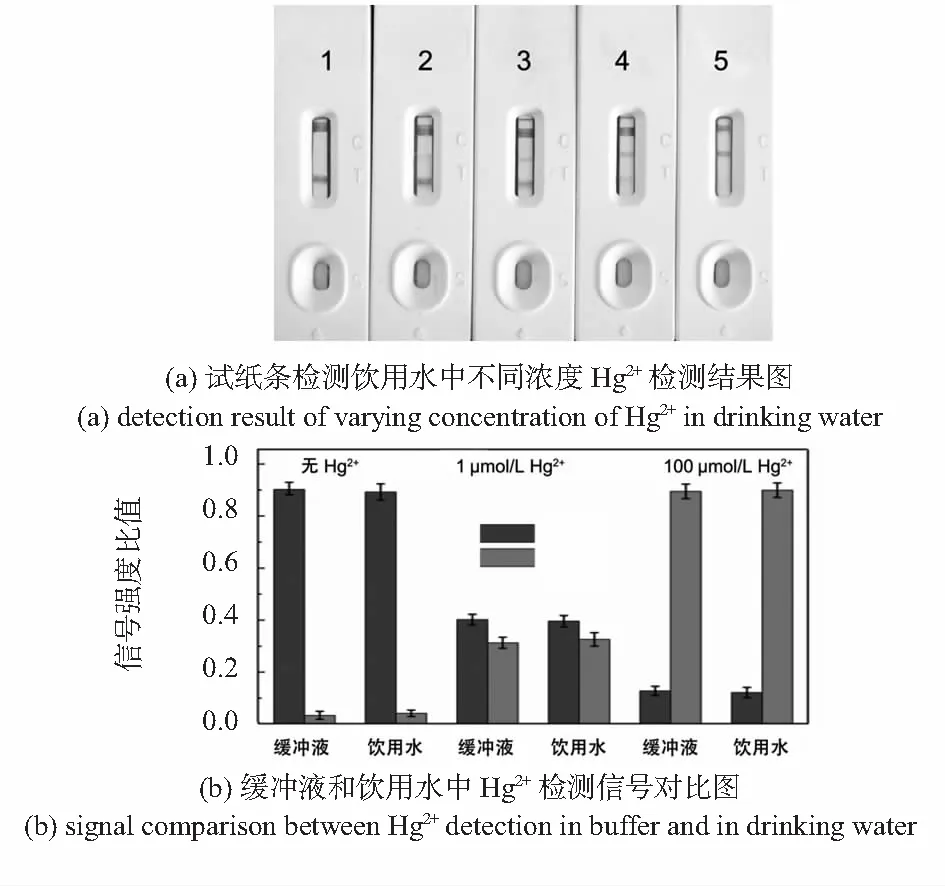
图6 试纸条检测饮用水中不同浓度Hg2+检测结果图和缓冲液与饮用水中Hg2+检测信号对比图
2.6 试纸条稳定性测试结果
分别在试纸条制备的第1,2,4,8周从干燥箱内取出试纸进行重复实验,结果表明:在室温保存8周的试纸条,条带颜色和检出限与新制备的试纸条没有明显差异,说明在室温干燥条件下,该试纸条至少可保存2个月。
3 结 论
本文成功研制出一种可用于现场快速检测的汞离子检测试纸条,检测结果在5 min内显示,裸眼可见灵敏度约为100 nmol/L,金标条阅读仪分析结果在10 nmol/L~10 μmol/L范围内具有较好的线性关系,对常见二价重金属离子具有良好的选择性。与传统汞离子检测方法相比,该方法快捷灵敏、操作简单、成本低廉、易于存放,在环境监测、食品安全等方面具有很好的应用前景。
参考文献:
[1]Magos L,Clarkson T W.Overview of the clinical toxicity of mercury[J].Annals of Clinical Biochemistry,2006,43(4):257-268.
[2]Zahir F,Rizwi S J,Haq S K,et al.Low dose mercury toxicity and human health[J].Environmental Toxicology and Pharmacology,2005,20(2):351-360.
[3]Leermakers M,Baeyens W,Quevauviller P,et al.Mercury in environmental samples: Speciation, artifacts and validation[J].TrAC Trends in Analytical Chemistry,2005,24(5):383-393.
[4]Guo X,Qian X,Jia L.A highly selective and sensitive fluorescent chemosensor for Hg2+in neutral buffer aqueous solution[J].Journal of the American Chemical Society,2004,126(8):2272-2273.
[5]Nolan E M,Lippard S J.Tools and tactics for the optical detection of mercuric ion[J].Chem Rev,2008,108(9):3443-3480.
[6]Tang Y,He F,Yu M,et al.A reversible and highly selective fluorescent sensor for mercury(II)using poly(thiophene)s that contain thymine moieties[J].Macromolecular Rapid Communications,2006,27(6):389-392.
[7]Miyake Y,Togashi H,Tashiro M,et al.Mercury II-mediated formation of thymine-Hg(II)-thymine base pairs in DNA duplexe-s[J].Journal of the American Chemical Society,2006,128(7):2172-2173.
[8]Ono A,Togashi H.Highly selective oligonucleotide-based sensor for mercury (II) in aqueous solutions[J].Angewandte Chemie International Edition,2004,43(33):4300-4302.
[9]Lee J S,Han M S,Mirkin C A.Colorimetric detection of mercuric ion (Hg2+) in aqueous media using DNA-functionalized gold nanoparticles[J].Angewandte Chemie,2007,119(22):4171-4174.
[10] Xue X,Wang F,Liu X.One-step, room temperature, colorimetric detection of mercury (Hg2+) using DNA/nanoparticle conjugates[J].Journal of the American Chemical Society,2008,130(11):3244-3245.
[11] Li D,Wieckowska A,Willner I.Optical analysis of Hg2+ions by oligonucleotide-gold-nanoparticle hybrids and DNA-based machines[J].Angewandte Chemie,2008,120(21):3991-3995.
[12] Wang H,Wang Y,Jin J,et al.Gold nanoparticle-based colorime-tric and “turn-on” fluorescent probe for mercury (II) ions in aqueous solution[J].Analytical Chemistry,2008,80(23):9021-9028.
[13] Li L,Li B,Qi Y,et al.Label-free aptamer-based colorimetric detection of mercury ions in aqueous media using unmodified gold nanoparticles as colorimetric probe[J].Analytical and Bioanaly-tical Chemistry,2009,393(8):2051-2057.
[14] Li T,Dong S,Wang E.Label-free colorimetric detection of aqueous mercury ion (Hg2+) using Hg2+-modulated G-quadruplex-based DNAzymes[J].Analytical Chemistry,2009,81(6):2144-2149.
[15] Liu X,Tang Y,Wang L,et al.Optical detection of mercury (II) in aqueous solutions by using conjugated polymers and label-free oligonucleotides[J].Advanced Materials,2007,19(11):1471-1474.
[16] Freeman R,Finder T,Willner I.Multiplexed analysis of Hg2+and Ag+ions by nucleic acid functionalized CdSe/ZnS quantum dots and their use for logic gate operations[J].Angewandte Chemie International Edition,2009,48(42):7818-7821.
[17] Liu J,Lu Y.Rational design of “turn-on” allosteric DNAzyme catalytic beacons for aqueous mercury ions with ultrahigh sensitivity and selectivity[J].Angewandte Chemie,2007,119(40):7731-7734.
[18] Lee J.Highly sensitive “turn-on” fluorescent sensor for Hg2+in aqueous solution based on structure-switching DNA[J].Chemical Communications,2008,45:6005-6007.
[19] Ye B C,Yin B C.Highly sensitive detection of mercury (II) ions by fluorescence polarization enhanced by gold nanoparticles[J].Angewandte Chemie International Edition,2008,47(44):8386-8389.
[20] Liu C W,Huang C C,Chang H T.Highly selective DNA-based sensor for lead (II) and mercury (II) ions[J].Analytical Che-mistry,2009,81(6):2383-2387.
[21] Ren X,Xu Q H.Highly sensitive and selective detection of mercury ions by using oligonucleotides, DNA intercalators, and conjugated polymers[J].Langmuir,2008,25(1):29-31.
[22] Kong R M.,Zhang X B,Zhang L L,et al.An ultrasensitive electrochemical “turn-on” label-free biosensor for Hg2+with AuNP-functionalized reporter DNA as a signal amplifier[J].Chem Commun,2009,37:5633-5635.
[23] Wu D,Zhang Q,Chu X,et al.Ultrasensitive electrochemical sensor for mercury (II) based on target-induced structure-switching DNA[J].Biosensors and Bioelectronics,2010,25(5):1025-1031.
[24] Zhu Z,Su Y,Li J,et al.Highly sensitive electrochemical sensor for mercury (II) ions by using a mercury-specific oligonucleotide probe and gold nanoparticle-based amplification[J].Analytical Chemistry,2009,81(18):7660-7666.

