饲料蛋白质的理化特性与其营养价值的关系
秦贵信 孙泽威 龙国徽 王 涛 白明昧
(1.吉林农业大学动物科技学院,长春 130118;2.吉林农业大学动物营养与饲料科学重点实验室,长春 130118;3.吉林农业大学生命科学学院,长春 130118)
对饲料原料中蛋白质的生物学品质特征的认识和其营养价值的评价关系,到环境中营养素与动物生命过程互动关系及其规律的深入揭示,关系到畜禽饲粮蛋白质源的优选、加工工艺优化和经济价值的评定,还关系到动物蛋白质营养需求数量、需求结构的有效调控及动物生产力水平的充分发挥。所以,这方面的问题既是动物营养与饲料科学与技术领域的一个关键的上游性和基础性的理论创新问题,也是现代畜牧业产业技术体系建设发展的一个具有重要经济意义的实践问题。在上百年的研究探索过程中,人们对评价方法不断进行改进,但这些改进大都没有离开用实体动物消化试验,即用表观消化率、真消化率、回肠末端消化率等这样一些反映饲料蛋白质在通过消化道过程中所发生的数量变化的指标来评价饲料。用消化试验评价饲料存在诸多缺点和问题。在实践上,消化试验成本高、时间长、误差大(尤其是用差比法测定单一饲料养分消化率);在原理上,消化指标只是把通过消化道的过程当成了一个“黑匣子”,而没有把蛋白质消化吸收情况,即饲料蛋白质在消化道内其氨基酸和小肽释放及吸收的时空情况反映出来。而这些情况与蛋白质即氨基酸的代谢、氮素的沉积存在紧密的联系。
在生产实践中,常常会发现用不同饲料原料配制的营养水平(如可消化蛋白质和氨基酸)相同的饲粮,其饲喂效果相差悬殊。蛋白质含量、氨基酸组成相同的饲料,其营养价值利用率却不同。同一种饲料的同一氨基酸,改变加工过程和贮藏过程,其利用率也会发生很大变化。这些情况说明在饲料营养价值评定的客观性和准确性方面仍有许多问题需要研究。近些年来,国内外一些研究结果表明,饲料蛋白质及氨基酸的利用效率与饲料的物理性质和化学结构,如溶解性、扩散性、高级结构(螺旋、折叠、无规则卷曲)、蛋白质分子柔性(氢键、二硫键数量和位置)、氨基酸组成、抗营养特性等理化特性存在十分密切的关系[1-3]。通过一些现代的测试手段,将饲料营养物质的物理、化学及生物学特征测定或读取出来,并将其与动物的生命过程(消化、吸收、代谢)关系做较全面的揭示,很可能会建立起更准确客观的饲料营养价值评价体系。
本文对国内外有关的饲料原料蛋白质物理、化学、生物学特性的评价方法及在饲料营养价值评定方面的应用进行了相关阐述。发现早期传统蛋白质营养理论,即仅仅以粗蛋白质含量、氨基酸的种类和数量来评价饲料蛋白质的质量,可能还不够充分。目前,关于饲料蛋白质的理化性质与其营养价值的关系研究相对较少,但已受到越来越多的关注,特就此作一简要综述。通过揭示以上几种因素与蛋白质消化及营养价值的关系,深入了解并正确认识氮素状态,才能完善氮素营养的理论体系以及建立精确科学的饲料评价体系,这不仅为饲料加工调制确立了科学精准的目标,而且为不同类别畜禽优选饲料蛋白质源和解决养殖业节氮减排、生态型养殖业技术体系提供了科学依据。
1 饲料蛋白质物理特性的评价指标、方法及其在饲料营养价值评定中的应用
1.1 蛋白质的溶解性
溶解性是指蛋白质在水溶液或盐溶液中溶解的性能。一般采用溶解度(PS)来衡量蛋白质溶解性的大小。蛋白质作为大分子有机化合物,在水中以分散态(胶体态)存在,因此,蛋白质在水中无严格意义上的溶解度,只是将蛋白质在水中的分散量或分散水平相应地称为蛋白质的溶解度。溶解度的测定方法主要有定氮法[4]和考马斯亮蓝法[5],目前广泛采用的是 Dale 等[4]提出的 0.2%KOH溶液定氮法,即将溶于0.2%KOH溶液中的蛋白质占样品总粗蛋白质含量的百分比视为溶解度。
在蛋白质的功能特性中,溶解度是最重要的一项指标,对蛋白质的乳化性、凝胶性及发泡性均有显著影响[6-7]。Kinsella[8]提出蛋白质在不同pH条件下的溶解度曲线是评价蛋白质变性程度、控制蛋白质加工工艺的第一指标,并在豆粕、菜籽粕、花生粕、棉籽粕等加工处理控制与评价中得到了广泛的应用[3,9-11]。同时,国内外学者针对菜籽、豆粕等蛋白质的分子结构、溶解度、消化率的相关关系开展了大量的研究(图1),客观、系统地揭示了蛋白质溶解度与消化率间的相关关系。

图1 不同蛋白质源饲粮胃肠道游离氨基酸总量的变化规律Fig.1 The variation pattern of total free amino acids in the gastrointestinal tract from different proteins sources[12]
1.2 蛋白质的分散性
蛋白质的分散性是指在搅拌的情况下,蛋白质在水中快速分散的能力。通常用蛋白质分散性指标(PDI)来评价。美国油脂化学家协会(AOCS)提出了经典的测定方法[13]:PDI(%)=(水中分散性蛋白质百分含量/样品中总蛋白质百分含量)×100。
传统观念认为PDI仅仅是蛋白质溶解度的一种表示方法,将蛋白质的溶解性与分散性视为相同指标,而事实上在加工处理过程中很难得到同时拥有高分散性和高溶解性的蛋白质产品,往往会出现高分散性的蛋白质制品通常溶解性不够理想,而高溶解性的通常分散性不够理想[14]。
国外通常用PDI表示油料蛋白质在加工过程中的受热程度[15]。Qin 等[16]便采用 PDI来探讨改善不同来源全脂大豆品质的适宜加工条件,目前PDI已成为常用的蛋白质性能指标之一,是确定加工工艺条件的依据。
2 饲料蛋白质化学特性的评价指标、方法及其在饲料营养价值评定中的应用
2.1 氨基酸组成
氨基酸是蛋白质的基本组成单位,赋予蛋白质特定的分子结构形态,使其分子具有生化活性。鱼粉、豆粕、花生粕、玉米蛋白粉、血粉和羽毛粉等不同饲料蛋白原料具有不同的氨基酸组成,如玉米蛋白粉中严重缺乏赖氨酸,羽毛粉富含半胱氨酸,在动物体的利用效率差异显著。
目前蛋白质氨基酸评定结果大多源于氨基酸分析仪,是采用强酸在高温条件下水解蛋白质后进行的测定,而动物的消化酶则无法将饲料蛋白质中的所有氨基酸释放出来,进而造成饲料蛋白质的氨基酸组成与动物消化道实际利用氨基酸数量与组成不一致。不同饲料蛋白质中氨基酸组成、排序及空间结构上的差异,以及加工处理过程中造成的各种不同的特定结构,是导致饲料氨基酸在动物胃肠道内释放规律不一致的主要因素(图1)。深入认识蛋白质结构与其在动物体消化道酶解模式的关系,对于提高氮营养素利用效率具有重要意义。
2.2 蛋白质分子结构及柔性
2.2.1 概念、定义
蛋白质的结构是指组成蛋白质分子的原子在空间上的排布位置,氨基酸的序列中包含着分子结构的信息,在与周围环境的相互作用中表现出结构形状的变化,是一种三维空间实体。丹麦生物化学家Kail Linderstram首先将蛋白质的结构划分为一级、二级和三级结构;英国化学家Bernal又使用四级结构来定性描述具有复杂多肽链蛋白质分子的亚基结构;后来,在二级结构与三级结构之间发现了超二级结构(结构模体)和结构域,揭示出蛋白质结构是具有丰富层次的体系。
蛋白质的柔性是在稳定构象状态下的蛋白质组成中不断动态变化的局部结构。蛋白质结构的柔性特征分析是理解蛋白质动态行为表现的重要内容,蛋白质的分子结构是与功能紧密相连的柔性结构。根据 Anfinsen[17]的热力学假定,在正常的生理环境(溶液、pH、离子强度、温度或其他成分,如金属离子、与蛋白质紧密结合的非氨基酸基团的存在等)条件下,天然蛋白质的三维结构是使整个系统的吉布斯自由能最低的结构。Anfinsen[17]在假定中特别强调了在不同环境条件下有不同构象的可能性,由于蛋白质与环境相互作用产生构象改变,生物活性总是要在不同程度上与蛋白质天然构象变化相联系。蛋白质分子与周围环境具有互动性,它永远处于运动状态,蛋白质各个氨基酸残基的热振动、肽链的热力学运动都属于构象变化。早在19世纪末,科学研究发现酶与底物之间的相互作用具有高度的几何互补性。随后,Fischer[18]提出的“锁 - 匙”模型,用“一把钥匙配一把锁”这种形象的模型来描述酶和底物之间的相互作用。尽管这种模型解释了蛋白质相互作用特异性,但对于蛋白质的柔性以及变构性质却无能为力。Koshland[19]在“锁-匙”模型的基础上加以改进,建立了“诱导契合”模型,成功的将蛋白质的柔性以及结合过程中的变构特性考虑了进来。他认为酶与底物结合的时候,并不是刚性的结合,二者会相互诱导发生结构变化,最终形成正确的复合体结构进而完全催化的过程。因此,了解蛋白质结构柔性对于蛋白质正常功能的发挥有着至关重要的意义。
2.2.2 测定指标及方法
蛋白质二级结构中,不论是α-螺旋还是β-折叠组成的片层结构中,都存在着较多的氢键致使规则的二级结构都有相当的刚性。如果一段肽段中不存在氢键或其他的相互作用,则肽段中的各个残基间有更大的自由度,表现出极大的柔性,这类肽段没有规则性。加工后的蛋白质具有部分二级结构特点,介乎前两者之间,即“刚柔兼备”(图2)。
目前,常用的蛋白质结构检测方法有X射线晶体衍射法、核磁共振光谱法、圆二色光谱法、紫外光谱法、荧光光谱法、拉曼光谱法与红外(FTIR)光谱法等。这些方法各有其优缺点。其中FTIR光谱和拉曼光谱同属分子振动光谱,是蛋白质构象研究工作中的重要工具。既适用于结晶质物质,也适用于非晶质物质;既可以测定固体样品,也可以测定液体样品;可用于鉴别化合物中的化学键类型,可对分子结构进行推测[21]。FTIR光谱对C—O、N—H和O—H等极性键伸缩振动灵敏,而拉曼光谱对C=C、C—C和S—S等非极性键灵敏,两者可以相互补充提供分子结构的线索[22]。计算机辅助解析方法的开发和应用,如去卷积、二阶导数和曲线拟合可定量分析蛋白质的二级结构[23-24]。
2.2.3 蛋白质结构在饲料营养价值评定中的应用
Yan 等[1]、Khan 等[2]、Peng 等[3]分别针对大麦、亚麻荠种子、玉米、燕麦、小麦、小扁豆、豌豆、菜籽粕、豆粕、血粉、肉粉等饲料中蛋白质的分子结构、功能特性、消化率及其相关关系进行了研究,深入揭示了蛋白质的α螺旋、β折叠及其比例关系与蛋白质溶解性、蛋白质消化率间的关系(表1),为客观分析蛋白质饲用价值和饲料蛋白质源结构优化提供了重要的基础。
龙国徽等[26]应用FTIR光谱法和拉曼光谱法对大豆球蛋白等大豆抗原蛋白的子结构进行研究,结果显示,与FTIR光谱相比拉曼光谱指纹区的数据峰较多,拉曼光谱可以解析出更多的分子结构信息。大豆球蛋白二级结构中主要成分的β-折叠的2种光谱结果一致,α-螺旋、β-转角和无规卷曲的结果差异显著。

图2 蛋白质的主要二级结构——α螺旋(A)、β折叠(B)和无规卷曲(C)Fig.2 The main of protein secondary structure—α-helix(A),β-sheet(B)and random coil(C)[20]
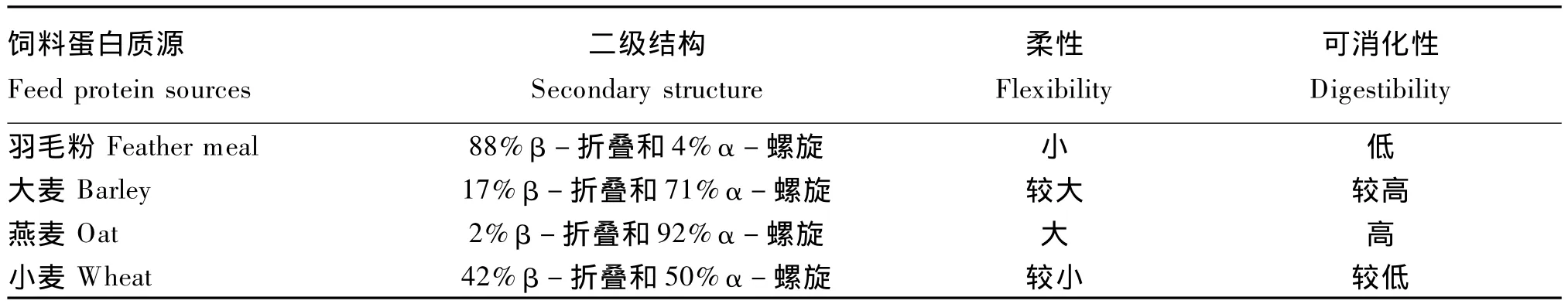
表1 不同饲料蛋白二级结构与可消化性间的关系Table 1 The relationship between secondary structure and digestibility of different feedstuff proteins[25]
Long等[27]在热变性大豆球蛋白的分子结构红外光谱研究中发现,120℃蒸汽处理比120℃烘干处理大豆球蛋白二级结构的变化更显著,并且分子聚集更强。这些变化都是影响蛋白酶消化大豆球蛋白的重要因素。
3 饲料蛋白质抗营养特性的生物学评价
3.1 饲料中的主要抗营养因子
饲料蛋白质的抗营养特性,在动物营养领域主要是指饲料或代谢产物所含有的抗营养因子和抗酶解肽物质对养分消化吸收、代谢及动物健康和生产性能产生负面影响的特性体现。
一些饲料,尤其是未经处理或热处理不够的大豆及其饼粕和其他豆科籽实,含有多种抗因营养因子(表3)。其中一些热不稳定性抗营养因子在加工过程中可有效去除,但一些热稳定性抗营养因子(如大豆球蛋白、β-伴大豆球蛋白等致敏蛋白)在常规加工处理过程中难以去除,危害动物的生理健康,限制蛋白质的安全、高效利用[28]。

表3 常见植物原料中的主要抗营养因子Table 3 The main anti-nutritional factors in the common plant material[29]
3.2 部分蛋白质类抗营养因子的分子特征研究
β-伴大豆球蛋白是大豆中难以去除且危害较大的抗营养因子之一。研究表明β-伴大豆球蛋白热稳定性强,且在动物消化道内随着蛋白质的降解其免疫活性反而存在升高现象[30]。Zhao等[31]着眼于酶解过程中β-伴大豆球蛋白分子结构与免疫活性的关系及变化规律,发现β-伴大豆球蛋白经胃蛋白酶和胰蛋白酶先后水解后,尽管β亚基被有效降解,但同时也产生了一些抗酶解肽段,这些肽段上存在着完整的免疫球蛋白E(IgE)、免疫球蛋白G(IgG)抗体结合表位,能够直接到达胃肠黏膜,刺激机体产生生物学效应,从而引 起 敏 反 应。Stanley 等[32]、王 俊 等[33]、Zheng等[34]的研究也发现了类似规律。
4 小结
对饲料中营养物质营养价值的认识过程也遵循着人类认识客观世界的一般规律,既去粗取精、去伪存真、从现象到本质的渐进过程。饲料中营养物质对动物的营养价值和营养特性与其物理特征、化学结构、化学性质存在着必然的根本性的联系。通过检测饲料的物理化学特性来寻求简便快捷的方法,进一步精确评价饲料中营养素对动物的营养价值,这是一个涉及多方面知识、内容非常复杂、体量比较庞大的科学技术问题,也是一个具有重大潜在意义的研究领域。可能是由于认识或研究条件等方面的原因,这一问题尚未得到足够广泛和深入的研究。
近年来,随着科学技术的不断发展,尤其是一些特殊高性能仪器设备的出现和对物质的物理特征、化学结构等观察测定新方法的建立,以及学科领域之间交叉与融合的创新理念的驱动,原来觉得难以解决的一些复杂问题现在正在变得越来越简单。所以,国内外已有人开始从不同的层面和不同的角度对这方面的有关问题开展了一些局部的、零星的探索性研究。从一般的科学逻辑分析和已有的研究结果看,这方面的研究具有很大的理论实用价值。积极深入地对这方面的问题开展研究,对于解决我国畜牧业发展面临的资源问题、环境问题和生产力水平提高问题均具有重要意义。
开展这方面的研究需要多方面的合作和有效的创新机制。研究的整体内容框架应该由以下几个方面构成:1)物理化学指标的搜索、收集、优选;2)仪器设备的选用、研制及测定方法、测定标准的建立;3)原料的分析化验指标与动物消化、代谢结果的关联研究;4)原料养分理化特性与动物生命过程关系及营养机制研究;5)多维理化变量与营养功能之间的复杂数量关系模型的建立;6)原料样品的批量测定及数据库的信息补充完善或新体系的建立。
[1]YAN X G,KHAN N A,ZHANG F Y,et al.Microwave irradiation induced changes in protein molecular structures of barley grains:relationship to changes in protein chemical profile,protein subfractions,and digestion in dairy cows[J].Journal of Agriculture and Food Chemistry,2014,62(28):6546-6555.
[2]KHAN N A,PENG Q,XIN H,et al.Vibrational spectroscopic investigation of heat induced changes in functional groups related to protein structural conformation in camel in a seeds and their relationship to digestion in dairy cows[J].Animal Science,2014,99:105-110.
[3]PENG Q H,KHAN N A,WANG Z S,et al.Relationship of feeds protein structural makeup in common prairie feeds with protein solubility,in situ ruminal degradation and intestinal digestibility[J].Animal Feed Science and Technology,2014,194:58-70.
[4]DALE N M.Protein solubility as an indicator of optimum processing of soybean meal[C]//Proceedings of the 1987 Georgia nutrition conference for the feed industry.Atlanta,Georgia,1987:88-95.
[5]KRATZER F H,BERSCH S,VOHRA P.Evaluation of heat-damage to protein by coomassie blue G dyebinding[J].Journal of Food Science,1990,55(3):805-807.
[6]THEODORIDOU K,YU P Q.Application potential of ATR-FT/IR molecular spectroscopy in animal nutrition:revelation of protein molecular structures of canola meal and presscake,as affected by heat-processing methods,in relationship with their protein digestive behavior and utilization for dairy cattle[J].Journal of Agriculture and Food Chemistry,2013,61(23):5449-5458.
[7]ZHANG X W,YU P Q.Using ATR-FT/IR molecular spectroscopy to detect effects of blend DDGS inclusion level on the molecular structure spectral and metabolic characteristics of the proteins in hulless barley[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2012,95:53-63.
[8]KINSELLA JE,MELACHOURISN.Functional properties of proteins in foods:a survey[J].C R C Critical Reviews in Food Science and Nutrition,1976,7(3):219-280.
[9]ZHANG X,YU P.Molecular basis of protein structure in combined feeds(hulless barley with bioethanol coproduct of wheat dried distillers grains with solubles)in relation to protein rumen degradation kinetics and intestinal availability in dairy cattle[J].Journal of Dairy Science,2012,95(6):3363-3379.
[10]HEYWOOD A A,MYERS D J,BAILEY T B,et al.Functional properties of low-fat soy flour produced by an extrusion-expelling system[J].Journal of the A-merican Oil Chemists'society,2002,79(12):1249-1253.
[11]L’HOCINE L,BOYE J I,ARCAND Y.Composition and functional properties of soy protein isolates prepared using alternative defatting and extraction procedures[J].Journal of Food Science,2006,71(3):C137-C145.
[12]夏继桥.不同蛋白源对断奶仔猪粗蛋白消化吸收的影响研究[D].硕士学位论文.长春:吉林农业大学,2014.
[13]AOCS.American oil chemist’society[C]//Protein dispersibility index(PDI).[S.l.]:AACC,1964:46-24.
[14]王一,曾茂茂,何志勇,等.不同来源蛋白酶水解对大豆分离蛋白分散性及溶解性的影响[J].食品工业科技,2012,33(17):67-69,72.
[15]ZHOU Y M.The research progress of oil cake quality evaluation method[J].The Food and Feed Industry,1995(10):30-34.
[16]QIN G X,VERSTEGEN M W A,BOSCH M W,et al.Effects of steam toasting on the digestibility and nitrogen utilization of argentine and Chinese soybeans in piglets[D].Ph.D.thesis.The Netherlands:Wageningen University,1996:83-96.
[17]ANFINSEN C B.Principles that govern the folding of protein chains[J].Science,1973,181(4096):223-230.
[18]FISCHER E.Einflussderconfiguration aufdie wirkung der enzyme[J].Berichte der deutschen chemischen Gesellschaft,1894,27(3):2985-2993.
[19]KOSHLAND D E,Jr.The key-lock theory and the induced fit theory[J].Angewandte Chemie International Edition in English,1995,33(23/24):2375-2378.
[20]邹思湘.动物生物化学[M].4版.北京:中国农业出版社,2005.
[21]ALIX A J P,PEDANOU G,BERJOT M.Fast determination of the quantitative secondary structure of proteins by using some parameters of the Raman amide I band[J].Journal of Molecular Structure,1988,174:159-164.
[22]LAKEMOND C M M,DE JONGH H H J,MARTIN HESSING,et al.Soy glycinin:influence of pH and ionic strength on solubility and molecular structure at ambient temperatures[J].Journal of Agriculture and Food Chemistry,2000,48(6):1985-1990.
[23]BYLER D M,BROUILLETTE J N,SUSI H.Quantitative studies of protein structure by FT-IR spectral deconvolution and curve fitting[J].Spectroscopy,1986,1:29-32.
[24]WANG B,WANG J,YU J,et al.A quantitative study on secondary structure of proteins by FT-Raman spectroscopy[J].Spectroscopy and Spectral Analysis,1999,19(5):674-676.
[25]YU P Q,MCKINNON J J,CHRISTENSEN C R,et al.Using synchrotron-based FTIR microspectroscopy to reveal chemical features of feather protein secondary structure:comparison with otherfeed protein sources[J].Journal of Agriculture and Food Chemistry,2004,52(24):7353-7361.
[26]龙国徽,纪媛,潘洪斌,等.大豆球蛋白的红外和Raman光谱分析[J].吉林大学学报:理学版,2014,52(4):840-846.
[27]LONG G H,JI Y,PAN H B,et al.Characterization of thermal denaturation structure and morphology of soy Glycinin by FTIR and SEM[J].International Journal of Food Properties,2014,doi:10.1080/10942912.2014.908206.
[28]QIN G X,VERSTEGEN M W A,VAN DER POEL A F B.Effect of temperature and time during steam treatment on the protein quality of full-fat soybeans from different origins[J].Journal of the Science of Food and Agriculture,1999,77(3):393-398.
[29]FRANCIS G,MAKKAR H P S,BECKER K.Antinutritional factors present in plant-derived alternate fish feed ingredients and their effects in fish[J].Aquaculture,2001,199(3/4):197-227.
[30]LALLÈS J P,TUKUR H M,SALGADO P,et al.Immunochemical studies on gastric and intestinal digestion of soybean glycinin and β-conglycinin in vivo[J].Journal of Agriculture and Food Chemistry,1999,47(7):2797-2806.
[31]ZHAO Y,QIN G X,SUN Z W,et al.Disappearance of immunoreactive glycinin and β-conglycinin in the digestive tract of piglets[J].Archives of Animal Nutrition,2008,62(4):322-330.
[32]STANLEY J S,BANNON G A.Biochemistry of food allergens[J].Clinical Reviews in Allergy and Immunology,1999,17(3):279-291.
[33]王俊,潘丽,赵元,等.大豆抗原蛋白β-伴大豆球蛋白抗酶解肽的分离纯化及其免疫活性鉴定[J].中国畜牧杂志,2012(23):53-56.
[34]ZHENG S G,QIN G X,TIAN H,et al.Role of soybean β-conglycinin subunits as potential dietary allergens in piglets[J].The Veterinary Journal,2014,199:434-438.

