杏鲍菇多肽生物活性的研究
,, ,,,
(山西农业大学食品科学与工程学院,山西太谷 030801)
杏鲍菇多肽生物活性的研究
程菲儿,赵宇宏,赵凡,张晓宝,窦世宏,冯翠萍*
(山西农业大学食品科学与工程学院,山西太谷 030801)
杏鲍菇多肽,清除自由基,脂质过氧化,乳化性,抑菌
1 材料与方法
1.1材料
1.1.1 原料 杏鲍菇多肽粗品的制备:利用碱提酸沉法[5-6]提取杏鲍菇蛋白质,其条件为温度50℃,pH 12,料液比1∶55,提取时间2.5h,提取率为46.21%,杏鲍菇蛋白质等电点为3.6。用Sephadex G-100凝胶对所提取蛋白质进行纯化[7]。洗脱流速,一般为每6min 4~5mL。按文献8的方法进行蛋白质水解度的测定[8]。利用碱性蛋白酶酶解制备多肽,最适水解条件为:pH10.5、温度45℃、时间12h、料水比1∶25、酶用量1.0%,在此条件下,杏鲍菇中蛋白质的水解度为81.19%。
1.1.2 实验菌株 大肠杆菌(ATCC25922),金黄色葡萄球菌(C56024),沙门氏菌(CMCC50071),李斯特菌(CMCC54001),志贺氏菌(CMCC51571) 均为山西农业大学食品安全实验室提供。
1.1.3 主要试剂 DPPH(1,1-diphenyl-2-picrylhydrazyl),Tris 均购自美国Sigma公司;牛肉膏、蛋白胨、盐酸、氯化钠、琼脂、无水甲醇、磷酸氢二钠、磷酸二氢钠、硫酸亚铁、氯仿、邻苯三酚、硫代巴比妥酸、无水乙醚 以上试剂均为国产分析纯。
1.1.4 主要仪器 漩涡混合器 上海精科实业有限公司;2100型可见光分光光度计 上海尤尼柯仪器有限公司;台式离心机 德国EPPendorf公司;分析天平 北京赛多利斯仪器系统有限公司;高速电动离心机 常州华普达教学仪器有限公司;全温振荡培养箱 哈尔滨东联电子技术开发有限公司;科伟电热恒温水浴锅 北京化玻联医疗器械有限公司;PHS-SC型精密酸度计 上海虹仪仪器仪表有限公司;磁力加热搅拌器 杭州仪表电机厂;医用型洁净工作台 北京东联哈尔仪器制造有限公司。
1.2实验方法
1.2.1 多肽对DPPH·清除作用的测定 不同浓度的多肽液(2%、1%、0.5%、0.25%、0.13%、0.06%)各取1mL,分别加入2mL 125μmol/L的DPPH·无水甲醇溶液,添加无水甲醇至4mL,充分混合后,在黑暗中放置30min,重复3组,在517nm下测定吸光度,得出各浓度多肽对DPPH·的清除率。
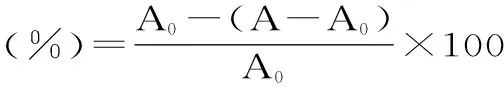
(A0:空白吸光度值;A:517nm下加入样品的DPPH·的吸光度值;Ab:517nm下加入样品不加DPPH·的吸光度值)
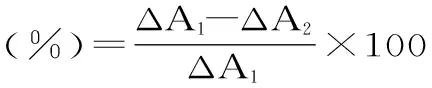
(ΔA1:邻苯三酚自氧化时的反应速率;ΔA2:加入样品液后邻苯三酚自氧化的反应速率)
1.2.3 多肽对体外脂质过氧化抑制作用的测定

(Asample:样品反应液吸光值;Ablank:以蒸馏水代替样品的反应液吸光值;Acontrol:未添加硫代巴比妥酸的样品反应液吸光值)
1.2.4 多肽抑菌能力的测定 本实验采用比浊法[9],灵敏度较高,不受杏鲍菇活性物质溶解性和扩散能力的影响。取无菌试管,向其中加入9mL杏鲍菇多肽水溶液和乙醇提取液及1mL菌悬液,振荡使混合均匀充分,设3组平行实验,在600nm处定时测定其吸光度,以乙醇、无菌蒸馏水作对照,找出最大抑菌时间,同时以蒸馏水作空白对照。

(A0:菌悬液的吸光值;A:多肽加菌悬液的吸光值;Ab:多肽的吸光值)
1.2.5 多肽乳化性的测定 取不同浓度的多肽溶液各0.5mL,加入大豆色拉油各0.5mL,高速搅拌1min(10000r/min),之后分别在0、10min取样,以0.1%(w/v)SDS(十二烷基硫酸钠,pH7.0)稀释100倍,以SDS溶液为空白,做3组平行实验,500nm处测定吸光度值,以0min的吸光度值(A0)表示乳化活性(EA),乳化稳定性用ESI表示:
(A0:0时刻的吸光值;ΔT:时间差(min);ΔA:ΔT内的吸光值差)
2 结果与分析
2.1多肽对DPPH·自由基清除率的测定
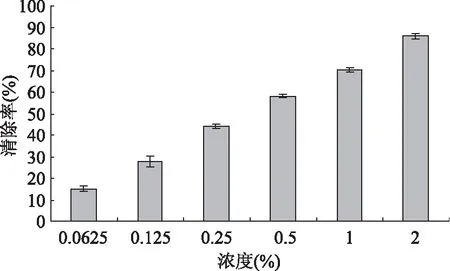
图1 不同浓度多肽对DPPH·自由基的清除作用Fig.1 DPPH· radical-scavenging activities of polypeptides
由图1可知,在实验浓度范围内,多肽对DPPH·自由基的清除率随浓度增加而增强,当浓度为2%时,清除率达85.95%,表明杏鲍菇多肽在一定浓度下具有较显著的清除DPPH·自由基的能力。

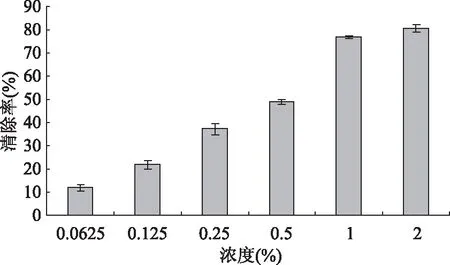
图2 不同浓度多肽对超氧阴离子自由基·)的清除作用Fig.2 Scavenging effects of polypeptides on superoxide anion radical
2.3多肽对体外脂质过氧化的抑制作用
由图3可知,在实验浓度范围内,杏鲍菇多肽对脂质过氧化的抑制作用随着多肽浓度的增加而增大,当多肽浓度为2%,抑制率达45.57%,说明对体外脂质过氧化有一定的抑制作用。
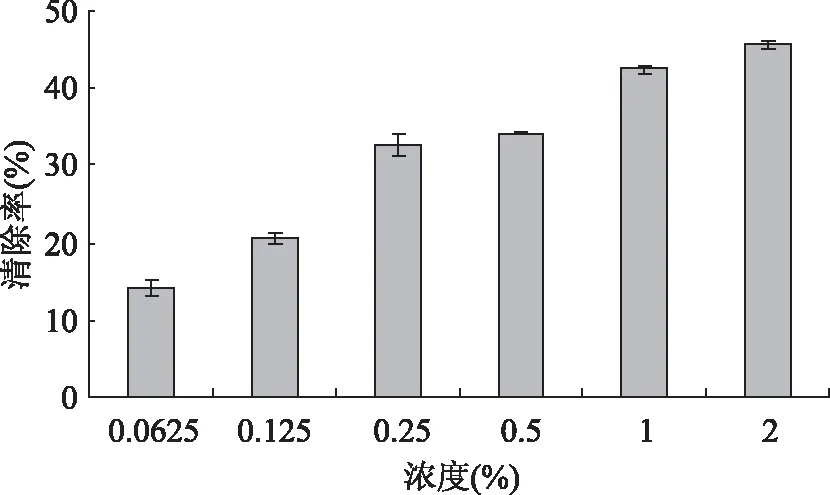
图3 不同浓度多肽对体外脂质过氧化的抑制作用Fig.3 Inhibition of polypeptides on lipid peroxidation at different concentration
2.4杏鲍菇多肽的抑菌作用
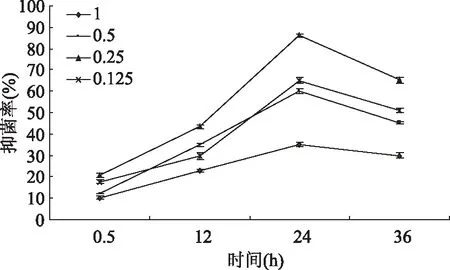
图4 不同浓度多肽对大肠杆菌的抑制作用Fig.4 Inhibition of polypeptides on E.coil at different concentration
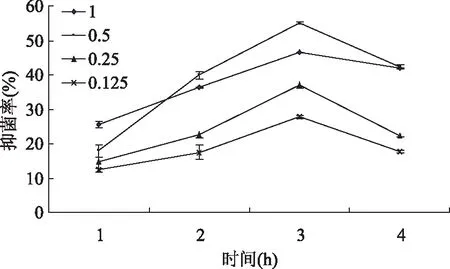
图5 不同浓度多肽对沙门氏菌的抑制作用Fig.5 Inhibition of polypeptides on Salmonella at different concentration
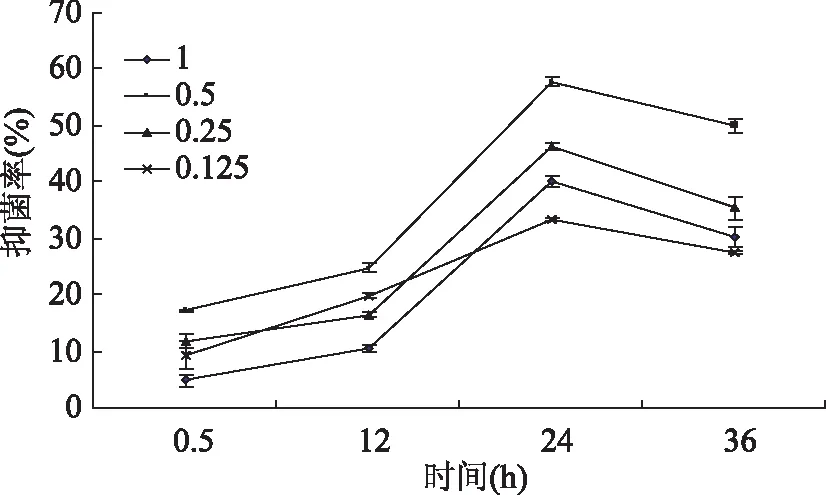
图6 不同浓度多肽对金黄色葡萄球菌的抑制作用Fig.6 Inhibition of polypeptidies on Staphylococcus aureus at different concentration
不同浓度杏鲍菇多肽对菌抑制作用如图4~8所示,经过0.5、12、24、36h后,其吸收光值均呈先上升后下降的趋势,除李斯特菌在12h达到最佳抑菌效果,其余均在24h达到最佳抑菌效果。在相同时间内,多肽的浓度增加,抑菌率也随之增大[10]。可以看出,杏鲍菇多肽有一定的抑菌作用,推测其抗菌作用主要体现在延长菌体生长延滞期,抑制细菌孢子的萌发,减少微生物在相同时间内繁殖代数,从而抑制菌体的生长[9]。但该浓度值下的多肽并不能将菌完全抑制,随着作用时间的延长,细菌繁殖生长的速度大于多肽抑制速度,从而导致其抑菌率呈现先升高后下降的趋势。

图7 不同浓度多肽对志贺氏菌的抑制作用Fig.7 Inhibition of polypeptides on Shigella at different concentration
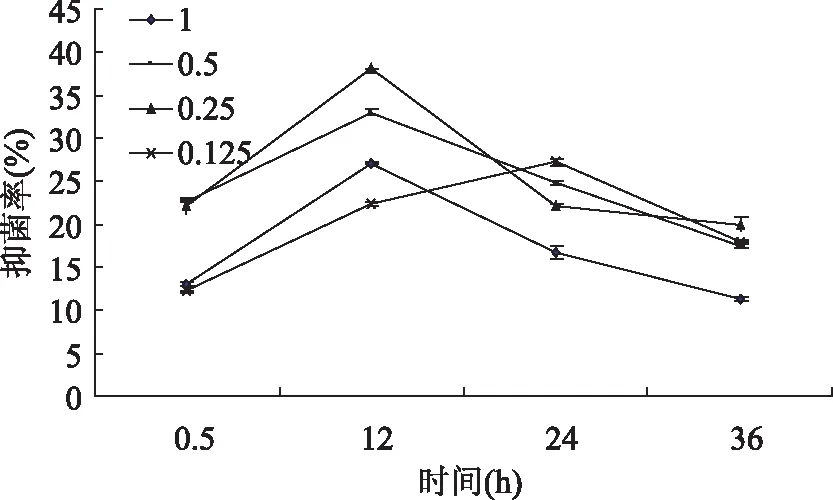
图8 不同浓度多肽对李斯特菌的抑制作用Fig.8 Inhibition of polypeptides on Listeria monocytogenes at different concentration
2.5乳化活性(EA)和乳化稳定指数(ESI)的测定
由表1可知,杏鲍菇多肽具有一定的乳化活性和较强的稳定性,浓度越高,乳化性越大,而在实验浓度中,2%的多肽稳定性最好。
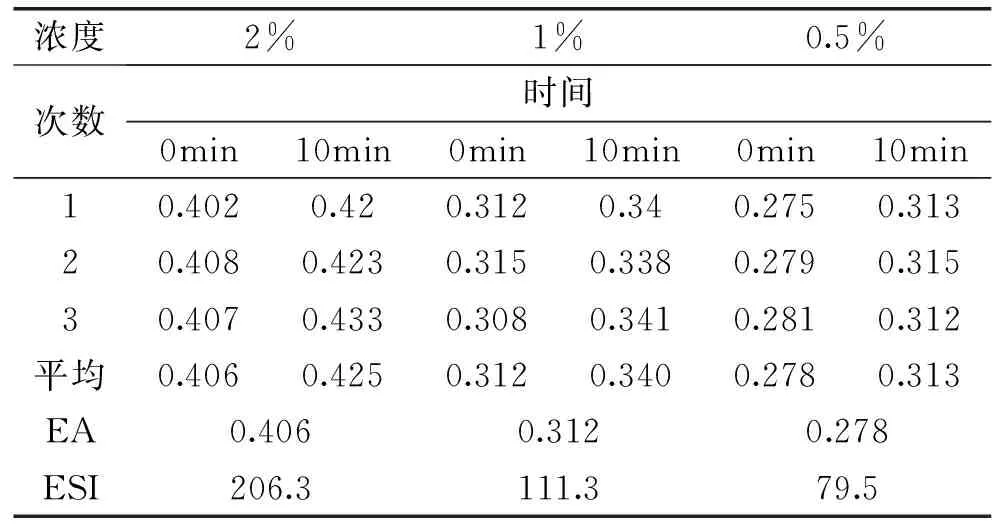
表1 杏鲍菇多肽乳化性和稳定性指数Table 1 The results of EA and ESA of Pleurotus eryngii polypeptide
3 讨论
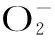
4 结论
[1]王凤芳,杏鲍菇中营养成分的测定[J],食品科学,2002,23(4):132-135.
[2]李志洲.杏鲍菇多糖的提取[J].食品与发酵工业,2012,38(3):154-158.
[3]凡军民,谢春芹,贾君.纤维素酶法提取杏鲍菇多糖工艺优化[J].食品科技,2013,38(3):192-196.
[4]张化鹏,张静,南征.杏鲍菇多糖WPP2的结构表征及抗肿瘤活性[J].高等学校化学学报,2013,34(10):2327-2333.
[5]陆晨,张士康,朱科学,等.碱提酸沉法提取茶叶蛋白质的研究[J].现代食品科技,2011,27(6):673-677.
[6]高兴,李桂娟.碱提酸沉法提取燕麦蛋白的工艺研究[J].中国西部科技,2011,31:29-31.
[7]蒋立科,罗曼.生物化学实验设计与实践[M].高等教育出版社,2007,130-131.
[8]王金胜.基础生物化学[M].北京:中国林业出版社,2006:123.
[9]冯翠萍,王亚琴.芦笋皮抑菌作用的研究[J].食品科学,2007,28(12):105-109.
[10]王储炎,艾启俊,范涛.鹿蹄草提取物抑菌活性的研究[J].现代食品科技,2011,27(1):26-28.
[11]侯伟峰,谢晶,蓝蔚青等.植酸对大肠杆菌抑菌机理的研究[J].江苏农业学报,2012,28(2):443-447.
[12]张培宜,张帅,冯翠萍.板栗多肽对DPPH·自由基清除作用和乳化性的研究[J].山西农业大学学报(自然科学版)2010,30(6):553-555.
[13]赵玲,殷邦忠,刘淇.4种海参多肽抗氧化活性的比较研究[J].中国海洋药物.2012,2,19-24.
[14]王海凤,王常青,吕鹏,等.葵花籽分离蛋白不同酶解产物清除自由基活性的研究[J].中国粮油学报.2011,26(3):56-59.
[15]刘一江,黄乾明,杨洲平,等.仙人掌抗菌肽的筛选、分离纯化及性质研究[J].四川农业大学学报.2007,25(3):271-276.
[16]Yumike O,Shigeki M,Rob W M,etal.Nagahamide A,an antibacterial depsipeptide from themarine sponge Theonella swinhoei[J].Org Lett,2002,4(18):3039-3042.
[17]卢学敏,王欣林,蓝晓燕.牡蛎活性多肽的抑菌作用与抗氧化性能研究[J].中国酿造.2013,23(2):77-80.
[18]郭兴凤,阮诗丰.影响大豆分离蛋白乳化稳定性测定的几种因素研究[J].食品研究与开发,2006.27(6):59-61.
Study on the biological activity ofPleurotuseryngiipolypeptide
CHENGFei-er,ZHAOYu-hong,ZHAOFan,ZHANGXiao-bao,DOUShi-hong,FENGCui-ping*
(College of Food Science and Engineering,Shanxi Agricultural University,Taigu Shanxi 030801,China)
Pleurotuseryngiipolypeptide;scavenging free radical;lipid peroxidation;emulsibility;bacteriostat
2013-12-16 *通讯联系人
程菲儿(1990-),女,研究生在读,研究方向:食品科学。
山西省科技攻关项目(20130311017-3)。
TS201.4
A
1002-0306(2014)17-0000-00
10.13386/j.issn1002-0306.2014.17.001

