淹水胁迫对乌桕幼苗叶片质膜透性和渗透调节物质的影响1)
蔡金峰 曹福亮 张往祥
(南京林业大学,南京,210037)
乌桕(Sapium sebiferum)属大戟科(Euphorbiaceae)乌桕属(Sapium)落叶乔木[1],广泛分布于秦岭、淮河流域以南各省区,是我国重要的速生经济树种,种子外被白色蜡质可榨取“皮油”(桕脂),种仁可榨取桕油;其木材坚韧致密,用途广泛;花期长,为重要蜜源植物;根、皮及叶均可入药,清热解毒、消肿、通便[2],乌桕树冠优美,季相变化丰富,集观形、观色叶、观果于一体,具有极高的观赏价值,广泛用于园林绿化[3]。
乌桕喜湿润气候环境,能够忍受较长时期的浸泡[4]。Robert等[5]研究了淹水对乌桕苗木生长的影响,认为乌桕耐水的原因是其在淹水胁迫下具有3大形态特征:肥厚的皮孔、不定根的形成和厚的吸收根的产生;Conner等[6]发现乌桕在盐淹胁迫下可以存活6周,在较低盐浓度的胁迫下,第2年可恢复生长;杨东等[7]对海岸防护林树种的筛选研究中发现,乌桕在胸径、树高生长及生长势均表现出较强的适应性,可以作为沿海滩涂或湿地的造林树种。本研究以2个耐涝性不同的乌桕种源为试材,测定淹水胁迫下乌桕幼苗叶片质膜透性和渗透调节物质的变化情况,分析淹水胁迫对乌桕生理生化变化的影响,对于进一步阐明乌桕的耐涝机理具有一定的理论意义。
1 材料与方法
试验材料为来自浙江兰溪和福建漳浦的1年生乌桕实生苗。通过预试验观察淹水胁迫对乌桕生长的影响,发现浙江种源较福建种源耐涝性强。
本研究选择生长相对一致的苗木于2月份进行盆栽(盆口径30 cm,高30 cm),每盆2棵,定植后平茬,正常管理。于6月下旬开始淹水处理,8月底结束,共50 d。试验设3个处理水平:对照(CK),正常管理,维持盆内土壤含水量为最大田间持水量的75%左右;渍水(W水平),土壤含水量完全饱和,模拟水渍危害;淹水(F水平),水面高于土面4 cm左右,模拟淹水胁迫。W、F水平两处理均将盆放在特制水槽里,水槽根据设计注水。每处理20盆,采用完全随机试验设计。在淹水处理第10、20、30、40、50天(其中福建种源在W、F处理下,分别于45和24 d时全部死亡)取成熟叶片,用蒸馏水清洗干净并吸干水分,剪碎混匀,取部分叶片进行质膜透性的测定,其余叶片放于超低温冰箱保存,用于其他生理指标的测定。
2 结果与分析
2.1 淹水胁迫对乌桕叶片质膜透性的影响
由图1可知,随淹水时间的持续,浙江种源叶片相对电导率整体上呈现先上升后下降的趋势,但对照处理显著低于W、F处理(p<0.05),且变化较为平稳。W、F处理间相对电导率差异不显著,随处理时间的持续显著上升,在淹水处理前20 d,F处理下相对电导率低于W处理,但20 d后急剧上升,在淹水40 d时达最大值,分别比对照和W理高出16.19%和4.14%,并在淹水末期大幅下降。
福建种源在对照处理下叶片相对电导率呈先缓慢升高再下降的趋势。处理10 d时,W、F处理10 d时,相对电导率分别为34.71%和33.06%,显著高于对照(18.9%);在处理20 d时,W处理下叶片相对电导率达最高值,然后急剧下降,淹水40 d时低于对照;F处理下相对电导率呈急剧下降趋势。
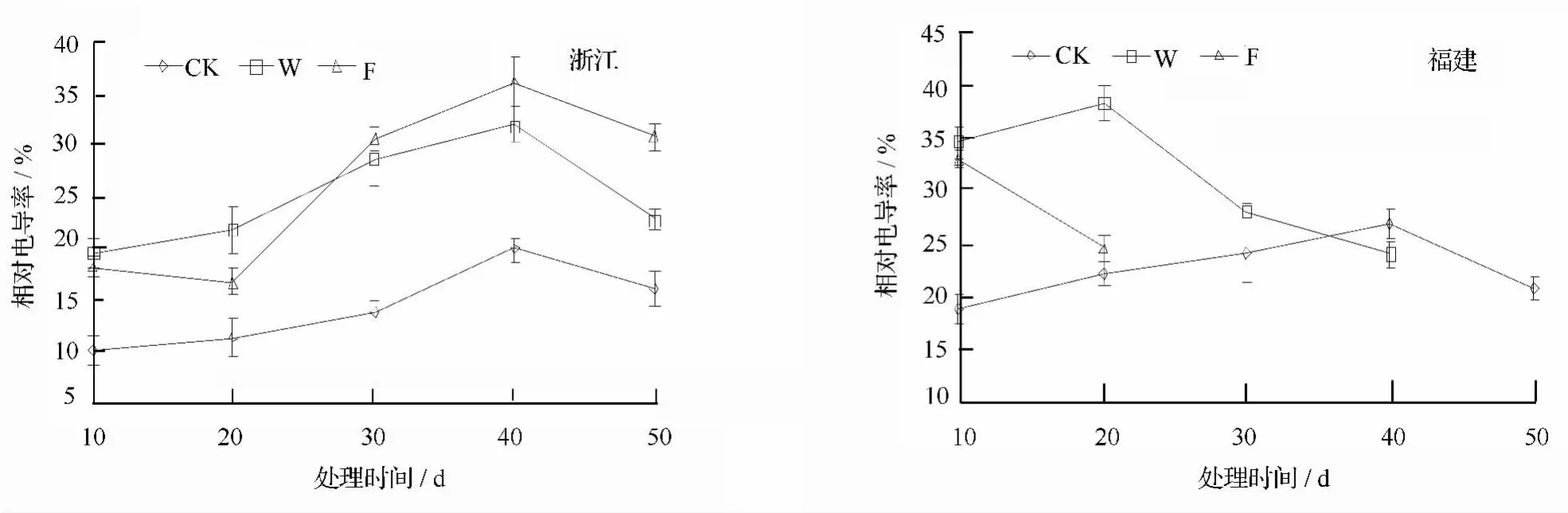
图1 淹水胁迫不同种源乌桕相对电导率的影响
2.2 淹水胁迫对乌桕叶片丙二醛质量摩尔浓度的影响
不同处理下乌桕叶片丙二醛(MDA)质量摩尔浓度变化情况如图2所示,随处理时间的持续和淹水程度的加重,MDA质量摩尔浓度整体上呈上升趋势,福建种源在各处理下MDA质量摩尔浓度绝对值高于浙江种源。
浙江种源在W、F处理下,MDA质量摩尔浓度在淹水前20 d呈上升趋势,且一直高于对照,然后急剧下降,处理30 d时低于对照,然后缓慢升高,试验结束时分别比对照高9.69%和14.58%。对照处理下福建种源MDA含量变化平稳;W、F处理下均呈逐渐升高的趋势,且显著高于对照(p<0.05)。
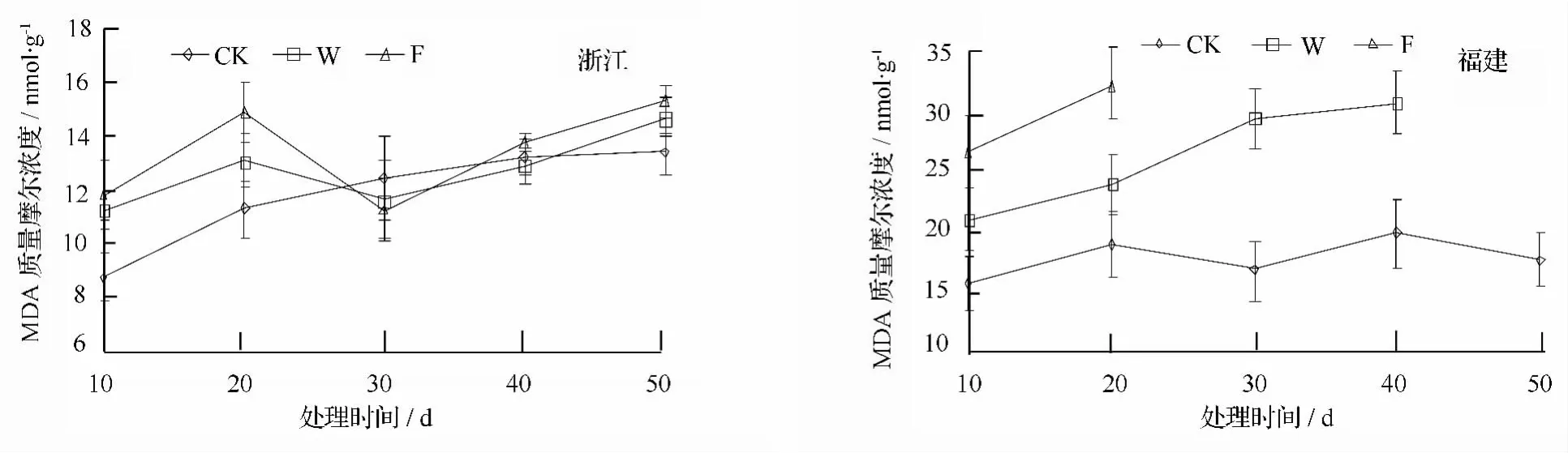
图2 淹水胁迫不同种源乌桕MDA质量摩尔浓度的影响
2.3 淹水胁迫对乌桕叶片可溶性蛋白质质量分数的影响
图3可知,在淹水10 d时,浙江种源在3种处理下叶片可溶性蛋白质质量分数无差异,随淹水时间的持续,蛋白质质量分数逐渐上升,W、F两处理差异不显著,但均显著高于对照,30 d时达到峰值,W、F两处理分别比对照高13.07%和21.9%;30~40 d时,对照和W处理缓慢下降,而F处理呈急剧下降趋势,下降幅度达29.85%,蛋白质质量分数分别比对照和W处理低10.26%和18.15%;40~50 d时,F处理趋于平稳,对照和W处理继续下降,50 d时分别比F处理低14.04%和21.05%。
3种处理下,福建种源叶片蛋白质质量分数差异显著,对照处理变化较为平稳,W和F处理均呈明显下降趋势;处理10、20 d时,F处理分别比对照低39.5%和63.56%,处理40 d时,W处理比对照低66.67%。
2.4 淹水胁迫对乌桕叶片脯氨酸质量分数的影响
江种源叶片脯氨酸质量分数显著低于耐涝性差的福建种源,而两种源在对照处理下差异不显著。
由图4可知,在W和F处理下,耐涝性强的浙
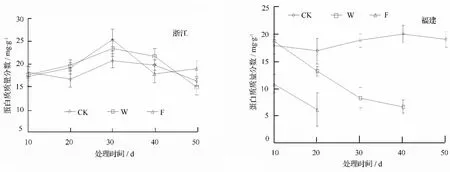
图3 淹水胁迫不同种源乌桕可溶性蛋白质质量分数的影响
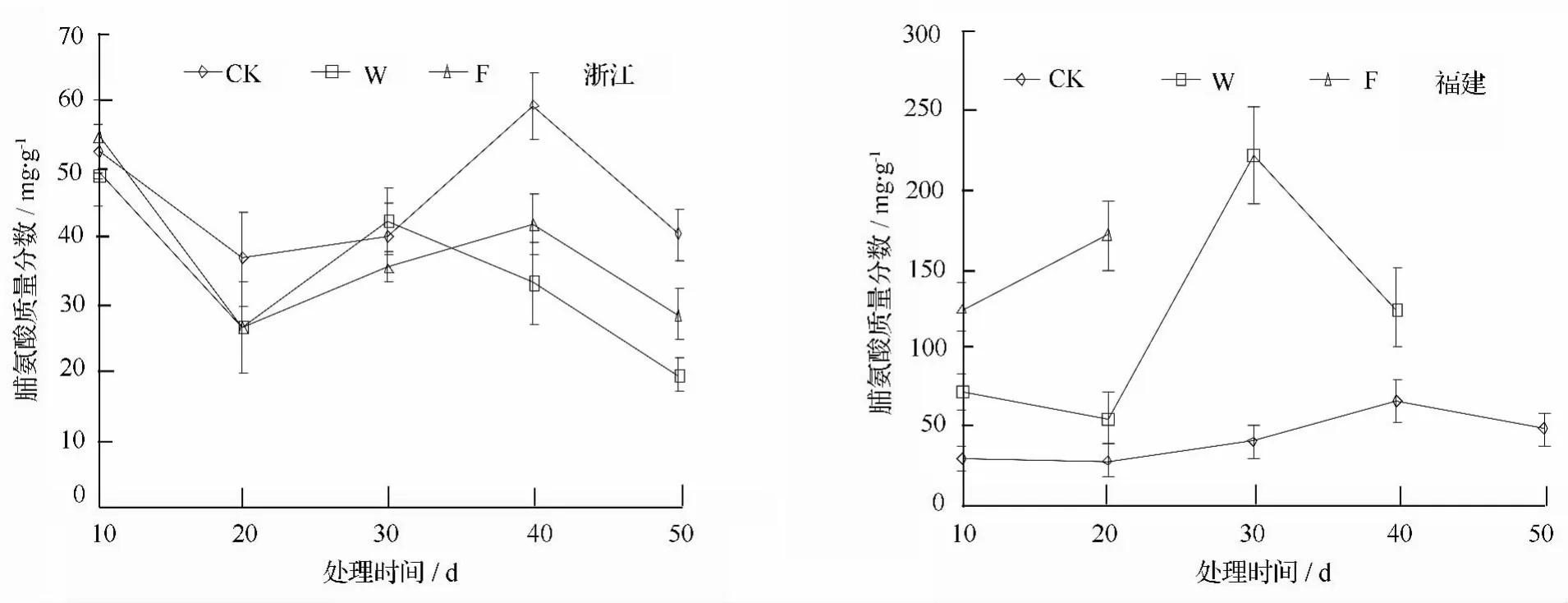
图4 淹水胁迫不同种源乌桕脯氨酸质量分数的影响
浙江种源叶片脯氨酸含量在3种处理下均呈下降—升高—下降的趋势,但整体上对照呈升高趋势,W和F处理呈下降趋势。处理前30 d,3种处理间变化基本一致,差异不显著;W和F处理分别在30d和40d时达到峰值,然后持续下降,至处理结束时分别比对照低 50.97%和 29.45%。
福建种源在W和F处理下脯氨酸质量分数均显著高于对照,处理10 d时,分别比对照高136.73%和307.85%,随处理时间的延长,W处理下脯氨酸质量分数先缓慢下降,然后急剧升高,处理30 d时较20 d时增幅达到296.03%,为对照的5.42倍,处理30 d后又急剧下降,但仍高于对照86.26%。
2.5 淹水胁迫对乌桕叶片可溶性糖质量分数的影响
不同淹水处理对耐涝性不同的乌桕叶片可溶性糖质量分数变化情况如图5所示,与对照相比,在整个处理期间,浙江种源乌桕在W和F处理下叶片可溶性糖质量分数均高于对照,但变化比较平稳,变化趋势基本一致,无明显规律,两处理可溶性糖质量分数的均值分别为对照的1.39倍和1.43倍。
处理10 d时,福建种源在W和F处理下叶片可溶性糖质量分数分别比对照高98.69%和51.38%。随处理时间的持续,W处理下可溶性糖质量分数呈下降趋势,处理30 d时,甚至低于对照,为对照的72.11%,但最后一次测量值与F处理20 d时测定值相似,均显著升高,显著升高,推测可能是由于植株遭到严重破坏,叶片严重失水,导致单位质量叶片内可溶性糖质量分数升高。
3 结论与讨论
3.1 淹水胁迫对不同涝性乌桕叶片质膜透性的影响
植物膜的功能和结构在逆境胁迫时受损,使其透性增大,这是膜受伤害和变性的重要标志[10]。本试验研究结果显示,淹水胁迫对不同耐涝性的乌桕叶片膜系统均造成了伤害,但伤害程度有所不同。耐涝性强的浙江种源在W和F处理下叶片质膜透性均高于对照,且与胁迫时间和胁迫程度呈正相关;而耐涝性差的福建种源在淹水初期显著高于对照,然后逐渐下降,甚至低于对照,说明在处理初期,淹水胁迫就对叶片膜系统造成了较大伤害,导致内含物在10 d内大量外渗,随淹水时间的延长,外渗物质逐渐减少,所以表现在数值上逐渐降低。
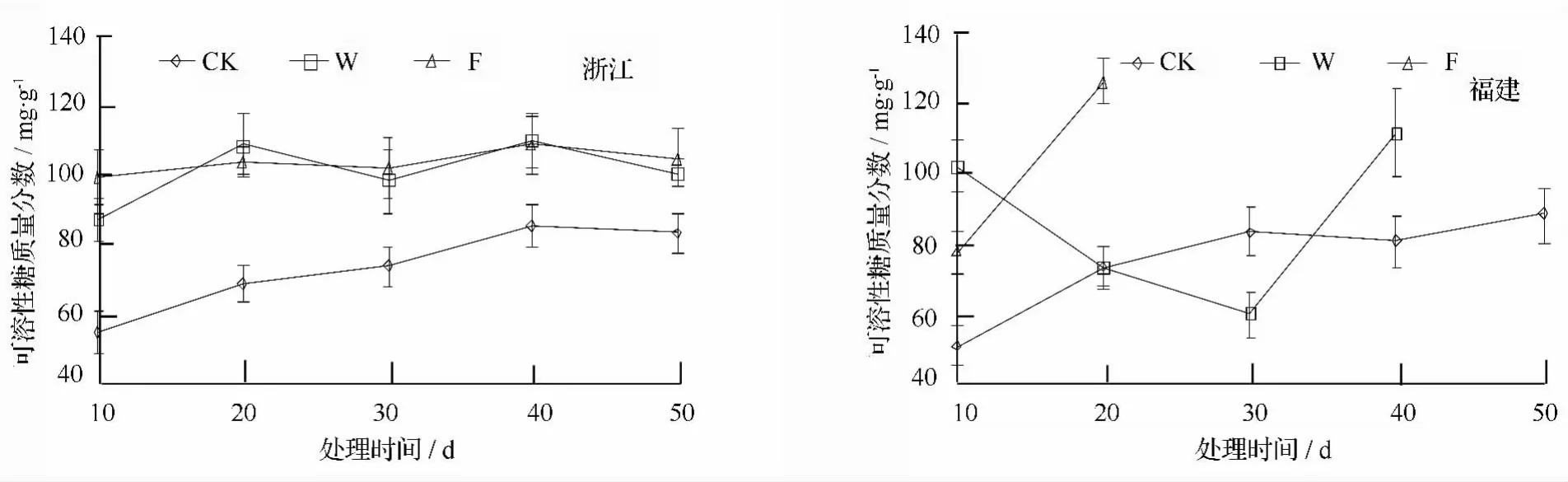
图5 淹水胁迫不同种源乌桕可溶性糖质量分数的影响
MDA是植物细胞膜脂过氧化的主要产物之一,MDA质量摩尔浓度升高是膜系统受伤害的另外一重要标志[11]。本试验研究结果表明,淹水胁迫下不同耐涝性的乌桕叶片MDA质量摩尔浓度有所积累,呈不同程度的上升趋势,但在整个淹水胁迫过程中,耐涝性差的福建种源MDA质量摩尔浓度均高于耐涝性强的浙江种源,可能是浙江种源在淹水胁迫下,由于体内较强活性的抗氧化酶系统能够在更大程度上清除或减少胁迫过程中产生的活性氧,从而减少了MDA的累积,缓解淹水胁迫对其造成的伤害,进而提高植株的耐涝能力。
3.2 淹水胁迫对乌桕叶片渗透调节物质的影响
为适应淹水逆境,植物会调节相应的代谢机制从而维持正常的生命活动,其中渗透调节是非常重要的调节机制之一。淹水胁迫下,细胞能主动积累可溶性蛋白、游离脯氨酸及可溶性糖等有机渗透调节物质,来调节细胞渗透势,维持体内水分平衡,保护植物组织内各种酶类和细胞膜结构的正常功能[12]。
淹水胁迫造成植物有氧呼吸受抑,ATP合成减少,抑制好气蛋白合成,促进厌氧代谢蛋白质(anaerobic protein,ANP)或厌氧多肽(anaerobic polypeptides,ANPs)合成[11],必定造成植物体内蛋白质质量分数的复杂变化。在淹水胁迫下,小麦[13]、玉米[14]、烟草[15]、西瓜[16]等叶片可溶性蛋白质质量分数均显著下降;张小平[17]、潘向燕[18]研究表明,抗涝性强的鹅掌楸种源或无性系在淹水胁迫下,叶片蛋白质质量分数要高于对照。本试验研究发现,耐涝性强的浙江种源在W和F处理下呈先上升后下降的趋势,可能是因为乌桕在淹水过程中产生了不定根和肥大的气孔,即使在涝渍胁迫下,也可以通过调节代谢机制使蛋白质的降解不出现明显增加;另外,淹水胁迫下乌桕叶片清除活性氧的保护酶系统活性增强,避免了蛋白质遭受活性氧的破坏,从而使得可溶性蛋白的质量分数增多。福建种源由于无法在生理上或形态上对淹水胁迫进行适应,涝渍胁迫阻碍了根系的有氧呼吸,影响了新的蛋白质的合成,同时由于自由基的大量产生,促进了原有蛋白质的降解,造成叶片蛋白质质量分数呈下降的趋势。
许多研究表明,干旱[19]、高温[20]、高盐[21]等逆境可增加游离脯氨酸质量分数,但淹水胁迫对脯氨酸质量分数的而影响因树种而异,越桔[22]和银杏[23]叶片脯氨酸质量分数随淹水时间的延长不断积累;而互花米草叶片游离脯氨酸质量分数与水淹时长无关[24];与对照相比,湿害处理后小麦穗部脯氨酸质量分数上升,叶部脯氨酸质量分数下降[25]。本试验研究结果表明,浙江种源乌桕叶片脯氨酸质量分数在淹水胁迫处理下较对照水平要低,结合蛋白质质量分数的变化,可能是更多的脯氨酸参与了蛋白质的合成;福建种源则不同程度的高于对照水平,推测可能原因是淹水胁迫导致蛋白质的合成受阻,产生大量的游离脯氨酸,另外,耐涝性差的植株也可能需要更多的脯氨酸来维持细胞的渗透势。
有报道指出,低氧胁迫下,植物可以通过减少碳水化合物的消耗,增加体内糖质量分数来增强植株的耐低氧能力[26-27],可溶性糖质量分数的增加,有利于氧缺乏时植物进行糖酵解和乙醇发酵[28]。高洪波等[29]研究表明,低氧胁迫下网纹甜瓜叶片可溶性糖质量分数显著高于对照处理,且抗涝性弱的品种增加的幅度显著高于抗涝性强的品种,银杏在淹水胁迫下,随淹水时间的延长,叶片可溶性糖的质量分数逐渐增加,明显高于对照[23],对烟草的研究也得到了相同的结果[15],认为在淹水胁迫下可溶性糖质量分数的增加,不仅可为植株的生长提供必要的能量,还能调节体内代谢,因而能在一定程度上减轻水涝的危害。
本研究发现,浙江种源在涝渍胁迫下,叶片可溶性糖质量分数一直保持较高的水平,且变化幅度不大,可能是淹水胁迫阻碍了叶片光合产物的转运,在保持叶片细胞膨压的同时,也为呼吸代谢提供了充足的底物,而福建种源在植株受到伤害时,叶片可溶性糖的质量分数均出现了下降的趋势,与互花米草[24]的研究一致,可能是由于水淹导致叶片光合速率下降,抑制了糖的合成积累,同时,长时间的无氧代谢消耗了大量的糖类,导致可溶性糖质量分数显著下降。另外,结合脯氨酸质量分数的变化,可以发现可溶性糖作为一种渗透调节物质,与脯氨酸质量分数存在此消彼涨的关系,这可能也是乌桕在对淹水胁迫的一种适应机制。
[1]陈有民.园林树木学[M].北京:中国林业出版社,1990.
[2]刘东泽,赵杰,刘志诚,等.20种植物提取物对几种昆虫的拒食作用[J].农药学学报,2003,5(3):89-91.
[3]张小红.乌桕的园林应用与栽培[J].中国林业,2006(9):41.
[4]张克迪,林一天.中国乌桕[M].北京:中国林业出版社,1994.
[5]Robert H Jones,Rebecca R Sharitz.Effects of root competition and flooding on growth of Chinese tallow tree seedlings[J].Canadian Journal of Forest Research,1990,20(5):573-578.
[6]Conner W H,Mcleod K W,McCarron J K.Flooding and salinity effects on growth and survival of four common forest wetland species[J].Wetlands Ecology and Management,1997,5(2):99-109.
[7]杨东,万福绪,顾汤华,等.上海海岸防护林造林树种的选择[J].南京林业大学学报:自然科学版,2012,36(2):95-100.
[8]邹琦.植物生理生化实验指导[M].北京:中国农业出版社,2000.
[9]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[10]潘澜,薛立.植物淹水胁迫的生理学机制研究进展[J].生态学杂志,2012,31(10):2662-2672.
[11]余淑文,汤章城.植物生理与分子生物学[M].北京:科学出版社,1998:366-389.
[12]刘爱荣,赵可夫.盐胁迫下盐芥渗透调节物质的积累及其渗透调节作用[J].植物生理与分子生物学学报,2005,31(4):389-395.
[13]王三根,何立人,李正玮,等.淹水对大麦与小麦若干生理生化特性影响的比较研究[J].作物学报,1996,22(2):228-232.
[14]张玉琼,张鹤英.淹水逆境下玉米若干生理生化特性的变化[J].安徽农业大学学报,1998,25(4):378-381.
[15]曾淑华,赵正雄,覃鹏,等.淹水对转超氧化物歧化酶或过氧化物酶基因烟草某些生理生化指标的影响[J].植物生理学通讯,2005,41(5):603-606.
[16]刘文革,阎志红,王川,等.西瓜幼苗抗氧化系统对淹水胁迫的响应[J].果树学报,2006,23(6):860-864.
[17]张晓平,方炎明,陈永江.淹涝胁迫对鹅掌楸属植物叶片部分生理指标的影响[J].植物资源与环境学报,2006,15(1):41-44.
[18]潘向燕.杂交鹅掌楸不同无性系对淹水胁迫的反应[D].南京:南京林业大学,2006.
[19]李燕,薛立,吴敏.树木抗旱机理研究进展[J].生态学杂志,2007,26(11):1857-1866.
[20]欧祖兰,曹福亮.植物耐热性研究进展[J].林业科技开发,2008,22(1):1-5.
[21]徐鲜钧,沈宝川,祁建民.植物耐盐性及其生理生化指标的研究进展[J].亚热带农业研究,2007,3(4):275-280.
[22]吴林,李亚东,张志东,等.三种类型越桔在淹水逆境下生理及形态反应的比较[J].园艺学报,1997,24(3):287-288.
[23]王义强,谷文众,姚水攀,等.淹水胁迫下银杏主要生化指标的变化[J].中南林学院学报,2005,25(4):78-80,85.
[24]肖强,郑海雷.水淹对互花米草生长及生理的影响[J].生态学杂志,2005,24(9):1025-1028.
[25]周广生,朱旭彤.湿害后小麦生理变化与品种耐湿性的关系[J].中国农业科学,2002,35(7):777-783.
[26]Ricard B,Toai T V,Chourey P.Evidence for critical role of sucrose syntheses for anoxic tolerance of maize roots using a double mutant[J].Plant Physiol,1998,116:1323-1331.
[27]Albrecht G,Mustroph A,Fox T C.Sugar and fructan accumulation during metabolic adjustment between respiration and fermentation under low oxygen conditions in wheat roots[J].Plant Physiol,2004,120:90-105.
[28]Bertrand A Y,Castonguay,Nadeau P,et al.Oxygen deficiency affects carbohydrate reserves in over wintering forage crops[J].Journal of Experimental Botany,2003,54:1721-1730.
[29]高洪波,郭世荣,章铁军,等.营养液低氧胁迫对网纹甜瓜幼苗生长和生理代谢影响[J].沈阳农业大学学报,2006,37(3):368-372.

