灌木柳叶PSII对盐胁迫的响应及耐盐性1)
周 鹏
(南京林业大学,南京,210037)
陈庆生 张 敏
(江苏省林业科学研究院)
张 强 方炎明
(南京林业大学)
土壤盐渍化严重影响农林生产和生态环境,已成为一个世界性的问题[1-2]。耐盐碱植物的筛选与种植,被认为是改良盐碱地的有效措施[3]。但可供盐碱地绿化造林的材料少,树种单一[4],因此,加强林木耐盐性研究对于耐盐树种的筛选及盐碱地综合治理具有重要意义。
研究表明,植物光合作用是对盐胁迫最敏感的生理过程,而PSⅡ是光合作用受到伤害的最原初部位[5-6]。叶绿素荧光分析技术能够为研究PSⅡ及其电子传递过程提供丰富信息[7]。但传统的叶绿素荧光测定方法只能测定叶片上某个点的荧光,不能准确反映整片叶及植株的真实生理状况[8]。叶绿素荧光成像技术是叶绿素荧光技术发展的最新成果,它不仅能够测定整叶甚至整株植物的叶绿素荧光,还能提供各参数对应的叶绿素荧光图像,可供研究者进行全面准确的分析[9]。目前,叶绿素荧光成像技术主要应用于叶片光合作用异质性的研究[10]和大量样品(如突变体、除草剂等)的筛选[11-12]及大批量微藻样品的毒理学研究[13]。
柳树属杨柳科柳属(Salix L.)乔、灌木,种类多,抗性强[14]。柳树种质资源丰富,是选育耐盐良种的理想树种。江苏省林业科学研究院从20世纪60年代起开展系统的柳树栽培和育种工作,已筛选出一批耐盐柳树无性系。目前,柳树耐盐性的研究大多集中在灌木柳生长指标、光合速率[15]、抗氧化酶、蛋白表达[16]等方面,而柳树盐胁迫下叶绿素荧光方面的研究尚不多见。本研究以2个耐盐性差异显著的灌木柳无性系为试材,利用叶绿素荧光成像仪,对盐胁迫下柳树PSⅡ荧光特性的变化进行了研究,探讨灌木柳耐盐特性和耐盐机制,为筛选和利用耐盐树种提供理论参考。
1 材料与方法
试验于2013年7月份在南京林业大学植物生理实验室进行。供试材料为2个耐盐性差异明显的灌木柳杂交种无性系:耐盐型JW2345(Salix suchowensis×S.integra)和盐敏感型 JW2367(S.viminalis×S.argyracea)的组织培养苗。
NaCl处理参照张敏等[17]的方法,生根培养30 d后,选取株高一致、根系发达、生长健壮的组培生根苗移入塑料套盆中用NaCl溶液处理,每盆50株。NaCl溶液用1/2MS液体培养基配制,用量为每盆500 mL,每2 d更换一次培养液。试验设5个浓度梯度,即:0(CK)、50(T1)、100(T2)、150(T3)、200 mmol·L-1(T4),每个处理重复3次。培养条件:温度25℃、空气相对湿度70%~80%、光照强度500 μmol·m-2·s-1、光周期昼 12 h/夜 12 h。
叶绿素荧光参数测定:培养7 d后,采用叶绿素荧光成像系统(Chlorophyll fluorescence Imager,CFI)(Technologica,英国)获取整叶叶绿素荧光图像。每个处理组剪取植株中部有代表性的叶片3片,按区域平放于自制样品板,置于样品室中,整个过程通过FluorImager(Version 2.2)软件完成(表 1),直接获取所有参数荧光图像及数据。

表1 叶绿素荧光成像测量程序
数据处理:所有测定指标均重复3次,结果取平均值±标准误。采用CFI自带软件FluorImager、Excel 2003及SPSS13.0统计分析软件进行数据处理,并对指标差异显著性利用Duncan’s新复极差法进行多重比较。
2 结果与分析
2.1 NaCl胁迫对灌木柳生物量的影响
由表2可知,处理 7 d后,50~100 mmol·L-1NaCl处理下,灌木柳水培苗干质量与对照无显著差异(P>0.05);随盐胁迫的加重,干质量均呈不同程度地下降,且JW2367下降幅度大于JW2345。结果表明,盐胁迫抑制灌木柳幼苗的生长,且对盐敏感型JW2367生长的抑制作用大于耐盐型JW2345。
2.2 盐胁迫对灌木柳叶Fv/Fm的影响
图1显示了不同浓度NaCl处理后灌木柳叶片形态图像和PSⅡ最大光化学效率(Fv/Fm)荧光成像图的变化。盐胁迫下灌木柳叶片均受到伤害,表现为叶片枯萎(图1A),且随着盐浓度增加伤害程度加大。相同处理下,盐敏感型JW2367叶片伤害的程度比耐盐型JW2345明显(图1B)。从图1可看出,荧光图对盐胁迫的反应较叶片可见伤害更敏感,如T1的 JW2367和 T2的 JW2345,盐胁迫并未对叶片形态产生明显影响,但荧光图变化明显。
Fv/Fm反映的是PSII反应中心捕获光能的效率,与有活性的PSⅡ反应中心数量成正比。在非胁迫条件下,Fv/Fm一般恒定在 0.74 ~ 0.85[18-19]。由表3可知,对照组中JW2345和JW2367的Fv/Fm分别为0.82和0.81,表明两者均处于正常生长状态。随着盐胁迫的加剧,灌木柳Fv/Fm均呈现下降趋势,且耐盐型JW2345的Fv/Fm值下降幅度明显小于盐敏感型JW2367。其中,T2引起灌木柳Fv/Fm值显著下降,但对干质量未产生显著影响,说明,Fv/Fm值对盐胁迫的反应较干质量更为敏感。
2.3 灌木柳叶Fo和Fm对盐胁迫的响应
最小荧光(Fo)是评价植物逆境伤害的重要指标之一,与反应中心活性有关[20]。如表3所示,50 mmol·L-1NaCl处理显著提高了灌木柳Fo值;但经100~200 mmol·L-1NaCl胁迫下,两个无性系的响应明显不同。JW2345的Fo随着盐胁迫的加剧而逐步上升,在T4时有所下降,但仍显著高于对照组,方差分析表明,各处理与对照差异显著(P<0.05);JW2367的Fo在T1时显著高于对照,随着NaCl浓度增加,Fo逐渐恢复到对照水平,T4时已低于对照组,但差异不显著。
最大荧光(Fm)可反映PSⅡ电子传递的最大潜力,Fm下降是光抑制发生的一个特征[21-22]。由表3表明,随着盐浓度的增加,灌木柳Fm均呈下降趋势,但相同处理下耐盐型JW2345的Fm值明显高于盐敏感型JW2367的。
2.4 盐胁迫下灌木柳叶F'v/F'm和 ΦP,SⅡ的变化
PSⅡ有效光化学量子产量(F'v/F'm)是有热耗散存在的情况下PSⅡ反应中心完全开放时的光化学效率,反映开放的PSⅡ反应中心的激发能捕获效率[9];PSⅡ实际光化学效率(ΦP,SⅡ)反映 PSⅡ反应中心部分关闭的情况下的实际光化学效率,与碳同化密切相关[23]。在盐胁迫下,两个无性系的 F'v/F'm变化趋势一致,随盐胁迫增加均显著下降(P<0.05)(表3)。其中,JW2345的 F'v/F'm值在 T3时下降幅度最大,比对照低38.71%;而JW2367在T4时下降最多,比对照低60.71%。

图1 盐胁迫对灌木柳叶Fv/Fm荧光图的影响
如表3所示,不同浓度NaCl处理下,灌木柳ΦP,SⅡ值较对照均降低,且 JW2345 下降幅度小于JW2367,最大降幅分别为 13.89%和 43.24%(P<0.05),表明盐胁迫可能导致植物同化力(NADPH和ATP)形成被抑制。
2.5 盐胁迫下灌木柳叶荧光猝灭的分析
荧光猝灭包括光化学猝灭(qP)和非光学猝灭(NP,Q)。qP反映PSⅡ天线色素吸收的光能用于光化学电子传递的部分,可以代表PSⅡ反应中心开放部分的比例;NP,Q反映的是PSⅡ天线色素吸收的光能不能用于光合电子传递而以热的形式耗散掉的部分[24]。表3显示了灌木柳qP在盐胁迫下的变化。灌木柳qP变化一致,受盐胁迫后均有所增加,且上升幅度随盐浓度的增加而增大。
由表3可知,JW2345对照组的 NP,Q明显低于JW2367的,且差异显著(P<0.05)。此外,盐胁迫下两个无性系NP,Q的变化趋势也存在差异。50 mmol·L-1NaCl处理提高了JW2345的NP,Q,比对照提高了24.17%(P<0.05),T2、T3、T4 稍低于对照,但差异不显著;随着盐胁迫浓度的增加,JW2367的 NP,Q则呈下降趋势,在T4时下降幅度最大,比对照下降了66.81%,方差分析表明,除T1外,其他处理与对照均有显著差异(P<0.05)。
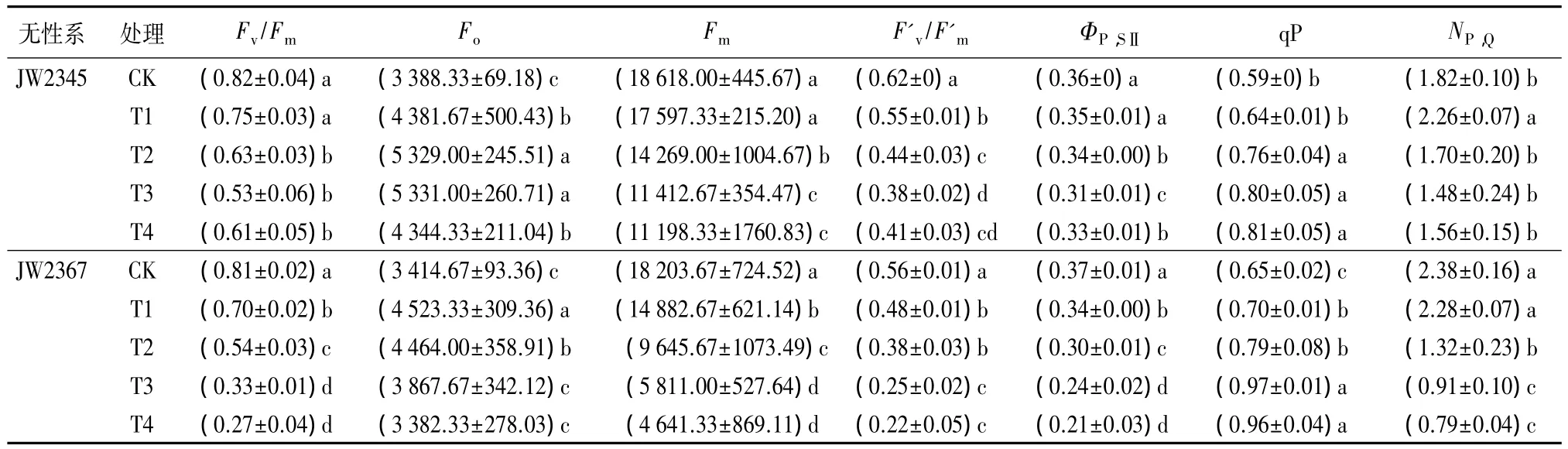
表3 盐胁迫对灌木柳叶片荧光参数的影响
3 结论与讨论
生物量是植物对盐胁迫反应的综合体现,也是评价植物耐盐性的重要指标[25]。Fv/Fm和Fm是衡量光抑制的重要指标,可以反映环境胁迫程度[19-21]。本试验结果显示,随盐胁迫加强,灌木柳干质量、Fv/Fm和Fm值均下降,JW2345降幅均低于JW2367,且Fv/Fm与干质量存在极显著的正相关关系(r=0.894,P<0.01)。表明盐胁迫导致灌木柳叶片PSⅡ受损,出现光抑制现象[26],耐盐型 JW2345受伤害较轻,具有一定的耐盐能力,这与施士争等[27]筛选耐盐灌木柳无性系时所得结论一致。
本试验中,盐胁迫下随着Fv/Fm的降低,灌木柳ΦP,SⅡ下降,qP则上升,推测盐胁迫下灌木柳可能通过调节PSⅡ反应中心开放程度(qP),以适应光抑制的发生[28],但由于反应中心对激发能捕获能力(F'v/F'm)的下降,引起 ΦPSⅡ被迫性下降[10,29]。与本文的研究结果相似,Askri等[30]发现葡萄(Vitis vinifera)在盐处理14 d后qP没有明显变化,主要是由于 NP,Q上升引起 F'v/F'm降低,最终导致 ΦP,SⅡ降低。本研究中,盐胁迫下耐盐型JW2345通过提高或维持非光化学能量耗散(NP,Q)来适应光合效率的下降,以避免产生光破坏[31];而盐敏感型 JW2367的NP,Q显著下降,表明热耗散机制严重受损,植物光保护能力丧失,且此时出现叶尖或叶片枯萎等形态变化,说明过多激发能积累已导致叶片严重光破坏。由此可见,盐胁迫下耐盐型JW2345叶片NP,Q的变化情况实际反映了植物对逆境所产生的一种自我调节和自我保护机制[22],这可能正是其较盐敏感型JW2367耐盐的原因之一。
目前,国内外学者普遍认为依赖叶黄素循环的热耗散存在于大多数植物中,并且是一种最主要的方式[32-33]。有研究表明,初始荧光Fo的变化可以推断反应中心状况和可能的光保护机制,依赖叶黄素循环的热耗散增加将会导致Fo降低,反应中心可逆失活或破坏及类囊体膜受损会引起Fo增加。本研究发现,盐胁迫导致耐盐型JW2345的Fo显著升高,而此时NP,Q显著高于或接近对照。由于依赖叶黄素循环的热耗散总是导致Fo的降低,显然,盐胁迫引起的柳树叶片Fo的增加不能归因于这个机制,试验中Fo的增加很可能是依赖PSⅡ反应中心可逆失活的热耗散运转所致[34],柳树叶片通过PSⅡ反应中心可逆失活提高自身热耗散能力,同时伴随有活性的PSⅡ反应中心数量降低,光抑制产生,这与低盐处理下NP,Q升高及Fv/Fm降低相吻合。因此,此时光抑制的产生是光合作用的保护过程[35]。此外,钱永强等[20]研究柳树经 Cd2+胁迫时,也发现在柳树中可能存在依赖PSⅡ反应中心失活的热耗散机制。
综上所述,灌木柳耐盐性及叶绿素荧光对盐胁迫的响应存在差异,并能通过叶绿素荧光成像图快速、直观地反映出来,说明叶绿素荧光成像技术可用于耐盐植物的快速筛选。盐胁迫下灌木柳起关键保护作用的很可能是依赖PSⅡ反应中心可逆失活的热耗散机制,其具体作用机制值得进一步深入研究。
[1]Zhou Jing,Liu Mingying,Jiang Jing,et al.Expression profile of miRNAs in Populus cathayana L.and Salix matsudana Koidz under salt stress[J].Molecular Biology Reports,2012,39(9):8645-8654.
[2]Rao E S,Kadirvel P,Symonds R C,et al.Relationship between survival and yield related traits in Solanum pimpinellifolium under salt stress[J].Euphytica,2013,190(2):215-228.
[3]高彦花,张华新,杨秀艳,等.耐盐碱植物对滨海盐碱地的改良效果[J].东北林业大学学报,2011,39(8):43-46.
[4]林士杰,张忠辉,张大伟,等.盐碱地树种选择及抗盐碱造林技术研究进展[J].中国农学通报,2012,28(10):1-5.
[5]Codrea M C,Hakala-Yatkin M,Kårlund-Marttila A,et al.Mahalanobis distance screening of Arabidopsis mutants with chlorophyll fluorescence[J].Photosynthesis Research,2010,105(3):273-283.
[6]Koyro H W.Effect of salinity on growth,photosynthesis,water relations and solute composition of the potential cash crop halophyte Plantago coronopus(L.)[J].Environmental and Experimental Botany,2006,56(2):136-146.
[7]Schansker G,Tóth S Z,Holzwarth A R,et al.Chlorophyll a fluorescence:beyond the limits of the Q(A)model[J].Photosynthesis Research,2014,120(1/2):43-58.
[8]王春萍,雷开荣,李正国,等.低温胁迫对水稻幼苗不同叶龄叶片叶绿素荧光特性的影响[J].植物资源与环境学报,2012,21(3):38-43.
[9]Venkateswarlu B,Shanker A K,Shanker C,et al.Crop stress and its management:perspectives and strategies[M].New York:Springer Nethlands,2012:359-398.
[10]杜亮亮,金爱武,胡元斌,等.5种箬竹属竹种叶绿素荧光特性的比较[J].世界竹藤通讯,2009,7(2):17-21.
[11]Oxborough K.Imaging of chlorophyll a fluorescence:theoretical and practical aspects of an emerging technique for the monitoring of photosynthetic performance[J].Journal of Experimental Botany,2004,55(40):1195-1205.
[12]Barbagallo R P,Oxborough K,Pallett K E,et al.Rapid,noninvasive screening for perturbations of metabolism and plant growth using chlorophyll fluorescence imaging[J].Plant Physiology,2003,132(2):485-493.
[13]Chalifour A,Spear P A,Boily M H,et al.Assessment of toxic effects of pesticide extracts on different green algal species by using chlorophyll a fluorescence[J].Toxicological and Environ Chemistry,2009,91(7):1315-1329.
[14]汪有良,王宝松,施士争.灌木型柳树镉吸收积累性状的研究[J].西北林学院学报,2011,26(2):105-110.
[15]隋德宗,王保松,施士争,等.盐胁迫对灌木柳无性系幼苗生长及光合作用的影响[J].浙江林学院学报,2010,27(1):63-68.
[16]隋德宗,田鑫,施士争,等.盐胁迫对灌木柳无性系生长及蛋白表达的影响[J].林业科技开发,2009,23(1):49-51.
[17]张敏,李荣锦,黄利斌,等.NaCl胁迫下构树幼苗液泡膜生理生化响应[J].林业科学,2009,45(8):50-55.
[18]Lichtenthaler H K,Buschmann C,Knapp M.How to correctly determine the different chlorophyll fluorescence parameters and the chlorophyll fluorescence decrease ratio RFd of leaves with the PAM fluorometer[J].Photosynthetica,2005,43(3):379-393.
[19]杨福孙,孙爱花,王燕丹,等.生长延缓剂对槟榔苗期叶绿素含量及叶绿素荧光参数的影响[J].中国农学通报,2009,25(2):255-257.
[20]钱永强,周晓星,韩蕾,等.3种柳树叶片PSⅡ叶绿素荧光参数对 Cd2+胁迫的光响应[J].北京林业大学学报,2011,33(6):8-14.
[21]付连双,谢甫绨.土壤水分对越冬期间冬小麦叶绿素荧光参数的影响[J].东北农业大学学报,2011,42(4):36-41.
[22]柯裕州,周金星,卢楠,等.盐胁迫对桑树幼苗光合生理及叶绿素荧光特性的影响[J].林业科学研究,2009,22(2):200-206.
[23]谢寅峰,李博,陶功胜,等.纳米氧化硅对髯毛箬竹光合荧光特性的影响[J].南京林业大学学报:自然科学版,2012,36(2):59-63.
[24]Qiu Nianwei,Lu Qingtao,Lu Congming.Photosynthesis,photosystem II efficiency and the xanthophyll cycle in the salt-adapted halophyte atriplex centralasiatica[J].New Phytologist,2003,159(2):479-486.
[25]Wani A S,Ahmad A,Hayat S,et al.Salt-induced modulation in growth,photosynthesis and antioxidant system in two varieties of Brassica juncea[J].Saudi Journal of Biological Sciences,2013,20(2):183-193.
[26]Demmig-Adams B,Adams Iii W W.Photoprotection and other responses of plants to high light stress[J].Annual Review of Plant Biology,1992,43(1):599-626.
[27]施士争,隋德宗,王红玲,等.灌木柳速生无性系的耐盐性选择研究[J].西北林学院学报,2010,25(4):72-77.
[28]王良桂,张春霞,彭方仁,等.干旱胁迫对几种楸树苗木叶片荧光特性的影响[J].南京林业大学学报:自然科学版,2008,32(6):119-122.
[29]Baker N R,Rosenqvist E.Applications of chlorophyll fluorescence can improve crop production strategies:an examination offuture possibilities[J].Journal of Experimental Botany,2004,55(43):1607-1621.
[30]Askri H,Daldoul S,Ammar A B,et al.Short-term response of wild grapevines(Vitis vinifera L.ssp.sylvestris)to NaCl salinity exposure:changes of some physiological and molecular characteristics[J].Acta Physiologiae Plantarum,2012,34(3):957-968.
[31]Zhang Hao,Hu Hao,Zhang Xiaobin,et al.Detecting Suaeda salsa L.chlorophyll fluorescence response to salinity stress by using hyperspectral reflectance[J].Acta Physiologiae Plantarum,2012,34(2):581-588.
[32]林荣呈,许长成,李良璧,等.叶黄素循环及其在光保护中的分子机理研究[J].植物学报,2002,44(4):379-383.
[33]Boughalleb F,Denden M,Tiba B B.Photosystem II photochemistry and physiological parameters of three fodder shrubs,Nitraria retusa,Atriplex halimus and Medicago arborea under salt stress[J].Acta Physiologiae Plantarum,2009,31(3):463-476.
[34]许大全.光合作用效率[M].上海:上海科学技术出版社,2002:136-153.
[35]Zhao Changming,Wang Genxuan,Wei Xiaoping,et al.Effects of groundwater depth variation on photosynthesis and photoprotection of Elaeagnus angustifolia L.[J].Trees,2007,21(1):55-63.

