蒙药乳腺-I号对乳腺增生大鼠乳腺组织细胞增殖和凋亡的影响
王忠超,李跃华,张彬,刘兰涛,魏成喜,额都,,任立群
(1. 长春医学高等专科学校 病理教研室,吉林 长春 130031;2. 长春市中医院 急诊科,吉林 长春130021 ;3. 内蒙古民族大学 蒙西医结合药物研究所,内蒙古 通辽 0280072;4.内蒙古民族大学附属医院,内蒙古 通辽 028007;5. 吉林大学 药学院 实验药理与毒理学教研室,吉林 长春1300513)
蒙药乳腺-I号对乳腺增生大鼠乳腺组织细胞增殖和凋亡的影响
王忠超1,李跃华2,张彬3,4△,刘兰涛4,魏成喜3,额都3,4,任立群5
(1. 长春医学高等专科学校 病理教研室,吉林 长春 130031;2. 长春市中医院 急诊科,吉林 长春130021 ;3. 内蒙古民族大学 蒙西医结合药物研究所,内蒙古 通辽 0280072;4.内蒙古民族大学附属医院,内蒙古 通辽 028007;5. 吉林大学 药学院 实验药理与毒理学教研室,吉林 长春1300513)
目的研究蒙药乳腺-I(M-I)号对乳腺增生大鼠乳腺组织细胞增殖和凋亡的影响。方法实验动物采用雌性未孕Wistar大鼠,乳腺增生模型复制方法为大鼠肌肉注射苯甲酸雌二醇0.5 mg/(kg·d)25 d,随后肌肉注射黄体酮4 mg/(kg·d)5 d。实验共分为6组:正常对照组、模型对照组,均给与生理盐水灌胃;阳性药对照组,给与三苯氧胺1.8 mg/kg灌胃;M-I号低、中和高剂量组分别给予M-I号0.5 g/kg、1.0 g/kg和3.0 g/kg灌胃。给药结束后,通过对各组大鼠乳腺组织进行HE染色,观察大鼠乳腺组织增生的程度,应用免疫组织化学方法观察乳腺组织中增殖细胞核抗原、细胞凋亡相关调控因子Bcl-2、Bax的表达。结果M-I号能够抑制乳腺组织增生,降低PCNA和Bcl-2的表达活性(P<0.05),增加Bax的表达活性(P<0.05),进而抑制乳腺组织细胞增殖,促进细胞凋亡(P<0.05)。结论M-I号对乳腺增生大鼠有较好的治疗作用,其治疗机制与抑制大鼠乳腺组织细胞增殖,促进细胞凋亡的作用有关。
蒙药乳腺-I号;乳腺增生;细胞凋亡
1 材料与方法
1.1 动物及主要试剂 雌性Wistar大鼠由吉林大学基础动物室提供,数量为48只,体重在180~220 g之间,大鼠合格证号为 SCXK-(吉)2007-0003。
苯甲酸雌二醇注射液和黄体酮注射液均购买于上海通用药业股份有限公司,批号分别是090902和090402;枸橼酸他莫昔芬,批号090101,购买于苏州第一制药有限公司;pv-6000通用型二步法免疫组化检测试剂盒(批号:133308 A)、DAB显色试剂盒(批号:k 136924 F)、细胞凋亡检测试剂盒(批号:bs-0491 R)、PCNA抗体(批号:BM 0104)、Bcl-2抗体(批号:c 2913)、Bax(批号:c 0212)试剂盒均购买于武汉博士德生物工程有限公司。
内蒙古民族大学附属医院负责提供M-I号(哲卫药准字:9604-79),其处方组成包括豆蔻、丁香、栀子、手掌参、沙棘、赤子、珍珠杆、诃子等30味蒙药。大鼠给药剂量根据临床药物剂量换算而得。
1.2 分组及给药 首先随机选出8只大鼠作为正常对照组(NC),将NC大鼠每天肌肉注射生理盐水,连续注射30 d,借鉴文献[5]中的方法将其余大鼠复制乳腺增生模型,具体措施为给予大鼠肌肉注射苯甲酸雌二醇25 d,剂量为0.5 mg/(kg·d);再肌肉注射黄体酮5 d,剂量为4 mg/(kg·d),之后将乳腺增生大鼠随机分为5组:模型对照组(MC),给予生理盐水灌胃;阳性药对照组(PC),给予三苯氧胺1.8 mg/kg灌胃;M-I低、中和高剂量组(M-IL、M-IM和M-IH),分别灌胃给予M-I 0.5 g/kg、1.0 g/kg和3.0 g/kg;共给药4周,期间NC大鼠给予生理盐水灌胃。给药期间每天观察大鼠状态,处理动物前,动物禁食12 h,收集血清分装于100µL EP管中,-80℃冰箱冻存;取乳腺组织用4%多聚甲醛固定。
1.3 大鼠乳腺组织病理学检查 将大鼠乳腺组织切片进行苏木素-伊红染色,在显微镜下观察乳腺组织形态,并对各组大鼠乳腺增生情况进行分级并记分:正常乳腺形态,记1分;病理表现为纤维组织在乳腺小叶内增多,腺泡和导管扩张而且数量增多,但腺泡及导管上皮无增生者视为轻度增生,记2分;病理表现为腺泡数量增多,且腺泡扩张及分泌现象严重,腺泡及导管上皮出现多层或乳头状改变者视为重度增生,记3分,之后对各组平均积分进行统计。
1.4 免疫组织化学方法检测大鼠乳腺组织Bax,Bcl-2,PCNA的表达 Bax,Bcl-2,PCNA采用pv-6000通用型二步法检测试剂盒测定,操作步骤如下:将组织切片进行脱蜡和水化;3% H2O2去离子水孵育10 min;滴加一抗后4℃过夜,用配好的PBS液冲洗3次,每次2 min;滴加试剂1后37℃孵育20 min,PBS 液冲洗3次,每次2 min;滴加试剂2后37℃孵育20 min,PBS液冲洗 3次,每次2 min;应用DAB溶液显色;自来水充分冲洗后苏木素复染。
乳腺组织中PCNA的阳性强度判断方法参照文献[6],每个切片随机取3个视野,观察每个视野中的乳腺上皮细胞,每个视野中无阳性细胞为(-),阳性细胞<10%为(+),阳性细胞达10%~50% 为(++),阳性细胞>50%为(+++)。Bax,Bcl-2的图像采用 Motic Images Advanced 3.2软件进行分析,计算目标总面积占选区总面积的百分比。
1.5 统计学方法 采用SPSS 11.5软件进行统计学分析,大鼠乳头高度及乳腺组织Bax,Bcl-2,PCNA表达量用“x±s”表示。组间比较采用t检验进行统计学分析。
2 结果
2.1 M-I对模型大鼠乳腺组织PCNA表达的影响PCNA 在乳腺导管上皮细胞和腺上皮细胞的细胞核中表达,染色为棕黄色颗粒。模型对照组与正常对照组比较,PCNA的表达量有显著性增加(P<0.01)。与模型对照组相比,阳性药、蒙药乳腺-I号中、高剂量均可降低增生大鼠乳腺组织中PCNA的表达量,具有显著差异(P<0.05,见表1)。

表1 各组大鼠乳腺组织PCNA 表达的比较(n=24)Tab.1 Comparison of PCNA expression in various groups by Immunohistochemical (n=24)
2.2 M-I对大鼠乳腺组织Bax和Bcl-2表达的影响 与正常组大鼠比较,模型对照组大鼠乳腺组织中Bax水平显著降低,Bcl-2水平显著升高,差异有统计学意义(P<0.05);M-I号高剂量组大鼠血清Bax、Bcl-2水平接近于正常对照组。与模型对照组大鼠比较,M-I号高剂量组乳腺组织中Bax水平显著增高(P<0.05),Bcl-2水平显著降低(P<0.05,见表2、图1、图2)。

表2 各组大鼠乳腺组织 Bax、Bcl-2表达的比较(n=8)Tab.2 Comparison of Bax and Bcl-2 expression in various groups by Immunohistochemical (n=8)
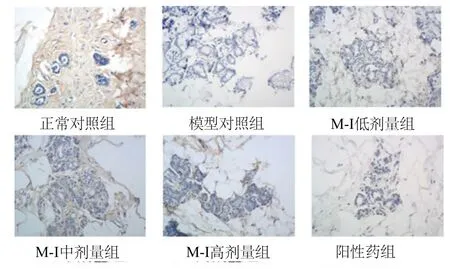
图1 免疫组织化学检测各组大鼠乳腺组织中Bax的表达Fig.1 The expression of Bax in various groups by Immunohistochemistry
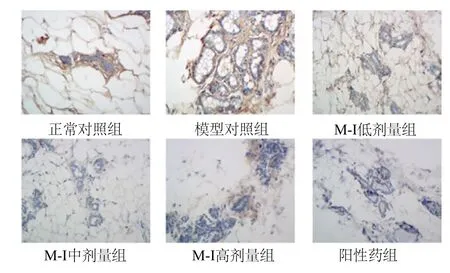
图2 免疫组织化学检测各组大鼠乳腺组织中Bcl-2的表达Fig.2 The expression of Bcl-2 in various groups by Immunohistochemistry
2.4 大鼠乳腺组织病理学特征分析 HE染色可见NC组大鼠乳房中脂肪较多乳腺小叶数量较少,呈散在分布,无导管和腺泡扩张及数量的增多、导管腔和腺泡腔内无分泌物或仅有少许分泌物。与正常组相比,模型对照组乳腺小叶数量增多,腺泡及导管大量增生,腺泡高度扩张,可见腺泡腔及导管腔内有大量分泌物,导管上皮呈多层和/或乳头状改变。阳性药对照组乳腺小叶数和乳腺小叶腺泡数比模型对照组明显减少,腺泡上皮多呈立方上皮,少数为扁平状,腔内无分泌物或有少许分泌。M-I号各治疗组乳腺小叶数及小叶腺泡数均少于模型对照组,乳腺腺泡数目及腔内分泌物较少,导管管腔变小,体积缩小(见表3)。

表3 各组大鼠乳腺组织病理学评分的比较(n=8)Tab.3 Comparisons of pathological grading scores of breast tissue of rats in various group(n=8)
3 讨论
目前乳腺增生病的病因并不明确,主要的观点是认为女性在月经周期作用下,雌激素反复作用于乳腺,使乳腺导管和小叶过度增生最终导致乳腺增生。细胞凋亡是细胞死亡方式之一,和细胞坏死不同,细胞调亡是细胞主动的、程序性的死亡。有研究表明,在月经周期中乳腺细胞存在着增殖和凋亡的波动[7]。增殖活性是主要依赖性激素的波动,而细胞凋亡活动可能受到激素和非激素双重因素的调控[8]。因此可推测乳腺上皮细胞的增殖和凋亡的稳定性对乳腺正常的形态和功能有重要的意义,一旦二者平衡被破坏,出现了增殖过度或者凋亡减退,这样一来就会促进乳腺增生症的形成。以往的研究已表明M-I号对乳腺增生症的治疗与调整大鼠体内雌、孕激素水平,调整大鼠乳腺组织中雌、孕激素受体表达是有关的[9],而M-I号的作用机制是否与调节乳腺上皮细胞中与细胞增殖与凋亡的因素相关,本研究利用实验动物,对大鼠乳腺组织中与细胞增殖和凋亡的相关指标进行检测,进而对 M-I号的治疗机制进行探讨。
Bcl-2和Bax是Bcl-2家族成员中调控细胞凋亡的重要基因。Bax是促凋亡基因,而Bcl-2能够抗凋亡,可通过许多途径阻止细胞凋亡。如Bax过度表达,Bax 蛋白间会形成同源二聚体,推动细胞凋亡的发生;如Bcl-2过度表达,它会与Bax蛋白结合形成异源二聚体,抑制细胞凋亡的进行[10]。因此二者比例如果不正常,细胞凋亡将失去重要的调控因素[11]。Luna-MoréS等对508例乳腺样本进行检测发现乳腺增生、乳腺原位癌和乳腺转移性癌组织中 Bcl-2表达呈强阳性表达[12]。
在本实验中,与空白对照组比较,模型对照组大鼠乳腺组织中Bcl-2表达升高,Bax表达下降,表明乳腺增生大鼠体内,乳腺增生的发生与细胞凋亡减少有关。与模型对照组比较,M-I号高、中剂量组的Bcl-2表达明显下降,而Bax含量升高,提示M-I号在治疗乳腺增生的过程中,有促进细胞凋亡的作用。
PCNA不但在细胞核内合成,而且在细胞核内实现其功能。它能够对DNA的合成与修复起作用,在细胞周期的G1期PCNA表达逐渐增加,S期表达到高峰,在细胞周期的G2期和M期PCNA表达减少,PCNA表达水平的高低可用来反映细胞DNA合成速度。目前已把PCNA作为衡量细胞增殖的重要指标之一。多项研究表明,PCNA在细胞内含量高时,细胞增生活跃,倍增时间短,细胞分化程度低,组织侵袭力强,肿瘤的复发及远处转移早,临床预后差[13-14]。在乳腺癌的研究方面,许多学者已把PCNA的阳性表达用来估计乳腺癌的预后情况[15-16]。例如石林祥等对乳腺癌术后5年无复发组和死亡组乳腺组织中 PCNA表达进行比较,结果PCNA 高者预后明显差于PCNA低者,且PCNA与淋巴结转移及临床分期有关,PCNA高者淋巴结转移阳性率高,临床分期晚[17]。
本实验结果显示:模型对照组与正常对照组比较,大鼠乳腺组织PCNA的表达量有显著的增加(P<0.01),与模型对照组相比,阳性药、蒙药乳腺-I号中、高剂量均可降低增生大鼠乳腺组织中PCNA的表达量,具有显著差异(P<0.05)。
综上所述,蒙药乳腺-I号不仅可以改善乳腺增生大鼠乳腺组织的病理结构,还可以通过调节乳腺上皮细胞中PCNA、Bcl-2 和 Bax的表达发挥治疗乳腺增生的作用。
[1] 王强修,阮永威,覃业军.现代乳腺疾病诊断病理学[M].北京:中国医药科技出版社,2008,88-90.
[2] 王称,严俊,胡泽楠,等.不同职业女性乳腺增生筛查分析[J].中国妇幼保健,2012,27(28):4385-4387.
[3] 刘铁钢,张彬,杨雨民.蒙药那木达奇治疗乳腺增生症临床疗效观察[J].中国医药指南,2012,10(6):228-229.
[4] Wang ZC,ED,Batu DL,et al.2 D-DIGE proteomic analysis of changes in estrogen/progesterone-induced rat breast hyperplasia upon treatment with the Mongolian remedy RuXian-I[J].Molecules,2011,16(4):3048-3065.
[5] 吴晓燕,瞿发林,许立,等.乳康口服液对大鼠乳腺增生及性激素水平的影响[J]. 解放军药学学报,2013,29(2):106-108.
[6] 李湘奇,党相国疏肝健脾方对模型大鼠乳腺增生组织细胞增殖/凋亡的影响[J].中国药房,2009,20(30):2326-2328
[7] Meresman G.Relevance of apoptosis in the female reproductive system[J].Invest Clin.2011,52(3):274-290.
[8] Maria Ali HN,Carolina M,Roberto F,et al.Assessment of the proliferative,apoptotic and cellular renovation indices of the human mammary epithelium during the follicular and luteal phases of the menstrual cycle[J]. Breast Cancer Research,2005,7(3):306-313.
[9] 王忠超,李敏,张彬,等.蒙药乳腺-Ⅰ号对乳腺增生大鼠抗氧化能力、乳腺组织雌激素受体和孕激素受体表达的影响[J].吉林大学学报(医学版).2012,38(6):1052-1057.
[10] 吉木斯,李存保.Bcl-2家族在线粒体细胞凋亡途径中的作用[J].内蒙古医科大学学报,2013,35(2):152-155.
[11] Golestani Ei B,Sanati MH,Houshmand M,et al.Expression and prognostic significance of bcl-2 and bax in the progression and clinical outcome of transitional bladder cell carcinoma[J].Cell J,2014,15(4):356-363.
[12] Luna-Moré S,Weil B,Bautista D,et al.Bcl-2 protein in normal,hyperplastic and neoplastic breast tissues.A metabolite of the putative stem-cell subpopulation of the mammary gland[J].Histol Histopathol,2004,19(2):457-463.
[13] Ouhtit A,Gaur RL,Abdraboh M.Simultaneous inhibition of cell-cycle,proliferation,s urvival,metastatic pathways and induction of apoptosis in breast cancer cells by a phytochemical super-cocktail:genes that underpin its mode of action[J].J Cancer,2013,4(9):703-715.
[14] 李英杰,于长海,俞建琦,王宏伟. 细支气管肺泡癌中PCNA、p16和p27的表达及其临床意义[J].临床军医杂志,2012,40(6):1315-1318.
[15] 张秀梅,王玉梅.乳腺癌细胞凋亡指数、PCNA、PgP与乳腺癌预后相关性的研究[J]中国实用医药,2013,8(5):96-98.
[16] Campbell MJ,Wolf D,Mukhtar RA,et al.The prognostic implications of macrophages expressing proliferating cell nuclear antigen in breast cancer depend on immune context[J].PLoS One,2013,8(10):79114.
[17] 王晓武.Bcl-2和Bax基因及多态性与乳腺癌关系的研究进展[J].青海医药杂志,2013,43(2):78-80.
Effect of Mongolian Remedy RuXian- I on proliferation and apoptosis of mammary gland hyperplastic tissue in rats
WANG Zhong-chao1, LI Yue-hua2, ZHANG Bin3,4△, LIU Lan-tao4, WIE Cheng-xi3, E Du3,4, REN Li-qun5
(1. Department of Pharmacology, Changchun Medical College, Changchun 130031, China; 2. Affiliated Hospital Inner Mongolia University for the Nationalities, Tongliao 028007, China; 3. Institute of Mongolia and Western Medicinal treatment, Inner Mongolia University for the Nationalities, Tongliao 028007, China; 4. Emergency department,Changchun Chinese medicine hospital, Changchun 130021, China; 5. Department of Experimental Pharmacology and Toxicology, School of Pharmaceutical Sciences, Jilin University, Changchun 130021, China)
ObjectiveTo observe effects of Mongolian Remedy RuXian- I on proliferation and apoptosis of Mammary Gland Hyperplastic Tissue in Rats。Method8 rats randomly chosen from Forty-eight virgin female Wistar rats were regarded as normal. The others were injected intramuscular with E 2(0.5 mg/kg) per day for 25 d and P(4 mg/kg) per day for 5 d. The rats in normal control group were injected with normal saline. Then disease model group was randomly divided into 5 groups: model control group, positive control group, M- I low dosage group, M- I middle dosage group and M-I high dosage group. The rats in different groups were respectively treated with normal saline, tamoxifen, M- I 0.5, 1.0 and 3.0 g/kg for 28 d. Then the pathological changes and expressions of Bax, Bcl-2, PCNA in breast tissues were measured。ResultsCompared with normal control group, expression of PCNA and Bcl-2 in model control group were obviously higher(P<0.01, P<0.05), while the expression of Bax were obviously lower (P<0.01). Compared with model control group, the expressions of PCNA and Bcl-2 in breast tissue in M-I high dosage group were obviously lower, while the expressions of Bax breast tissues were obviously higher(P<0.05)。ConclusionTreatment mechanism of M-I may be related with inhibited cell proliferation and promote cell apoptosis in the breast tissue.
Mongolian Remedy RuXian-I; hyperplasia of mammary glands; apoptosis
R 285.5
A
1005-1678(2014)01-0056-04
有报道表明,我国因乳腺癌死亡的人群平均年龄为67.91岁,其中年龄在 55~75岁的患者已占乳腺癌死亡人数的46.75%[1]。因此乳腺疾病对老年人的健康已造成了不可忽视的危害。对乳腺癌的防治重在早期预防,而乳腺增生症是诱发乳腺癌的因素之一,随着生活环境的改变及生活节奏的加快,其发病率逐年升高[2]。目前临床上治疗乳腺增生的有效药物很少,西药治疗又有很大的副作用。蒙药乳腺-I(M-I)号经临床验证对乳腺增生的治疗有较好的治疗效果。据临床疗效观察,其治疗乳腺增生的有效率可达到96.7%[3]。因此深入探讨M-I的治疗机制,为开发民族药及进一步研制治疗乳腺增生的有效药物,减少乳腺增生病对患者造成的病痛有重要的意义。为探讨M-I的治疗机制,在前期工作中已利用荧光差异双向凝胶电泳技术做了初步研究,发现在质谱鉴定出的结果中,有部分差异蛋白是与细胞增殖和凋亡相关的[4]。因此在前期研究基础上,本实验旨在通过复制大鼠乳腺增生模型,利用免疫组织化学方法,对M-I号作用后大鼠乳腺组织中增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)和凋亡相关蛋白 Bax、Bcl-2进行检测,为进一步研究M-I号治疗乳腺增生症的治疗机制提供有力的实验依据。
王忠超,女,博士,讲师,研究方向:乳腺病理学与病理生理学,Email:jlccwzc@qq.com;张彬,通信作者,博士,教授,硕士生导师,研究方向:乳腺外科学,E-mail:bzh 9911@163.com。

