人乳头瘤病毒1 8型E 6的点突变体对宫颈癌H e l a细胞生长和凋亡的影响
左丽君,吴宝杰,刘飞,吴燕雯,范立强
(生物反应器工程国家重点实验室 华东理工大学,上海 200237)
人乳头瘤病毒1 8型E 6的点突变体对宫颈癌H e l a细胞生长和凋亡的影响
左丽君,吴宝杰,刘飞,吴燕雯,范立强△
(生物反应器工程国家重点实验室 华东理工大学,上海 200237)
目的构建并鉴定pcDNA 3.1(+)/HPV 18 E6及其突变体pcDNA 3.1(+)/E6 F49R、pcDNA 3.1(+)/E6 F127R真核重组表达质粒,并在转染Hela细胞后,检测其对宫颈癌Hela细胞生长增殖的影响。方法用RT-PCR法从HeLa细胞中扩增HPV 18 E6基因及其突变体HPV 18 E6 F49R、HPV 18 E6 F127R、HPV 18 E6 F49R-F127R基因片段,构建重组表达载体pcDNA 3.1(+)/HPV 18 E 6、pcDNA 3.1(+)/E6 F49R、pcDNA 3.1(+)/E6 F127R,在HeLa细胞中进行转染,48 h后进行MTT试验,利用吖啶橙/溴乙锭(AO/EB)双染法在荧光显微镜下进行细胞形态学的观察。结果成功构建了3种重组表达载体;重组质粒成功转染到Hela细胞中;pcDNA 3.1(+)/HPV 18 E6能促进细胞增殖;pcDNA 3.1(+)/E6 F 49 R和pcDNA 3.1(+)/E6 F127R在一定程度上可抑制表达有E6全长的HPV阳性细胞系Hela的增殖;荧光显微镜下观察到转染了突变体重组质粒的细胞均呈现细胞核皱缩,表现为早起凋亡现象。结论HPV 18 E6及其突变体的真核表达为研究其表达作用机制及为研究预防和治疗子宫癌奠定基础。
人乳头瘤病毒HPV;真核表达;Hela细胞
本文从HeLa细胞中克隆扩增出E6蛋白(HPV 18 E 6)编码基因及其突变体HPV 18 E6 F49R、HPV 18 E6 F127R编码基因,将其和真核载体pcDNA 3.1(+)连接,成功构建pcDNA 3.1(+)/ E6、pcDNA 3.1(+)/E6 F49R、pcDNA 3.1(+)/E6 F127R真核重组表达质粒,并转染到HPV阳性细胞系HeLa中表达观察,为进一步研究HPV 18 E6及其突变体E6 F49R和E6 F127R作用机制及子宫癌的预防和治疗奠定基础。
1 材料
人子宫颈癌细胞HeLa(本实验室保存),大肠杆菌DH5 α,真核表达空载体pcDNA-3.1(+)质粒(本实验室保存)。克隆载体pMD 18-T(宝生物)。TRIzol试剂(美国MD公司),反转录试剂盒(Fermentas公司),pMD-18 T、Taq DNA 聚合酶(宝生物),琼脂糖(Biowest公司),DEPC(Invitrogen公司),限制性内切酶、T4 DNA连接酶(宝生物),2×TaqMasterMix、质粒抽提试剂盒、胶回收试剂盒、DNA产物纯化试剂盒(TIANGEN,北京),抗生素(AMRESCO)。常规化学试剂(国药集团上海化学试剂公司)。脂质体转染试剂(购自Invitrogen公司;胎牛血清(FBS);RPMI-1640培养基(Gibco产品)。倒置显微镜(重庆光学仪器厂),CO2组织培养箱(Thermo公司)。
2 方法
2.1 HeLa基因组总RNA提取及其cDNA合成 按照反转录试剂盒产品说明书操作,利用Trizol法提取HeLa细胞总RNA,再反转录合成cDNA。
2.2 HPV 18 E6基因的扩增与真核载体构建 以Hela细胞cDNA为模板,利用正向引物(5’-TATGGTACCATGGCGCG CTTTGAGGATC-3’,Kpn I)和反向引物(5’-GGCGAATTCTTATA CTTGTGTTTCTCTGC-3’,EcoRI)进行PCR扩增,条件如下:94℃预变性5 min,94℃变性30 s,55℃复性45 s,72℃延伸50 s,共25个循环后,72℃再延伸5 min;PCR产物胶回收后与pMD-18 T载体连接,转化大肠杆菌后,筛选阳性克隆质粒pMD-E6。将该阳性质粒pMD-E6质粒、pcDNA 3.1真核载体分别经Kpn I和EcoR I双酶切,切胶回收目的片段,并将载体和目的片段连接,转化至DH-5α感受态细胞,涂布平板过夜培养。挑选菌落,摇菌,提取质粒,酶切鉴定,确认目的片段正确插入。然后大量摇菌,制备用于真核载体pcDNA 3.1(+)/E6转染的无菌质粒。
2.3 HPV 18 E6 F49R突变体基因的扩增与真核载体构建取连接T载体的目的基因的阳性克隆质粒 pMD-E6,利用正向引物(5’-TTTGAATTTGCACGTAAAGATTTATTTGTGG)和反向引物(5’-CCACAAATAAATCTTTACGTGCAAATTCAAA)进行重叠PCR扩增,第一轮PCR条件如下:94℃预变性5 min,94℃变性30 s,55℃复性45 s,72℃延伸50 s,共20个循环后,72℃再延伸5 min;PCR产物胶回收后,在pfu酶作用下,进行第二轮PCR扩增,条件如下:94℃预变性5 min,94℃变性30 s,55℃复性45 s,72℃延伸50 s,共8个循环后,72℃再延伸5 min,;接着利用正向引物(5’-TATGGTACCATGGCGCGCTTTGAG GATC-3’,KpnI)和反向引物(5’-GGCGAATTCTTATAC TTGTGTTTCTCTGC-3’,EcoRI)进行第三轮PCR扩增,条件如下:94℃预变性5 min,94℃变性30 s,55℃复性45 s,72℃延伸50 s,共25个循环后,72℃再延伸5 min。PCR产物胶回收后与pMD-18 T载体连接,转化大肠杆菌后,筛选阳性克隆质粒pMD-E6 F49R。将该阳性质粒pMD-E 6 F49R质粒、PCDNA 3.1真核载体分别经Kpn I和EcoR I双酶切,切胶回收目的片段,并将载体和目的片段连接,转化至DH-5 α感受态细胞,涂布平板过夜培养。挑选菌落,摇菌,提取质粒,酶切鉴定,确认目的片段正确插入。然后大量摇菌,制备用于真核载体PCDNA 3.1-E6 F49R转染的无菌质粒。
2.4 HPV18 E6 F127R突变体基因的扩增与真核载体构建 取连接T载体的目的基因的阳性克隆质粒pMD-E6,利用正向引物(5’-GAAAAACGACGACGTCACAACATAGCT)和反向引物(5’-AGCTATGTTGTGACGTCGTCGTTTTTC)进行重叠PCR扩增,三轮PCR条件同上,PCR产物胶回收后与pMD-18 T载体连接,转化大肠杆菌后,筛选阳性克隆质粒pMD-E6 F127R。将该阳性质粒pMD-E6 F127R质粒、pCDNA 3.1真核载体分别经KpnI和EcoRI双酶切,切胶回收目的片段,并将载体和目的片段连接,转化至DH-5α感受态细胞,涂布平板过夜培养。挑选菌落,摇菌,提取质粒,酶切鉴定,确认目的片段正确插入。然后大量摇菌,制备用于真核载体pCDNA 3.1-E6 F127R转染的无菌质粒。
2.5 细胞的复苏培养 用常规复苏方法复苏细胞,10%胎牛血清和RPMI-1640培养基培养细胞。转染前,将含(1.5~5)×104个细胞种植到96孔板中,不加抗生素,转染时保证细胞覆盖率达90%~95%。
2.6 重组质粒转染细胞 参照Invitogen公司梭华转染试剂说明进行转染。转染实验分为4组,分别为阴性对照组(转染空载真核质粒pcDNA 3.1(+)),实验组pcDNA 3.1(+)/HPV 18 E6转染组、pcDNA 3.1(+)/E6 F49R转染组、pcDNA 3.1(+)/ E6 F127R转染组,每组设5个复孔;每孔加人15µL转染复合物(0.15µg质粒溶于转染试剂中),将96孔板放于37℃、5% CO2细胞培养箱中孵育,转染48 h后进行检测分析。
2.7 MTT法观察重组质粒转染对肿瘤细胞活力的影响配置MTT溶液过滤除菌后4℃保存。转染及测定均于96孔培养板中进行,转染48 h后,每孔加入20µL MTT母液,置于37℃CO2组织培养箱孵育4 h后,弃去孔板上清,加入150µL DMSO溶解,摇晃10 min后,待其充分混匀,酶标仪检测490 nm处的吸光度值。本实验抑制率=1-转染重组质粒实验组/转染空载对照组OD,OD值以“x±s”表示,采用统计学方法卡方检验分析。
2.8 RT-PCR检测转染细胞中HPV 18 E 6 mRNA水平 采用Trizol法提取HeLa细胞总RNA。孔板培养细胞贴壁率约为80%~90%左右时,加入1 mL冰冷的Trizol,于室温放置5 min,加人0.2 mL氯仿,用枪头吹打混匀,冰浴中放置2 min,于4度以12000 r/min离心15 min;小心地将上层水相转移到一个新的离心管中,加入等体积的异丙醇,混和后在冰浴中放置10 min;于4℃以12000 r/min离心10 min,小心地尽可能去除全部上清液;用1 mL 75%的乙醇洗涤沉淀和管壁,7500 r/min离心5 min,去除乙醇后将RNA室温放置干燥5~10 min,用RNA-free DEPC水将所提取的RNA溶解。提取的RNA按照反转录试剂盒说明,反转录mRNA合成cDNA。
2.9 AO/EB荧光染色法测定重组质粒诱导细胞的凋亡 取处于指数生长期的HeLa细胞,加入适量0.25%胰酶消化,用含10%胎牛血清的1640培养液配成悬液,用血球细胞板计数,配成2×105/mL,取放有盖玻片的6孔细胞培养板,每孔加细胞悬液2 mL,将细胞板放在37℃,含5%CO2的培养箱中分别孵育18 h后取出。将各种重组质粒分别加入各孔中,再将细胞板放在37℃,含5%CO2的培养箱中分别孵育48 h后取出细胞培养板。取出载玻片,加1滴混合荧光色液:100µg/mL吖啶橙(AO)和100µg/ mL嗅乙啶(EB)混匀,压上爬满细胞的盖玻片,荧光显微镜下观察凋亡细胞形态。
2.10 生长曲线绘制 将pcDNA 3.1(+)/HPV 18 E 6、pcDNA 3.1(+)/E6 F 49 R、pcDNA 3.1(+)/E6 F 127 R重组质粒的阳性克隆细胞、pcDNA 3.1(+)空白质粒转染的HeLa细胞及未转染的HeLa细胞调整细胞数为2×105个细胞数接种于24孔板内,补足培养基1 mL/孔,37度,5% CO2孵箱中培养。每隔24 h消化细胞计数,每次每种细胞计数3孔,取3孔细胞的平均数,共检测6 d,以细胞数为纵坐标,培养间隔时间为横坐标,绘制生长曲线。
2.11 统计学方法 数据处理采用SPSS 19.0软件,正态计量资料以“x±s”表示,组间比较采用t检验,对于由不同观察时间点构成的多组数据,采用两因素方差分析,定义P<0.05具有统计学意义。
3 结果
3.1 HPV 18 E6编码基因的扩增 本研究采用试剂盒法提取HeLa细胞总DNA,并以其为模板进行PCR扩增,得到1条约477 bp的清晰条带(见图1)。将纯化的PCR产物连接到pMD-18T载体,转化至大肠杆菌DH-5α感受态细胞中,随机挑取5个单克隆鉴定菌液PCR。经PCR扩增后在近500 bp处出现与目标基因大小(477 bp)相符的条带,可能为阳性克隆;酶切鉴定和测序结果表明所扩增的产物符合要求(见图2)。

图1 HPV 18 E6基因PCRMaker.DNA maker IV;1.HPV 18 E6基因PCR结果Fig.1 PCR of HPV 18 E6Maker.DNA maker IV;1.PCR of HPV 18 E6

图3 PMD-18 T-E6-F49R、PMD-18 T-E6-F127R双酶切鉴定结果Maker.DNA Maker IV;1.PMD-18 T-E6-F49R双酶切鉴定结果;2.PMD-18 T-E6 F127R双酶切鉴定结果Fig.3 Double digestion of PMD-18 T-E6-F49R and PMD-18 T-E6-F127RMaker.DNA Maker IV;1.Double digestion of PMD-18 T-E6-F49R;2.Double digestion of PMD-18 T-E6-F127R
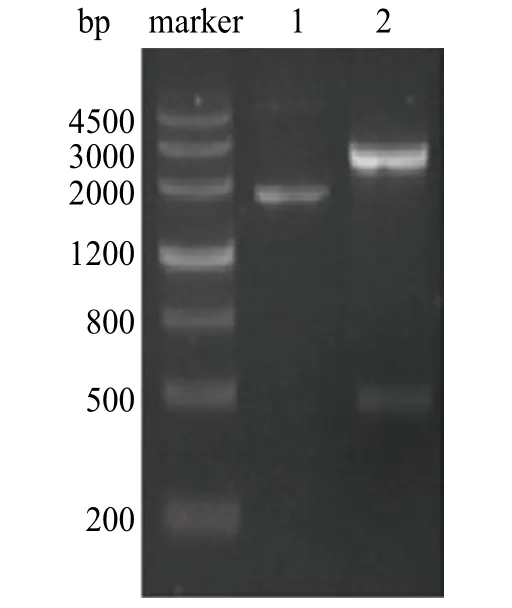
图2 PMD-18 T-E6质粒双酶切鉴定结果Maker.DNA Maker IV;1.PMD-18 T-E6重组质粒;2.PMD-18 T-E6重组质粒双酶切结果Fig.2 Double digestion of PMD-18 T-E6Maker.DNA Maker IV;1.PMD-18 T-E6;2.Double digestion of PMD-18 T-E6
3.2 HPV 18 E6 F49R、HPV 18 E6 F127R突变体编码基因的扩增 采用重叠PCR方法,以阳性pMD-E6质粒为模板,进行三轮PCR扩增后,得到约477 bp的清晰条带。将纯化的PCR产物连接到pMD-18 T载体,转化至DH-5 α中,酶切鉴定和测序结果表明所克隆的产物符合要求(见图3)。
3.3 重组质粒pcDNA 3.1-E6、pcDNA 3.1-E6F49R、pcDNA 3.1-E6F127R的构建 载体pcDNA 3.1和克隆质粒pMD-E 6、pMD-E6F49R、pMD-E6F127R分别用Kpn I和EcoR I双酶切后连接、转化E.coli DH5α,对重组质粒菌液PCR及酶切鉴定。结果显示:PCR扩增得到目标条带,双酶切的两条带分别与载体和目的片段大小相符,测序结果也表明成功地构建了pcDNA3.1-E6、pcDNA3.1-E6F49R、pcDNA3.1-E6F127R重组质粒。
3.4 pcDNA 3.1-E6、pcDNA 3.1-E6 F49R、pcDNA 3.1-E6 F127R重组质粒在HeLa细胞中的表达及MTT实验 利用梭华转染试剂,将重组质粒分别转化到HeLa细胞系,培养48 h后,进行MTT试验。由表1可知:pcDNA 3.1-E6重组质粒对HeLa细胞有一定的生长促进作用,pcDNA 3.1-E6 F49R、pcDNA 3.1-E6 F127R重组质粒对HeLa细胞生长均有一定程度的抑制作用。pcDNA 3.1-E6 F49R重组质粒基本上可以达到对于EC 109细胞半数抑制程度(见表1)。由表1可知,不同重组质粒在48 h对HeLa细胞抑制作用不同。E6对HeLa细胞基本没有抑制作用,反而一定程度上促进细胞的生长,HPV 18 E6 F49R和HPV 18 E6 F127R对HeLa细胞有一定的生长抑制作用,具有统计学意义(P<0.05)。

表1 重组质粒对HeLa细胞生长的抑制作用(n=4)Tab.1 The effects on proliferation of cervical carcinoma cell line Hela transfected with the recombinant plasmids(n=4)
3.5 重组质粒在HeLa细胞内的表达 RT-PCR琼脂糖电泳结果见图组中均在300 bp左右有一条条带,与内参β-actin大小一致,阴性对照组:pcDNA 3.1(+)空质粒转染组细胞在约500 bp处有很淡的条带,那是因为HeLa细胞内源性E6有表达。而实验组:pcDNA 3.1(+)/HPV 18 E6、pcDNA 3.1(+)/ E6 F49R、pcDNA 3.1(+)/E6 F127R转染组在约500 bp处有一明显较亮条带,大小与之相符合(见图4)。实验组相对于阴性对照组条带明显要量很多,表达量明显变高,可见阴性对照组只表达内源性E6蛋白,而转染组里面成功转染了对应质粒,使细胞不仅表达内源性E6蛋白,同时表达外源性E6蛋白,E6蛋白表达量明显升高。

图4 RT-PCR产物琼脂糖电泳M.1 Kb DNA ladder;1.pcDNA 3.1(+)/HPV 18 E6转染组;2.pcDNA 3.1(+)/ E6 F49R转染组;3.pcDNA 3.1(+)/E6 F127R转染组;4.pcDNA 3.1(+)空载转染阴性对照组Fig.4 RT-PCR products of E6 by agarose gel electrophores1.RT-PCR of E6 in HeLa which was transfected with pcDNA 3.1(+)/ HPV 18 E6;2.transfected with pcDNA 3.1(+)/E6 F49R;3.transfected with pcDNA 3.1(+)/E6 F127R;4.negative control:transfected with pcDNA 3.1(+)
3.6 AO/EB双染荧光显微镜下观察结果 荧光显微镜下观察阴性对照组无明显凋亡细胞。阴性对照组:转染了pcDNA 3.1(+)空载质粒的细胞,细胞呈正常的多边形,细胞膜完整,整个细胞显现绿色(见图5 a)。pcDNA 3.1(+)/ HPV 18 E6转染组没有抑制HeLa细胞的生长,细胞呈现绿色(见图5 b)。pcDNA 3.1(+)/E6 F49R转染组了显示了早期凋亡细胞的现象,细胞核出现固缩,细胞形状不规则(见图5 c)。pcDNA 3.1(+)/E6 F127R转染组表现为细胞核为AO染色呈黄绿色荧光,浓聚成颗粒状,位于细胞的一侧,表现出早期凋亡现象(见图5 d)。

图5 细胞AO/EB双染荧光图Fig.5 Cell slide stained with AO and EB
3.7 转染细胞生长曲线的绘制 分别对成功转染重组质粒的阳性克隆细胞、阴性对照和空白对照组细胞绘制生长曲线(见图6)。用方差分析比较每组细胞每天的细胞计数均值,结果表明:转染pcDNA 3.1(+)/HPV 18 E6基因的HeLa细胞的生长速度比pcDNA 3.1(+)/HeLa阴性对照组明显加快,而转染pcDNA 3.1(+)/E6 F49R、pcDNA 3.1(+)/E6 F127R质粒的HeLa细胞较阴性对照组有一定程度的抑制作用,且在第四、五、六天呈现显著性差异(P<0.01)。
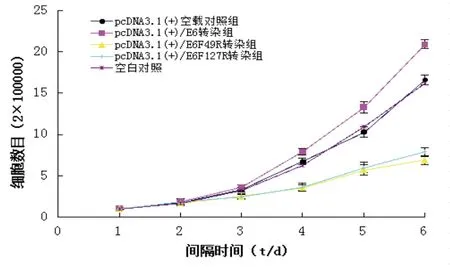
图6 转染细胞生长曲线图Fig.6 Growth curves of transfection cell
4 讨论
人类乳头瘤病毒(HPV)是一种具有种属特异性的嗜上皮病毒,属双链闭环的小DNA病毒,包含约8000个碱基,其中包括8个早期开放读码框架(E1-E8)、2个晚期读码框架和1个非编码长控区[7]。根据HPV的基因和致癌潜力加以划分,目前已知的HPV类型有100多种,其中HPV 16和HPV 18是高致癌性,与宫颈癌息息相关[8]。在HPV早期开放读码框架中,E6和E7基因对细胞生长刺激最为重要,其编码的E6、E7蛋白与宿主细胞内广泛存在的PDZ结构域相互作用,营造一种适合其转化、增殖的体内环境,可引起宫颈上皮细胞永生化,从而引起一系列的疾病,甚至诱导肿瘤的发生。而E6蛋白是参与细胞恶性转化的主要蛋白[9-10]。
HPV E6蛋白大约由160个氨基酸组成,含有两处Cys-X-X-Cys的锌指结构序列,即锌指结构一区和锌指结构二区,它在E6蛋白结合宿主细胞和锌的转化过程中发挥着重要的作用[11]。正常体内,E6-AP作为一种泛素连接酶,不与p53蛋白结合,若机体感染了高危型HPV,E6蛋白可同时与E 6-AP、p53蛋白通过锌指结构及PDZ结构域相互作用,结合成三聚体复合物,导致p53受26 S泛素化蛋白酶体作用而被降解[12]。同时高危型HPV E6蛋白通过E 6-AP搭桥作用,促进其他相关抑癌蛋白p73、HDLG、MAG1-1、MUPP-1蛋白的降解[13]。而p53作为一种极其重要的抑癌蛋白,在肿瘤的抑制作用上发挥着重要作用。当p53等一系列抑癌蛋白被降解后,高危型HPV E6可破坏细胞骨架和细胞间紧密连接,致使细胞极性丢失,产生肿瘤细胞的浸润和转移的表型[14]。
根据文献报道[5]的研究,将HPV 16第47位氨基酸由精氨酸(F)突变为苯丙氨酸(R),可以在一定程度上有效的抑制HPV阳性人子宫颈癌Hela细胞的增殖,表明该突变体HPV 16 E6 F47R将具有桥梁作用的锌指结构一区突变,可能在一定程度上抑制了E6、E6-AP和p53的相互作用结合,从而抑制内源性E6的p53降解活性,激活依赖p53的生长停滞和凋亡功能,选择性地诱导HPV阳性细胞系的生长抑制现象,从而诱导癌细胞衰亡。
目前研究的比较多且透彻的类型是HPV 16,而对于同样高致癌性的HPV 18报道甚少。鉴于HPV 18和16型有着很大的相似性和同源性,实验创新性地考虑同样在HPV 18 E6锌指结构一区和锌指结构二区内构建点突变体(HPV 18 E6 F49R和HPV 18 E6 F127R),检测其对宫颈癌HeLa细胞生长增殖的抑制作用情况,是一种新的探索宫颈癌的防治方式,具有创新性和可实施性。试验将构建成功的突变重组质粒pcDNA 3.1(+)-E6 F49R、pcDNA 3.1(+)-E6 F127R成功转染到HeLa细胞中,通过最初的MTT试验,发现成功转染48 h后,与转染空载的对照组比较,突变组细胞抑制率约为25%左右,而野生型pcDNA 3.1(+)-E6转染组几乎没有抑制效果。对检测成功表达转染质粒的细胞的荧光染色发现:转染了两种突变质粒的细胞均出现细胞核皱缩、细胞变圆的早期凋亡特征;而转染野生型E6的细胞相对于空载转染组,细胞生长没有受到抑制;结果可视化地表明成功转染的突变体对HeLa细胞有一定的抑制作用,而野生型E6没有明显作用。为了更加明确的判断转染质粒对细胞的长期作用情况,实验设计在6天内检测转染细胞的生长数目,并绘制生长曲线,结果表明在培养的第3天后,突变体转染组相比较空载转染组和空白转染组,细胞增殖速率呈明显的下降趋势(P<0.01)。空白对照组和空载对照组没有明显区别,说明转染空载体的细胞生长并没有受到明显影响。野生型E6转染组在第4天开始呈一定的上升趋势,可见野生型重组质粒pcDNA 3.1(+) HPV 18 E6转染进细胞后在一定程度上促进细胞的增殖。综合以上实验结果发现:成功构建并转染进细胞的HPV 18 E6 F49R和HPV 18 E6 F127R突变质粒能一定程度上抑制肿瘤细胞HeLa的增殖,可能与其锌指结构突变,导致E6和宿主PDZ结构域作用减弱,抑制p53的降解,激活机体的免疫监视作用息息相关。而野生型E6转染组相反能缓慢促进细胞的增殖,可能与其E6蛋白通过其锌指结构发挥作用,促进E6-AP、p53、E6的相互绑定作用,从而进一步促进p53降解,导致细胞持续增殖有关。当然这种机制只是一种猜想,而其中涉及到的具体的分子机制还需要实验进一步去探索和发现,这是实验未涉及的不足之处。
本研究中将HPV 18 E6 F49R和HPV 18 E6 F127R突变体分别与真核载体pcDNA 3.1重组,构建了pcDNA 3.1-E6 F49R、pcDNA 3.1-E6 F127R真核重组质粒,并成功转染到癌细胞中进行观察,初步探索了HPV 18 E6的点突变体具有一定的抑癌作用,为宫颈癌的防治提供了一条全新的思路。然而要想将其开发成为一种新型的宫颈癌检测、防治手段,还需要对其中所涉及到的可能的分子学机制和生物学功能进行进一步的探索和研究。
目前HPV检测对于宫颈癌、宫颈癌前病变及癌症治疗后的筛查及监测具有重要的意义。因此,对HPV的深入研究有利于我们更进一步的了解宫颈癌的生物学行为,为宫颈癌防治提供有效的策略[15]。本研究为进一步研究HPV 18 E6蛋白分子作用机及研究预防和治疗子宫癌提供一定的基础。
[1] Niladri G,Suraj PP.Human papillomavirus E6 and E7 oncoproteins as risk factors for tumorigenesis[J].Biosci,2009,34(1):113-123.
[2] O.del Moral-Herna′ndez,et al.The HPV-16 E 7 oncoprotein is expressed mainly from the unspliced E 6/E 7 transcript in cervical carcinoma C 33-A cells[J]. Arch Virol,2010,155(12):1959-1970.
[3] Faridi,Amreen Z,Khalida K,et al.Oncogenic potential of Human Papillomavirus and its relation with cervical cancer[J].Virology Journal,2011(8):269.
[4] Gaělle B,Caroline H,Davy VB,et al.Human Papillomavirus E6 and E 7 Oncogenes[J].The International Journal of Biochemistry and Cell Biology,2007,39(11):2006-2011.
[5] Ristriani T,Fournane S,Orfanoudakis G,et al.A single-codon mutation converts HPV 16 E 6 oncoprotein into a potential tumor suppressor,which induces p 53-dependent senescence of HPV-positive HeLa cervical cancer cells[J]. Oncogene,2009(28):762-772.
[6] 殷广洁,罗兵,王言奎,等.靶向HPV 18 E6基因不同锌指结构编码序列的siRNA对宫颈癌HeLa细胞作用的比较[J].青岛大学医学院学报,2008,44(3):200-204.
[7] Raffaella G,Rosita A.The biological properties of E 6 and E 7 oncoproteins from human papillomaviruses[J].Virus Genes,2010(40):1-13.
[8] Yves N,Murielle M.Structural and Functional Analysis of E 6 Oncoprotein:Insights in the Molecular Pathways of Human Papillomavirus-Mediated Pathogenesis[J]. Molecular Cell,2006,3(21):665-678.
[9] Ingeborg Z,Hava L,Ashley W,et al.Rare human papillomavirus 16 E 6 variants reveal significant oncogenic potential[J].Molecular Cancer,2011,10(24):77.
[10] Rabia F.Oncogenic potential of Human Papillomavirus(HPV) and its relation with cervical cancer[J].Virology Journal,2011,8(1):269.
[11] 胡斯奇,高友鹤.高危型HPV E6蛋白与宿主PDZ蛋白互相作用的研究进展[J].微生物免疫学进展,2009,37(2):79-81.
[12] 许洁.HPV致宫颈癌的机制研究及防治策略[J].实用医学杂志,2011,27(4):714-715.
[13] Sivapriya R,Tufail R,Hokayem JE,et al.Overexpression of ligase defective E 6-associated protein E 6-AP Results in mammary tumorigenesis[J].Breast Cancer Res Treat,2011(9):12-25.
[14] Vjekoslav T.The stability of the human papillomavirus E 6 oncoprotein is E6 AP dependent[J].Virology,2009(393):7-10.
[15] Liao SJ,Wang SX.Production and verification of human papillomavirus type 18 vaccine in vitro[J].Oncology Reports,2008(20):211-217.
Mutation of HPV 18 E6 inhibits the growth of Hela cells and induces apoptosis
ZUO Li-jun,WU Bao-jie,LIU Fei,WU Yan-wen,FAN Li-qiang△
(State Key Laboratory of Bioreactor Engineering,East China University of Science and Technology,Shanghai 200237,China)
ObjectiveTo construct pcDNA 3.1(+)/HPV 18 E 6 fusion gene and a single-codon mutation pcDNA 3.1(+)/E6 F49R or pcDNA 3.1(+)/E6 F127R fusion gene in eukaryotic expression vector and study the effects on proliferation and apoptosis of cervical carcinoma cell line Hela。MethodHPV 18 E6 gene sequence and the single-point mutation HPV 18 E6 F49R or HPV 18 E6 F127R were ampli fi ed from total RNA of Hela cell line by reverse transcription- polymerase chain reaction ( RT- PCR), then the gene sequences were respectively inserted into pcDNA 3.1(+) vector to reconstruct recombinant plasmids which were transfected transiently into Hela cells. MTT and RT-PCR were used to test the expression levels of HPV 18 E6 and the growth of HeLa cells after transfected about 48 h. The proliferation and apoptosis of Hela cells were detected respectively by cell counting and AO/EB fl uorescent vital staining。ResultsThe pcDNA 3.1(+)/HPV 18 E6, pcDNA 3.1(+)/E6 F49R and pcDNA 3.1(+)/E6 F127R eukaryotic expression vectors were successfully constructed. The gene of HPV 18 E6 was discriminably detected in the HeLa cells which were transfected with the recombinant plasmids. After several days, the proliferation of Hela cells transfected with pcDNA 3.1(+)/ E6 F49R or pcDNA 3.1(+)/E6 F127R plasmid were obviously inhibited and the apoptotic rates were signi fi cantly increased, then the proliferation of cells transfected with pcDNA(+)/HPV 18 E6 was rather increased slightly, and we could observe the phenomena of early apoptosis and the formation of thekaryopyknosis by fl uorescent microscope in the cells transfected with pcDNA 3.1(+)/E6 F49R or pcDNA 3.1(+)/E6 F127R。ConclusionThe eukaryotic expressing vectors encoding HPV 18 E6 F49R and HPV 18 E6 F127R provide fundamental basis for the further study on HPV 18 E6 mechanism as well as prevention and treatment of uterine cancer.
human papillomavirus; eukaryotic expression; Hela cell
Q 78
A
1005-1678(2014)01-0051-05
宫颈癌是最常见的妇科恶性肿瘤之一,严重威胁着女性的健康。人乳头瘤病毒(human papillomavirus,HPV)是导致宫颈癌的罪魁祸首,它与宫颈癌的发生、发展及恶性表型有密切联系。研究证实,高危型HPV的感染,尤其是HPV 16、18型,90%以上与宫颈癌有关,而低危型HPV引起的尖锐湿疣、食道癌等仍是常见的疾病[1]。E6、E7蛋白是HPV的主要致癌转化蛋白。E6蛋白可通过与p 53结合使其功能失活、激活端粒酶、破坏细胞黏附、极性和上皮分化等方式参与诱导细胞增殖、永生化和转化等过程,逃避宿主免疫监视[2],也可结合在肿瘤坏死因子受体上,使细胞不受控制的增殖[3]。
体外表达的E6蛋白主要是两个锌指结构,研究结果[4]显示,锌指一区和锌指二区都是病毒转化活性和引起蛋白反式激活所必须的,均与蛋间的相互作用有关。有文献[5]报道,HPV-16 E6的点突变体——HPV 16 E6 F47R是p53聚泛素化降解的缺陷突变体,能感应早期的细胞衰老,选择性地诱导HPV阳性HeLa细胞的生长抑制,可能是一种潜在的抗HPV感染的肿瘤药物。另有文献[6]报道,HPV 18 E6的两个锌指结构区域中,锌指结构二区的突变可能比锌指结构一区的突变,抑制肿瘤细胞无限增殖的效果更明显。HPV 18型和16型有着很高的相似度,故实验尝试同样在HPV 18 E6进行相应的点突变——HPV 18 E6 F49R和HPV 18 E6 F127R的这项研究,为宫颈癌抑癌方式的探究提供了一条新线索。
左丽君,女,硕士,E-mail:adtszlj 1115@126.com;范立强,通信作者,女,副教授,E-mail:fanglq@ecust.edu.cn。

