静脉输注人免疫球蛋白G对慢性不可预料应激模型大鼠的影响
王晟,徐丽芳
(深圳市精神卫生中心 深圳市心理健康重点实验室,广东 深圳 518020)
静脉输注人免疫球蛋白G对慢性不可预料应激模型大鼠的影响
王晟,徐丽芳
(深圳市精神卫生中心 深圳市心理健康重点实验室,广东 深圳 518020)
目的探讨静脉输注免疫球蛋白(GIVIG)对慢性不可预料应激抑郁模型大鼠的影响。方法慢性不可预料应激造模大鼠,分为IVIG+应激组(IVIG组,n=6)和单纯应激组(CUS组,n=6),采用糖水偏好实验、强迫游泳实验和BrdU标记检测海马齿状回神经元再生,分析IVIG对抑郁模型大鼠的作用。结果IVIG组大鼠糖水偏好消耗显著大于CUS组(P<0.01);强迫游泳实验IVIG组不动时间显著小于CUS组(P<0.01);IVIG组海马区域BrdU阳性细胞数对比CUS组阳性细胞个数具有显著差异(P<0.01)。结论IVIG具有抗慢性不可预料应激造成的抑郁症状,其作用可能是通过消减循环炎性细胞因子发挥作用。
免疫球蛋白G;抑郁;海马
免疫球蛋白G(immunoglobulin G,IgG)是体液免疫应答中发挥免疫功能的最主要免疫分子,其结构由两条重链和两条轻链组成。根据重链的不同,免疫球蛋白可分为IgM、IgG、IgA、IgD和IgE五种。其中IgG含量最丰富。蛋白质水解实验显示分泌型免疫球蛋白可分为含有抗原结合位点的Fab段和含有补体Fc受体结合位点的Fc段。Fc受体在很多免疫效应细胞中表达,如单核细胞、中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、肥大细胞、NK细胞、B细胞、T细胞和组织巨噬细胞。免疫球蛋白通过Fc段和Fc受体结合,介导多种免疫反应,包括噬菌作用、抗体依赖细胞介导的细胞毒性作用、炎性介质的释放以及对B细胞活化和抗体产生的调节作用[1]。
一直以来,大脑被视为免疫豁免器官,然而国外多家研究机构发现免疫球蛋白G在中枢神经系统中存在表达[2-5],并发现它参与了多种神经系统疾病的病理反应机制,进一步显示免疫球蛋白G可能在神经系统中发挥独特病理生理作用。我们结合慢性不可预料应激造抑郁模型,探索免疫球蛋白在调节大脑海马神经元再生、可塑性方面的病理生理机制,有助于情绪应激的预防、诊断以及治疗。
近年来,原位杂交,PCR和免疫荧光均显示神经元表达免疫球蛋白G[2];然而,神经元表达IgG的生物学功能尚不清楚。与此同时,国外研究者也发现,多种动物大脑内存在免疫球蛋白G表达[3]。关于IgG在神经元的功能,有文献报道具有保护神经元的作用,能够通过调节小胶质细胞的TNFα表达从而起到保护神经元的作用[6-10]。有研究表明:给予大鼠氟哌啶醇可以减少脑内神经元的IgG免疫活性[5],显示神经元表达免疫球蛋白G可能参与调控与情绪应激、精神障碍(psychosis)以及认知等相关的大脑功能。因此,我们将运用静脉给与IgG来观察其对神经精神系统的调节作用。
1 材料
1.1 实验动物 成年Sprague-Dawley雄性大鼠(SPF级,300~350 g),由汕头大学医学院实验动物中心[合格证号:SCXK(京)2011-0011]提供。实验动物于本院动物中心屏蔽环境饲养,环境温度21℃,光照时间为上午8点至下午8点。
1.2 试剂 5-溴脱氧尿嘧啶核苷(BrdU,Roche);人免疫球蛋白冻干粉(广东卫伦生物制药有限公司,国药准字:S 19993059);BrdU抗体(Sigma,美国);HRP标记山羊抗大鼠IgG二抗(Rockland,美国)。
2 方法
2.1 大鼠慢性不可预料应激模型(chronic unpredictablestress)
实验动物随机分为应激+IVIG组(6只,IVIG组),应激+生理盐水组(6只,CUS组)。慢性不可预料应激造模方法参考Goshen I等[15](见表1)。
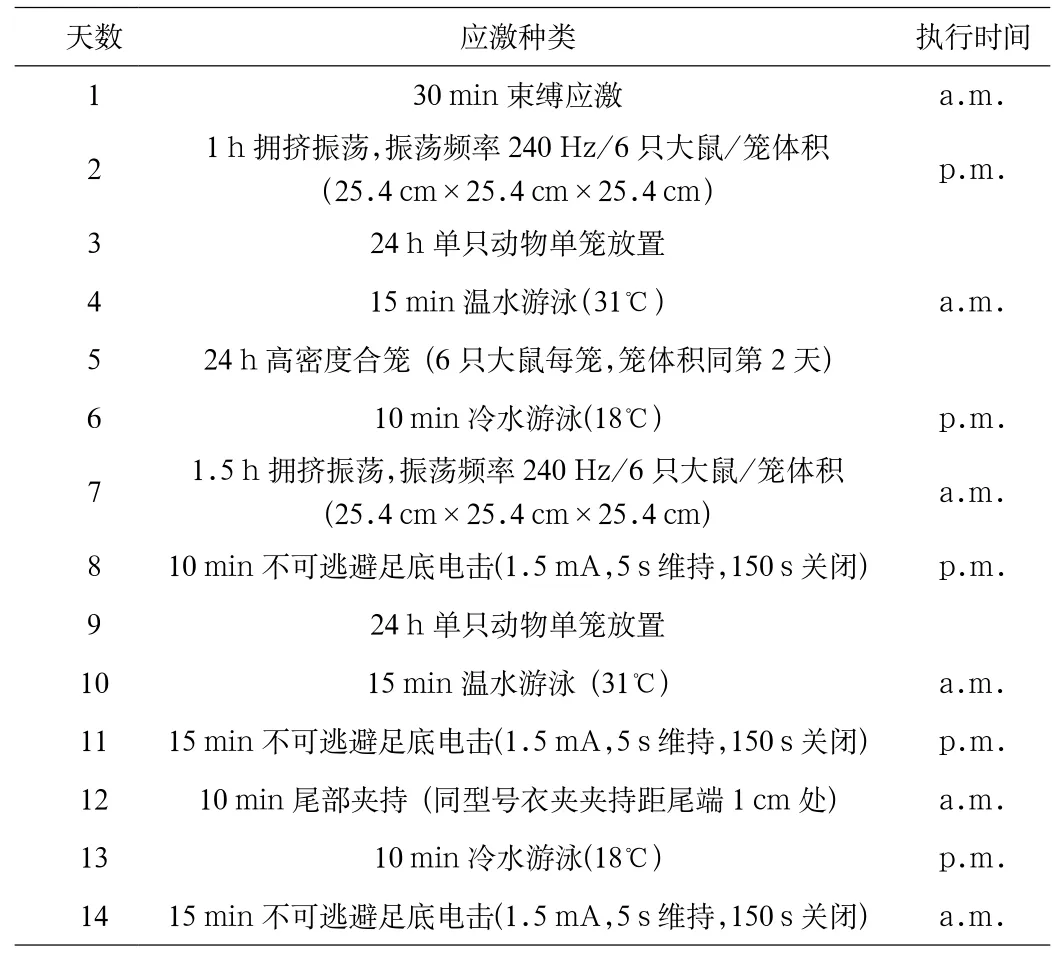
表1 慢性不可预料应激模型Tab. 1 Chronic unpredictable stress
2.2 静脉输注人免疫球蛋白(IVIG) 人免疫球蛋白冻干粉浓度按照Arumugam[6]所述,使用生理盐水配制成5%溶液,按照2 g/kg进行尾静脉注射。注射前将鼠尾采用75%乙醇温润,使大鼠尾静脉充分暴露,于大鼠固定器上完成注射。对照组注射相同体积的生理盐水。完成注射后进行上述应激步骤。
2.3 蔗糖偏好实验 作为慢性不可预料模型的检测重要指标,抑郁模型大鼠伴随有强烈的糖水摄入消耗量的减少。实验前一天对大鼠进行24 h饮水限制,20∶00进行糖水摄取量测试,每只大鼠单笼放置,每笼配备500 mL自来水1瓶,500 mL 1%浓度蔗糖溶液1瓶,放置位置距离笼中线相等。次日8∶00计算糖水摄取量差异。
2.4 强迫游泳实验 采用大鼠水中被动漂浮时间评定大鼠的行为无助水平。具体如下:第1天进行适应性训练,将大鼠放入游泳桶中(桶高60 cm,直径30 cm,桶内水深30 cm,水温25℃),游泳训练时间为15 min。于第2天的同一时间,将大鼠放入强迫游泳桶中,摄像并记录大鼠在5 min内的静止不动(不动状态:大鼠在水中停止挣扎,仅四肢偶尔划动以保持身体漂浮),每只大鼠实验后换水并酒精清洗强迫游泳桶,避免影响后续实验动物。
2.5 大鼠海马齿状回存活新生神经元数量 Brdu腹腔注射(75 mg/kg,每隔2 h 1次,共4次),4周后取脑检测海马齿状回存活新生神经元数量,免疫组化步骤参考抗体说明书完成。
2.6 统计学方法 数据均以“x±s”表示,采用SPSS 13.0软件分析。P<0.05为差异有统计意义。
3 结果
3.1 IVIG对慢性不可预料应激造模各组大鼠糖水消耗量的影响 采用慢性不可预料应激模型大鼠,IVIG组由尾静脉输注人免疫球蛋白G,发现IVIG能显著改善大鼠的糖水消耗量(P<0.01,见图1),提示免疫球蛋白G可能具有减轻抑郁症状的效果。

图1 大鼠糖水测试*P<0.01,与CUS组相比,compared with CUS groupFig.1 Sucorse preference test of rats*P<0.01,Compared with CUS group
3.2 IVIG对慢性不可预料应激各组大鼠强迫游泳不动时间的影响 强迫游泳实验结果显示,各组大鼠在强迫游泳实验中的不动时间差异显著。IVIG组大鼠与CUS组比较,不动时间显著缩短(见图2)。

图2 强迫游泳不动时间对比*P<0.01,与CUS组相比,compared with CUS groupFig.2 Comparison of floating time *P<0.01,compared with CUS group
3.3 IVIG对海马神经元再生(neurogenesis)的影响 取脑检测Brdu阳性神经干细胞个数。结果表明:CUS组大鼠海马神经元BrdU阳性细胞个数明显少于IVIG组大鼠(见图3、图4)。
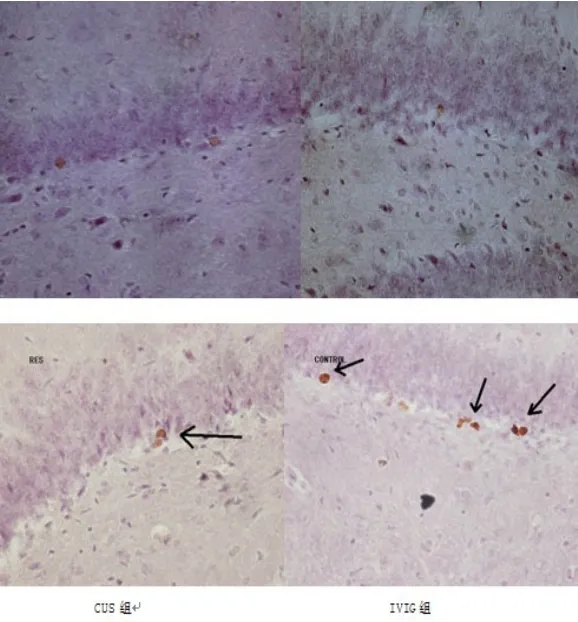
图3 大鼠海马齿状回Brdu染色(CONTROL:CUS组;RES:IVIG组×400,箭头所示为BrdU阳性细胞)Fig.3 Brdu positive cell in DG area of rat hippocampus

图4 海马齿状回神经元再生数量对比*P<0.01,与CUS组相比,compared with CUS groupFig.4 Comparison of neurogenesis in DG area of rat hippocampus *P<0.01,compared with CUS group
4 讨论
IVIG对大脑具有保护作用。研究表明:给予脑缺血小鼠静脉输注人免疫球蛋白G,IgG具有通过清除补体,避免缺血和缺血再灌注所导致的神经元损伤的作用[11]。另有学者采用海马脑片与小胶质细胞培养手段,发现非特异性单体IgG具有增强小胶质细胞的循环胞吞作用,并且可以通过结合小胶质细胞上的Fc受体,促进肿瘤坏死因子-α的释放[12]。我们的研究表明,采用多克隆IgG的抗体中和培养的海马神经元IgG,导致海马神经元释放IL-1 β的增加(未发表数据)。这些提示我们海马部位存在IgG的表达并且与IL-1 β的合成具有相互关系,而IL-1 β则被认为是应激过程中关键的调控因子[13-17]。结合上述文献,IL-1 β升高或者应激状态下,海马的IgG可能存在保护作用。有趣的是,Crow[11]发现临床给予病人静脉输注免疫球蛋白G,可以降低外周循环白介素1 β含量,两者存在拮抗关系。
快感缺乏是重度抑郁的一个核心症状之一。糖水偏好实验则是一个很好的客观指标,表明IVIG可以对抗大鼠抑郁样行为;强迫游泳实验反映出慢性不可预料应激造成大鼠的绝望状态以及严重程度。海马神经元再生受损是抑郁症发生发展的细胞水平病理机制。本研究的结果表明,静脉给予免疫球蛋白G对应激状态下大鼠的抑郁样行为具有保护作用,并且海马神经元再生的维持支持IVIG具有细胞分子基础。该作用有可能是中和外周循环的炎性细胞因子从而发挥作用的,这点则不同于海马自身所表达的IgG作用。炎性细胞因子可以进入血脑屏障从而发挥促抑郁作用,IVIG可能存在消减机体前炎性细胞因子的病理机制,从而提前减弱应激对于海马的损伤,达到对抑郁的治疗作用。IVIG的这一发现可能为应激乃至抑郁的防治提供新的治疗方向和思路。
[1] White DA,Leonard MC.Acute stroke with high-dose intravenous immune globulin[J]. American journal of health-system pharmacy,2007,64(15):1611-1614.
[2] Chen Z,Qiu X,Gu J.Immunoglobulin expression in non-lymphoid lineage and neoplastic cells[J].The American journal of pathology,2009,174(4):1139-1148.
[3] Yoshimi K,Woo M,Son Y,et al.IgG-immunostaining in the intact rabbit brain:variable but significant staining of hippocampal and cerebellar neurons with anti-IgG [J].Brain research,2002,956(1):53-66.
[4] Upender MB,Dunn JA,Wilson SM,et al.Immunoglobulin molecules are present in early‐generated neuronal populations in the rat cerebral cortex and retina[J]. Journal of Comparative Neurology,1997,384(2):271-282.
[5] Goldsmith S.Haloperidol reduces IgG immunoreactivity in the rat brain[J].The International Journal of Neuropsychopharmacology,2002,5(4):309-313.
[6] Arumugam TV,Tang SC,Lathia JD,et al.Intravenous immunoglobulin (IVIG) protects the brain against experimental stroke by preventing complement-mediated neuronal cell death[J].Proc Natl Acad Sci U S A,2007,104(35):14104-14109.
[7] Nanri K,Okita M,et al.Intravenous immunoglobulin therapy for autoantibodypositive cerebellar ataxia[J].Intern Med,2009,48(10):783-790.
[8] Walberer M,Nedelmann M,et al.Intravenous immunoglobulin reduces infarct volume but not edema formation in acute stroke[J].Neuroimmunomodulation,2010,17(2):97-102.
[9] Unkeless,JC,Scigliano,E,Freedman,VH.struture and function of human and murine receptors for IgG [J].Annu Rev Immunol,1988,(6):251-281.
[10] Hulse RE,Swenson WG,Kunkler PE,et al.Monomeric IgG is neuroprotective via enhancing microglial recycling endocytosis and TNF-α[J].The Journal of Neurosc ience,2008,28(47):12199-12211.
[11] Crow AR,Song S,Semple JW,et al.A role for IL-1 receptor antagonist or other cytokines in the acute therapeutic effects of IVIg?[J]. Blood,2007,109(1):155-158.
[12] Frank MG,Baratta MV,Sprunger DB,et al.Microglia serve as a neuroimmune substrate for stress-induced potentiation of CNS pro-inflammatory cytokine responses [J].Brain,behavior and immunity,2007,21(1):47-59.
[13] Eriksson PS,Perfilieva E,Bj¨ork-Eriksson T,et al.Neurogenesis in the adult human hippocampus [J].Nature medicine,1998,4(11):1313-1317.
[14] Wojtowicz JM,Kee N.BrdU assay for neurogenesis in rodents[J].Nature protocols,2006,1(3):1399-1405.
[15] Goshen I,Kreisel T,Ben-Menachem-Zidon O,et al.Brain interleukin-1 mediates chronic stress-induced depression in mice via adrenocortical activation and hippocampal neurogenesis suppression[J].Molecular psychiatry,2007,13(7):717-728.
[16] Norman GJ,Karelina K,Zhang N,et al.Stress and IL-1 β contribute to the development of depressive-like behavior following peripheral nerve injury[J]. Molecular psychiatry,2009,15(4):404-414.
[17] Goshen I,Yirmiya R.Interleukin-1 (IL-1):a central regulator of stress responses [J].Frontiers in neuroendocrinology,2009,30(1):30-45.
Effect of intravenous immunoglobulins G on rat subjected to chronic unpredictable stress
WANG Sheng,XU Li-fang
(Psychological Lab, Mental health center of Shenzhen, Shenzhen 518020, China)
ObjectiveTo investigate the effect of intravenous immunoglobulins G on rat subjected to chronic un-predictable stress。MethodRats were randomly divided into 2 groups (IVIG + stress group and stress-only group). Sucrose preference test, force swim test and neurogenesis analyze were used to analyze the effect of IVIG on rats in stress group。ResultsSucrose consumption in IVIG group was signi fi cantly more than CUS group(P<0.01), while non fl oating time of force swim was signi fi cantly lower than CUS group(P<0.01). The difference of BrdU positive cell number in Hippocampus between two groups was signi fi cant(P<0.01)。ConclusionIVIG show an antidepressant like effect, the mechanism may be involved in eliminate in fl ammatory cytokine of peripheral circulation.
immunoglobulin G; depression; hippocampus
R 749.41
A
1005-1678(2014)01-0032-03
国家自然科学基金资助项目(81102280)
王晟,男,博士,助理研究员,研究方向:神经精神免疫学,Email:shengwang.diamond@gmail.com。

