等离子电切术联合抗雄激素治疗伴膀胱出口梗阻的晚期前列腺癌的疗效观察
刘正清 郭立丽
前列腺癌在全球范围内男性最常见的恶性肿瘤中,位居第二位[1]。前列腺癌的治疗仍然是世界难题,且晚期患者常伴膀胱出口梗阻,加剧排尿困难,造成急性尿潴留[2]。前列腺癌生物学特性较好,一般晚期患者可长期带瘤生存[3]。因此,解除梗阻,减轻患者痛苦并提高生活质量是治疗伴膀胱出口梗阻晚期前列腺癌的关键。目前临床多采用手术治疗、药物治疗或联合治疗。我院对54例伴膀胱出口梗阻的晚期前列腺癌患者采用等离子电切术与间断雄激素药物联合治疗,现报告如下。
1 资料与方法
1.1 一般资料
入选我院2011年1月-2013年4月收治的伴膀胱出口梗阻的晚期前列腺癌患者104例。入选标准:60岁以上男性患者;符合晚期前列腺癌诊断标准[4],且经前列腺癌穿刺活检检查确诊者;均有不同程度的尿路梗阻,尿潴留;根据ASA分级方法评估为Ⅰ~Ⅱ级者;前列腺体积≥30 ml;RU≥60 ml,Qmax≤10 ml/s者;IPSS评分≥18分者;本研究符合伦理委员会要求,签署知情同意者;排除合并严重心、脑、肝、肾及肺部疾病者。所有患者根据入院先后顺序不同分为2组,观察组54例,年龄60~76岁,平均(65.8±3.3)岁;体重指数(BMI)为22~26 kg/m2,平均(24.6±2.2)kg/m2;病程8~29个月,平均(12.2±3.5)个月;根据前列腺腺癌Gleason组织学分级,评分<7分者15例(27.8%),≥7分者39例(72.2%);TNM临床分期:Ⅲ期者30例(55.6%),Ⅳ期者24例(44.4%)。对照组50例,年龄60~78岁,平均(66.2±3.2)岁;BMI为21~26 kg/m2,平均(24.0±2.3)kg/m2;病程10~30个月,平均(12.5±3.4)个月;Gleason组织学分级,评分<7分者12例(24.0%),≥7分者38例(76.0%);TNM临床分期:Ⅲ期者28例(56.0%),Ⅳ期者22例(44.0%)。所有患者直肠指诊前列腺Ⅱ度或Ⅲ度,表面不光滑,质硬,高低不平,且伴有结节。2组患者的年龄、病程、BMI、前列腺体积、RU、IPSS评分、Gleason组织学分级及病理分期等基线特征大体一致。
1.2 方法
所有患者均采用等离子电切术治疗:腰麻联合持续硬膜外麻醉,取患者截石位,使用0.9%生理盐水进行灌洗,插入电切镜,观察患者前列腺情况,切除造成梗阻的组织和浸润组织,切除双侧睾丸,逐步切割至包膜,谨慎处理尖端组织,检查创面,止血,清洗切割下来的组织,反复清洗,检查创面和止血,术后采用三腔导尿管,注水30~40 ml,术后3天内持续冲洗膀胱,5~7 d后拔除导尿管。观察组在此基础上予以抗雄激素联合治疗:术后5~7 d开始口服比卡鲁胺,1次/天,每次1片,疗程12个月。观察并对比2组治疗前后前列腺体积、PSA、IPSS评分、RU、Qmax及QOL评分的改变。
1.3 统计学方法

2 结果
2.1 2组前列腺体积、PSA和IPSS评分比较
2组患者治疗前前列腺体积、PSA和IPSS评分大体一致,经治疗,观察组前列腺体积显著小于对照组,PSA显著低于对照组,IPSS评分显著低于对照组,差异均具有统计学意义(P均<0.05),见表1。
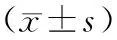
表1 2组患者前列腺体积、PSA、IPSS评分比较
注:*为与对照组比较,P<0.05。
2.2 2组RU和Qmax比较
2组患者治疗前RU和Qmax大体一致,经治疗,观察组RU(29.6±16.4)ml显著低于对照组(46.2±18.3)ml,Qmax(19.2±4.0)ml/s显著高于对照组(16.3±3.8)ml/s,差异均具有统计学意义(P均<0.05),见表2。
2.3 2组QOL比较
2组患者治疗前QOL评分观察组(3.5±1.2)分,与对照组(3.4±1.3)分大体一致(t=0.41,P>0.05)。经治疗,观察组QOL评分(2.2±1.3)分显著低于对照组(2.8±1.4)分,差异具有统计学意义(t=2.27,P<0.05)。
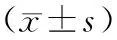
表2 2组患者RU和Qmax比较
注:*为与对照组比较,P<0.05。
3 讨论
前列腺癌是男性肿瘤重要高发病之一。在美国,其发病率高于肺癌,2010年新发前列腺癌患者约有217 730例,死亡病例数达到32 050例[5]。在我国,据2007年上海市疾病预防控制中心统计,前列腺癌发生率是11.81/10万例,在男性恶性肿瘤中位列第五位[6]。老年男性患者高发前列腺癌,新患者年龄中位数是72岁,年龄<39岁的男性发病率为0.005%,40~59岁男性发病率是2.2%,而60~79岁男性发病率高达13.7%[7]。随着我国人口老龄化趋势及饮食结构的改变,我国前列腺癌发病率不断提高。75%~80%的前列腺癌起源自外周带[8],且前列腺癌的早期临床症状和前列腺增生相似,医患不易察觉,且早期就容易出现远期转移和局部扩散,故发现时前列腺癌大多即属于癌症晚期,失去根治时机。前列腺癌晚期时,患者一般合并膀胱出口梗阻,严重影响患者的生活质量。当患者已无根治可能时,此时的治疗目标是解除膀胱出口梗阻,减少患者并发症及尽可能地改善患者生活质量。
等离子电切术是目前对前列腺癌和膀胱癌电切最有效的治疗手段[9]。电切术最大的问题是形成水中毒,止血效果较差,一般要求医生在1 h内完成手术。与过去的常规电切术相比,等离子双极电切术采用生理盐水作为冲洗液,实现动态等离子切割机制[10]。等离子电切术具有以下优势:①相对延长手术时间,避免发生经尿道前列腺穿孔等电切综合征,减少稀释性低钠血症的发生风险,更彻底切除前列腺组织,提高组织切除率和手术安全性。②不受前列腺体积大小的影响和限制,扩大手术适应证,降低手术风险。③缩短术后恢复时间:等离子电切热穿透有限,切面炭化少,较少损伤周围组织,减少术后膀胱刺激症,缩短术后冲洗及留置导管时间,缩短术后恢复时间。④减少术中术后出血量。等离子电切术组织切割面为40 ℃~70 ℃[11],双极回路,低温切割和有限的热穿透有助于减少炭化,减少术中出血和术后焦伽脱落所致再出血。⑤等离子电切术可以提高前列腺偶发癌的检测率,与汽化电切相比,等离子电切双环较小,电切速度相对较慢,切割组织更加细小,无炭化,容易检出偶发癌症。尽管等离子电切术无法改变患者临床结局,但有助于缓解梗阻症状。此外,目前公认雄激素受体(AR)在前列腺癌的发生和发展中起到重要作用[12],抗雄激素治疗有助于提高治疗效果。长期全雄激素阻断治疗可以使绝大多数雄激素依赖性癌症转化为非雄激素依赖性癌,但再次进行抗雄激素治疗效果差,故本研究采用间断雄激素阻断治疗。
本研究发现,观察组治疗后前列腺体积显著小于对照组,PSA、IPSS评分、RU和QOL评分显著低于对照组,Qmax显著高于对照组,差异均具有统计学意义(P均<0.05)。提示等离子电切术与抗雄激素联合治疗膀胱出口梗阻晚期前列腺癌可全面改善临床症状,近期临床疗效确切,期待进一步研究远期临床效果。
[1] Jemal A,Bray F,Center MM,et al.Global cancer statistics〔J〕.CA Cancer J Clin,2011,61(2):69-90.
[2] 王 强,王军起,管同郁,等.合并膀胱出口梗阻的晚期前列腺癌的治疗〔J〕.中华男科学杂志,2013,19(2):184-185.
[3] 伍信阳,毕学成,何慧婵,等.非转移性细胞蛋白1基因在前列腺癌中的表达及临床意义〔J〕.中华实验外科杂志,2013,30(3):587-589.
[4] 冯鲰心,张玲媛.中华医学会泌尿外科学会第六届第二次常委会、《中华泌尿外科杂志》第六届第二次编委会纪要〔J〕.中华泌尿外科杂志,2001,22(8):453-454.
[5] Jemal A,Siegel R,Xu J,et al.Cancer statistics,2010〔J〕.CA Cancer J Clin,2010,60(5):277-300.
[6] 李 鸣,张思维,马建辉,等.中国部分市县前列腺癌发病趋势比较研究〔J〕.中华泌尿外科杂志,2009,30(6):368-370.
[7] Higgins GS,McLaren DB,Kerr GR,et al.Outcome analysis of 300 prostate cancer patients treated with neoadjuvant androgen deprivation and hypofractionated radiotherapy〔J〕.Int J Radiat Oncol Biol Phys,2006,65(4):982-989.
[8] 周 毅,姚 远,杨剑文,等.老年前列腺癌并存代谢综合征患者的临床相关性研究〔J〕.中华老年医学杂志,2014,33(2):172-174.
[9] 汪自力,易 炜,陈 刚,等.经尿道等离子电切联合内分泌治疗晚期前列腺癌导致下尿路梗阻的临床疗效〔J〕.中华腔镜泌尿外科杂志(电子版),2011,5(3):222-224.
[10] Kantoff P.Recent progress in management of advanced pr-ostate cancer〔J〕.Oncology (Williston Park),2005,19(5):631-636.
[11] 杨志刚,张 飞,霍日查,等.经尿道等离子电切联合内分泌治疗伴膀胱出口梗阻晚期前列腺癌的临床观察〔J〕.现代肿瘤医学,2012,20(8):1671-1672.
[12] 张华俊,李月兵,郝建国,等.经尿道等离子电切联合非那雄胺治疗晚期前列腺癌致膀胱出口梗阻的临床价值〔J〕.临床军医杂志,2012,40(3):727-728.

