宫颈癌分段调强放射治疗计划的应用研究
陈文娟 潘建基 柏朋刚 江 楠 张秀春
宫颈癌为我国常见的恶性肿瘤,放射治疗是中晚期宫颈癌的主要治疗手段,其中调强放射治疗技术(intensity modulated radiation therapy,IMRT)是精确放射治疗的重要技术。但宫颈癌治疗期间肿瘤变化程度相对较大,随着内靶区的运动和靶区的明显缩小,致使治疗期间计划靶区及实际靶区不相符,导致精确度下降。本文旨在探讨分段调强放射治疗的必要性、可行性。
1 资料与方法
1.1 一般资料
选择2011年3月至2011年10月间初诊宫颈鳞癌Ⅰb~Ⅲb期患者33例进入本研究。患者中位年龄为 43岁(37~65岁);根据2009年修订后FIGO宫颈癌分期标准,Ⅰb期5例、Ⅱ期13 例、Ⅲ期15例;病理类型均为鳞状细胞癌;KPS>80分。治疗前所有患者血常规、肝肾功能等相关检查均正常,无放化疗禁忌证。患者均签放疗知情同意书。本组均接受2~4个周期的TP(紫杉醇135 mg/m2,DDP 80 mg/m2)同步化疗。21天为1个周期。
1.2 方法
1.2.1 体位 采用仰卧位,双手互握肘关节置头顶,双腿自然并拢,用网状体膜及真空垫,体架固定体位。
1.2.2 CT增强扫描 采用CT-CIM模拟机定位。扫描前60 min排空膀胱,并喝水250 ml,碘过敏试验,证实阴性者给予造影剂90 ml静脉注射,激光灯校对体模3个标记,20 s后开始扫描。扫描范围从隔顶至坐骨结节下缘下5 cm,层厚5 mm。CT图像通过网络传输到Pinnacle治疗计划系统。在前半程治疗基础上30 Gy后行第二程定位CT增强扫描并重新制定后半程治疗计划,同时比较分析30 Gy时肿瘤退缩情况以及危及器官剂量体积变化的影响。
1.2.3 靶区定义 原发灶大体肿瘤体积 (gross tumor volume,GTV)和盆腔肿大淋巴结(GTV node,GTVN)为临床或影像学检查发现的病变范围。临床靶体积(clinical target volume,CTV)包括子宫、宫颈、阴道等原发肿瘤区域及盆腔淋巴引流区(包括宫旁、闭孔、髂内、髂外、骶前、髂总、腹股沟深组)。CTV 的具体勾画是上界在腹主动脉分叉处,下界在闭孔下缘,以实体肿瘤或子宫体、子宫颈或淋巴结为标准或淋巴结的层面以髂总、髂内外动脉为标准,旁开7~10 mm作为前后及左右侧界。靶区在Pinnacle3 8.0工作站进行。
1.2.4 危险器官 (OARS)定义上下界在CTV上下2 cm处,包括小肠、结肠、直肠、膀胱、脊髓、股骨头。
1.2.5 计划设计 在ADAC Pinnacle3 8.0计划系统进行。采用7个共面射野,6 MVX线照射,设野方向均分,处方剂量95%PTV 50.4 Gy,1.8 Gy/次,每周4~5次,共28次。处方剂量规定:PTV为95%等剂量线所包绕;PTV接受>110%的处方剂量的体积<5%;PTV接受<93%的处方剂量的体积<3%;PTV外的任何地方不能出现>110%的处方剂量正常组织。尤其是 GTV 内没有冷点,PTV外没有热点。直肠前壁及膀胱后壁没有剂量热点。外照射结束后予Ir-192腔内放疗‘A’点:DT 21~28 Gy/3~4 F。危及器官限量:直肠V50≤45%,膀胱V50≤45%,小肠V40≤40%,股骨头V50≤5%。髂骨V40<40%。
1.2.6 DVH评价 通过DVH评价同一个患者二程计划中肿瘤体积变化以及膀胱、直肠和小肠接受30 Gy、40 Gy、45 Gy剂量时的容积百分比的改变。
1.3 统计学处理
采用SPSS 16.0统计分析,靶区和OARS剂量分布的分析采用方差分析,显著性检验采用t检验。
2 结果
2.1 体积变化
治疗前及治疗后半程比较,肿瘤靶体积(GTV)分别为(77.39±36.82)cm3、(52.01±30.6)cm3,GTV体积退缩(30.1±8.9)%(P<0.001);临床靶体积(CTV)分别为303.2~718.9 cm3、301.3~630.7 cm3,退缩(7.7±1.1)%,差异均有统计学意义(P<0.05)。
2.2 剂量变化
治疗前、后半程两段计划处方剂量均较好地覆盖了靶区,平均 96.7% 的PTV 接受处方剂量的照射。PTV平均剂量分别为(5024±65.8)cGy;(4993±111.5)cGy,差异无统计学意义(P>0.05)。直肠、膀胱、小肠的处方剂量变化,见表1。
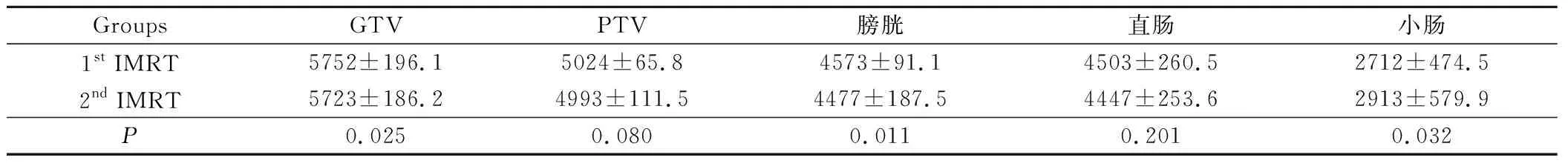
表1 肿瘤靶体积(GTV)、临床靶体积(CTV)和危及器官平均剂量的比较/cGy
2.3 膀胱受照容积的变化
通过DVH图分析调强放疗膀胱、直肠接受30 Gy、40 Gy、45 Gy、50 Gy的容积百分比(表2)。膀胱在前后两段计划中的体积变化没有统计学意义(P=0.1),膀胱在低剂量区V30~V45有明显变化,P<0.05,而高剂量区V50差异无显著性意义。二段计划显示直肠受量及体积差异没有统计学意义(P>0.05)。
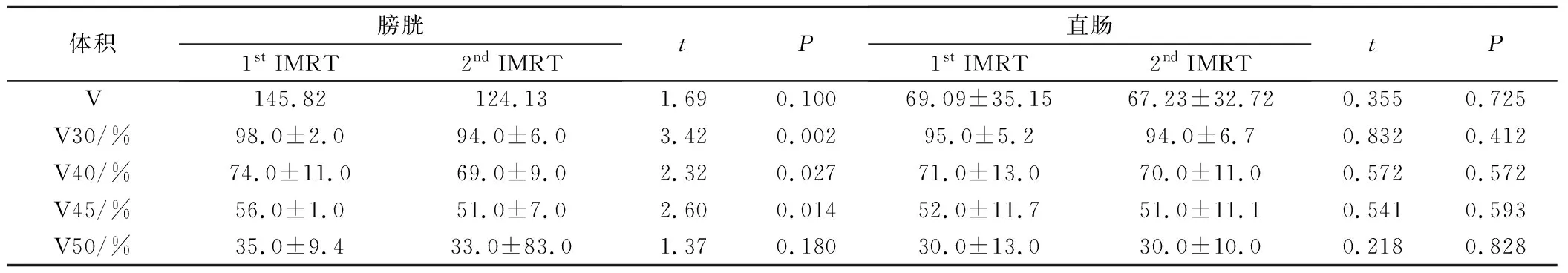
表2 两段放疗计划膀胱、直肠体积与剂量比较。
2.4 小肠受照容积的变化
小肠接受30 Gy、40 Gy、45 Gy的容积百分比(表3),小肠受照体积两段计划比较受量减少,但在低剂量区V30~V40有统计学意义(P<0.05)。表明采用调强放疗低剂量区小肠能得到很好的保护。

表3 两段放疗计划小肠体积与剂量比较
3 讨论
放射治疗是宫颈癌的主要治疗手段[1],其疾病控制率以及放射不良反应发生率均与放射剂量呈正相关。常规放射治疗范围包括了大部分盆腔,照射野中包含了小肠﹑膀胱﹑直肠等危及器官,正常组织受到高剂量照射后可能产生不同程度的急﹑慢性不良反应,尤其是放射性肠炎和膀胱炎,且持续时间长﹑治疗困难,严重影响放射治疗后患者的生活质量,有些严重的并发症甚至限制了传统的放疗技术的实施[2]。
调强放射治疗保证肿瘤靶区得到足量照射的同时有效地保护了周围正常组织,从而提高放射治疗增益比[3],提高肿瘤局部控制率﹑生存率,并改善生存质量。调强放射治疗主要基于治疗前图像资料制定治疗计划,靶区﹑危及器官位置及体积的改变、外轮廓的变化等相关因数在治疗过程中会影响靶区及危及器官的实际剂量分布,宫颈癌治疗期间肿瘤变化程度相对较大,随着内靶区的运动和靶区的明显缩小,致使治疗期间计划靶区及实际靶区不相符合,导致精确度下降。盆腔内靶区的运动、摆位误差等不确定因素,包括直肠、膀胱的充盈程度,肿瘤的消退速度、体重的变化等。此外,由于肿瘤的退缩导致靶区相对增加,危及器官(organ at risk,OAR)进入高剂量照射范围,接受更大的照射剂量,放射损伤几率大大增加[4]。有学者[5]对11例宫颈癌患者治疗前、治疗过程中每周行MRI扫描,据此勾画CTV、OAR范围,制定不同的IMRT计划。结果显示:随着放疗剂量的增加,受照的OAR体积较治疗初期明显增大,在10、20、30、40、45 Gy照射水平下,除膀胱和乙状结肠的V10无明显变化外,其余OAR在各剂量照射水平的受照射体积均明显增加,据此认为及时调整IMRT 计划能有效减少正常组织的照射体积及剂量。研究发现,放疗过程中肿瘤会发生不同程度的缩退,剂量达45 Gy时,肿瘤可缩小50%~80%[6]。Van de Bunt等[7]通过对14例患者研究后发现CTV平均18%与GTV肿瘤平均46%的体积退缩,Tyagi等[8]通过对10例患者研究发现CTV平均20%的体积退缩,结论类似。
Nam 等[9]观察了81例宫颈癌患者放化疗时的肿瘤体积退缩情况,发现治疗4周时同步放化疗者和单纯放疗者的肿瘤退缩率分别为79%和69%。本研究将放疗前与放疗30 Gy(15次)后GTV与CTV进行分析。数据显示GTV肿瘤平均退缩了(30.1±8.9)%,CTV平均退缩了(7.7±1.1)%。直肠、膀胱大于40 Gy的平均体积分别是(68.0±16.0)%、(70.0±13.0)%;(69.0±12.0)%;(66.0±11.0)%。小肠大于35 Gy的平均体积是(32.0±7.0)%;(36.0±1.0)%。小肠大于40 Gy 的平均体积是(22.0±7.0)%;(25.0±8.0)%。小肠受照容积百分比30 Gy、40 Gy、45 Gy两段计划比较受量减少,但在低剂量区V30~V40有统计学意义(P<0.05)。表明采用调强放疗低剂量区小肠能得到很好的保护。膀胱在低剂量区V30~V45有明显变化,P<0.05,而高剂量区变化不大。在30 Gy 以上的高剂量水平,IMRT 危及器官受照体积明显降低。分段计划对正常器官的保护是不容忽视。局部晚期宫颈癌放化疗过程中,应选择适宜的时机进行CT扫描并重新制定放射治疗计划,以减少靶区体积及OAR的受照范围、剂量,从而降低不良反应发生率和严重程度[10-11]。建议对于大体积考虑二次或多次更改治疗计划或考虑适应性放射治疗(adaptive radiotherapy,ART)。
[1] 殷蔚伯,余子豪,徐国镇,等.肿瘤放射治疗学(第四版)〔M〕.北京:中国协和医科大学出版社,2007:1018.
[2] 孔 蕾,于雨华,黄 伟,等.宫颈癌调强放疗新进展〔J〕.中华放射肿瘤学杂志,2006,15 (5):426-428.
[3] Georg D,Kirists C,Hillbrand M,et al.Image-guided radiotherapy for cervix cancer:high-tech external beam therapy versus high-tech brachytherapy〔J〕.Int J Radiat Oncol Biol Phys,2008,71(4):1272-1278.
[4] Assenholt MS,Petersen JB,Nielsen SK,et al.A dose planning study on applicator guided stereotactic IMRT boost in combination with 3D MRI based brachytherapy in locally advanced cervical cancer〔J〕.Acta Oncol,2008,47(7):1337-1343.
[5] Lee CM,Shrieve DC,Gaffney DK.Rapid involution and m-obility of carcinoma of the cervix〔J〕.Int J Radiat Oncol Biol Phys,2004,58(2):625-630.
[6] Munt AJ,Lujan AE,Rotmensch J,et al.Intensity-modulated whole pelvicradiotherapy in women with gynecological malignancies〔J〕.Int J Radiat Oncol Biol Phys,2002,52(5):1330-1337.
[7] Van de Bunt L,van der Heide UA,Ketelaars M,et al.Conventional,conformal,and intensity-modulated radiation therapy treatment planning of external beam radiotherapy for cervical cancer:The impact of tumor regression〔J〕.Int J Radiat Oncol Biol Phys,2006,64(1):189-196.
[8] Tyagi N,Lewis JH,Yashar CM,et al.Daily online cone beam computed tomography to assess interactional motion in patients with intact cervical cancer〔J〕.Int J Radiat Oncol Biol Phys,2011,80(1):273-280.
[9] Nam H,Park W,Huh SJ,et al.The prognostic significance of tumor volume regression during radiotherapy and concurrent chemoradiotherapy for cervical cancer using MRI〔J〕.Gynecol Oncol,2007,107(2):320-325.
[10] 黄曼妮,徐英杰,吴令英,等.宫颈癌调强放射治疗靶区设计的临床研究〔J〕.癌症进展,2008,6(5):523-527.
[11] 魏丽春,石 梅.宫颈癌根治性放疗中三维适型调强放疗技术的应用〔J〕.中华肿瘤防治杂志,2010,17(17):1387-1390.

