CO2体系中咪唑啉季铵盐与十二烷基磺酸钠之间的缓蚀协同效应
张 晨 赵景茂,2,*
(1北京化工大学材料科学与工程学院,北京100029;2材料电化学过程与技术北京市重点实验室,北京100029)
1 引言
经济发展促使中国对石油、天然气等石化资源的需求量与日俱增.CO2是天然气或石油伴生气的组分之一,其溶于高矿化度的盐水后对钢铁具有强烈的腐蚀性.CO2腐蚀最典型的特征是呈现局部的点蚀、轮癣状腐蚀和台面状坑蚀.其中,台面状坑蚀是腐蚀过程最严重的一种情况,这种腐蚀的穿孔率很高.通常腐蚀速率可以达到3-7 mm·a-1,从而使油气井管柱的使用寿命下降至6-18个月,给油田生产造成巨大的经济损失.
目前,抑制CO2腐蚀的技术大致有:采用耐蚀合金、设备或管道的内外侧涂覆防腐层,加注缓蚀剂等.1实践表明,加注缓蚀剂是一种成本低廉、行之有效且易于实施的方法,特别适用于控制油气井管柱与地面集输管道的内腐蚀.咪唑啉在CO2腐蚀环境下具有优良的缓蚀性能,并且毒性小,因此得到了广泛应用.2
缓蚀剂的协同效应是指一种缓蚀剂的性能由于其它物质(或缓蚀剂)的加入而得到改善的现象.这种缓蚀效果的提高,并不是两组分的简单加和,而是互相促进,即1+1>2.3因此利用协同效应,可以有效地提高缓蚀剂的缓蚀效率,减少缓蚀剂的使用量.工业中实际应用的缓蚀剂大部分都是利用协同效应由多种物质复配而成的.
之前对缓蚀剂的协同效应研究主要集中在酸性体系(盐酸、硫酸、磷酸等无机强酸体系),其中对含氮的有机物与卤素离子之间的缓蚀协同效应研究较多,较为公认的缓蚀协同效应机理为:卤素离子在金属表面发生特性吸附,使金属表面带负电荷,有利于阳离子的缓蚀剂分子在金属表面吸附,从而提高了缓蚀效果.4,5对CO2体系中的研究主要集中在咪唑啉与硫脲之间的协同效应研究.6-9研究结果表明,咪唑啉与硫脲的复合物有可能在金属表面形成了一层双层膜.硫脲在膜的下部,咪唑啉在膜的上部.
与缓蚀剂经常复配使用的物质之一是表面活性剂.表面活性剂分子中多含有N、O、S、P等原子,由于其与缓蚀剂相似的结构和吸附特性,也会对碳钢产生缓蚀作用.10-18另外,表面活性剂可以通过亲水或疏水作用改变基体的表面活性,进而影响缓蚀剂在界面上的浓度及分散等.表面活性剂可以分为阳离子型、阴离子型、非离子型表面活性剂及双子表面活性剂,其中阴离子表面活性剂与缓蚀剂的协同效应已有前人研究,但研究体系多为盐酸、碳酸铵等,19-22而在CO2体系中,对咪唑啉缓蚀剂与阴离子表面活性剂的缓蚀协同效应研究较少.23因此,本文研究了咪唑啉季铵盐(IAS)与十二烷基磺酸钠(SDSH)在CO2饱和的3.5%NaCl腐蚀介质中对Q235钢的缓蚀协同效应,阐述了IAS与SDSH之间的协同作用机理.
2 研究方法
2.1 实验材料
实验所用材料为Q235钢,其化学成分(%,w)为C 0.17,Si 0.20,Mn 0.45,P 0.01,S 0.03,Fe余量.试片的尺寸为50 mm×10 mm×3 mm.实验介质为3.5%NaCl溶液,采用分析纯试剂和蒸馏水配制.实验前通1 h CO2使之饱和,实验温度为60°C.咪唑啉季铵盐(IAS)是实验室自制的缓蚀剂,是一种以抑制阳极为主的混合型缓蚀剂,在溶液中可电离产生阳离子.23IAS与SDSH的分子结构如图1.
2.2 静态失重法
钢片静态悬挂于CO2饱和的3.5%NaCl中,浸泡24 h后,将试片取出,放入后处理液(10%HCl+1%T-90酸洗缓蚀剂)中浸泡3 min,然后用去污粉搓洗,并用蒸馏水冲洗,再经丙酮、无水乙醇清洗,热风吹干后称重,由试片的失重来计算腐蚀速率(v)和缓蚀效率(η).计算公式:
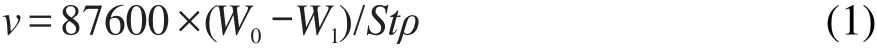
式中v单位为mm·a-1;W0与W1分别为腐蚀前后试片的质量,单位为g;S为试片的面积,单位为cm2;ρ为碳钢的密度,为7.8 g·cm-3;t为实验时间,单位为h.
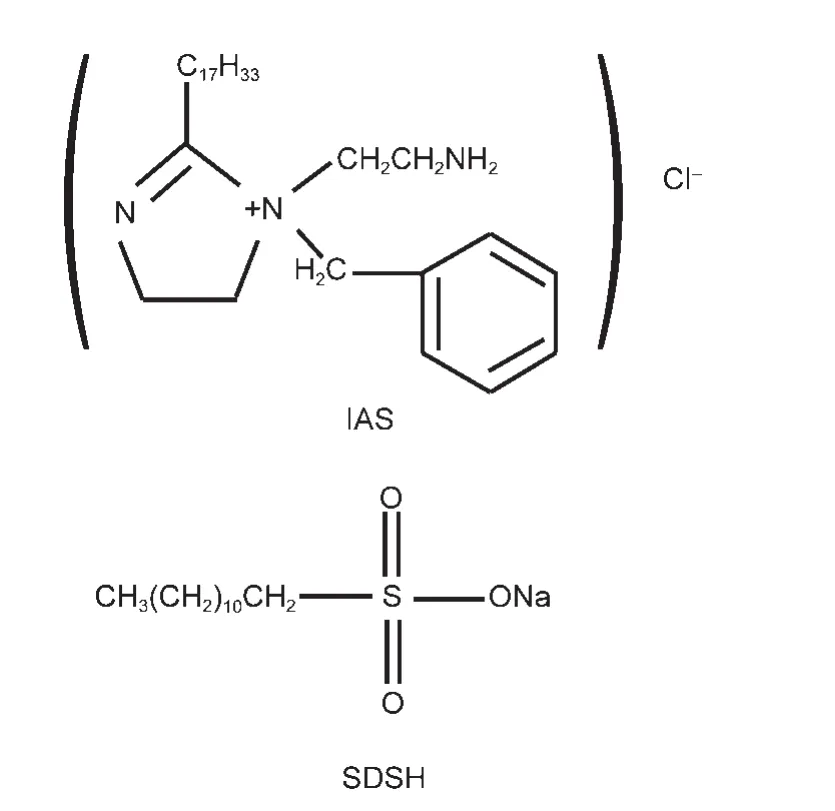
图1 IAS与SDSH的分子结构式Fig.1 Molecular structures of IAS and SDSH

式中v与v0分别为加入与未加入缓蚀剂时钢片的腐蚀速率,单位mm·a-1.
2.3 动电位极化曲线和电化学阻抗谱(EIS)测试
动电位极化曲线和电化学阻抗测试均采用传统三电极体系,工作电极材料为Q235钢,辅助电极为铂片电极,参比电极为饱和甘汞电极(SCE).极化曲线测试时,电位扫描速率为0.5 mV·s-1,扫描范围为±200 mV(vs自腐蚀电位),从阴极向阳极扫描,通过“弱极化区极化曲线法(三参数)”(由corrTest电化学测试系统Ver4.3提供的一种数据拟合方法)拟合,可以得出阴极塔菲尔斜率(βc)与阳极塔菲尔斜率(βa)及自腐蚀电流密度等参数.缓蚀效率可通过下式计算得到:

其中ic与ic0分别为加入与未加入缓蚀剂时测得的腐蚀电流密度,单位mA·cm-2.
电化学阻抗谱的扰动电位幅值为±5 mV,从高频往低频扫描,扫描频率范围为100 kHz-0.01 Hz,用Zsimp Win3.10软件对相应电化学参数进行解析.缓蚀率可通过下式计算得到:

其中Rct与Rct0分别为加入与未加入缓蚀剂时的电荷转移电阻,单位Ω·cm2.
2.4 XPS测试
所用仪器为美国Thermo Fisher Scientific公司的ESCALAB 250 X射线衍射光电子能谱仪.XPS分析的试样制备过程与静态失重法的过程一致,只是实验周期结束后不对试样进行后处理,而是直接用去离子水冲洗试片表面,去除残留的腐蚀介质,用滤纸沾干水渍,冷风吹干后用滤纸包好后,送样测试.
3 结果与讨论
3.1 静态失重结果
表1为采用静态失重法测得的添加不同浓度缓蚀剂的CO2饱和盐水中Q235钢的腐蚀速率和缓蚀剂的缓蚀效率的结果.从表中可以看出,单一的IAS和SDSH都有一定的缓蚀效果,且随着浓度的升高,缓蚀率逐渐升高,当浓度达到100 mg·L-1后,缓蚀率变化不大.溶液中单独添加200 mg·L-1IAS时,缓蚀率反而下降,可能是由于缓蚀剂在浓度较高时会在碳钢表面形成胶团吸附,从而使吸附层结构疏松,降低缓蚀率.24
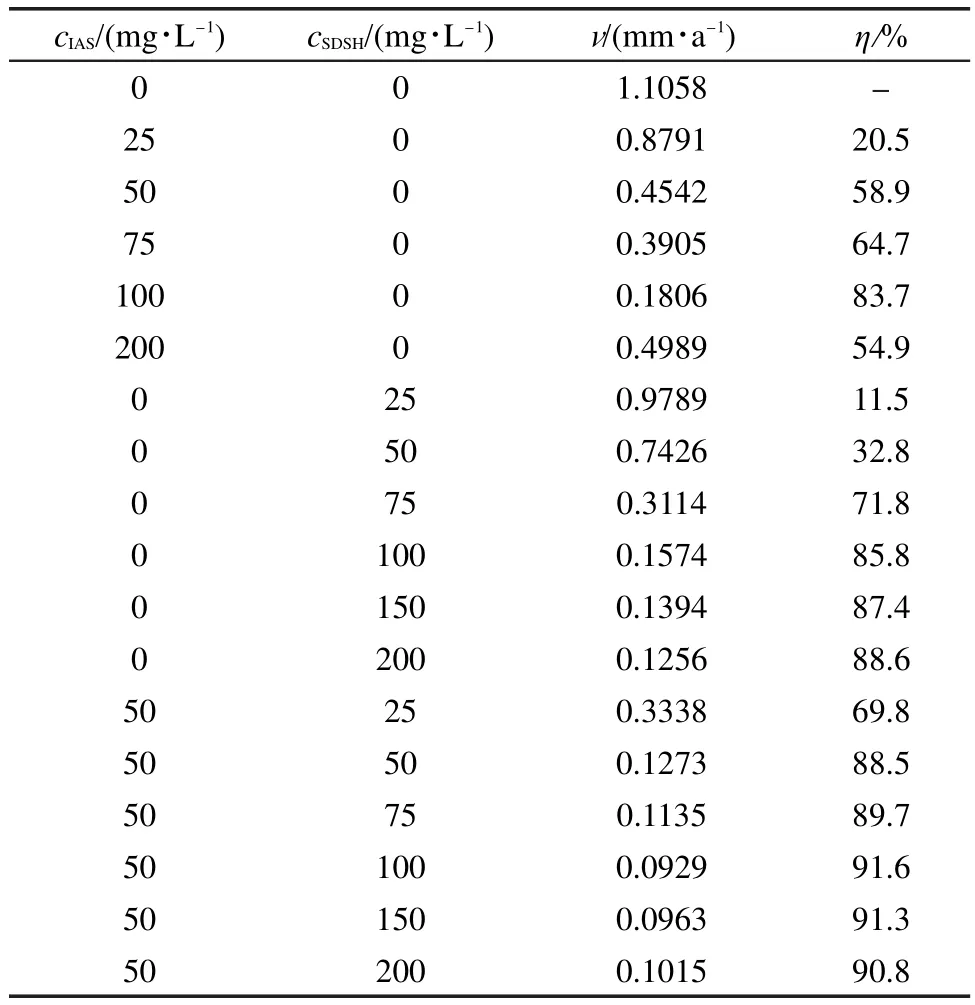
表1 在添加不同浓度缓蚀剂的CO2饱和盐水中Q235钢的v和缓蚀剂的ηTable 1 v of Q235 steel andηof inhibitors measured in the solution with different concentrations of corrosion inhibitors in CO2saturated brine solution
表2为溶液中同时添加SDSH和IAS后的腐蚀速率和缓蚀率.其中,IAS浓度固定为50 mg·L-1,SDSH的浓度变化范围为25-200 mg·L-1.从表2看出,除了第一组配比(50:25)外,其它配比均具有较好的缓蚀效果.比较表1和表2的数据可知,当二者复配使用后的缓蚀率明显大于单独使用SDSH或IAS的缓蚀率,说明二者之间具有较好的缓蚀协同效应.
为说明协同程度的大小,计算了二者不同配比时的协同参数S的数值,见表2.最初,S值的提出是为了描述有机胺类与卤素离子对金属腐蚀的联合抑制行为,之后被诸多学者引用到其它体系.通常,对于相互作用的缓蚀剂A与B,协同参数S的计算方法如下:25
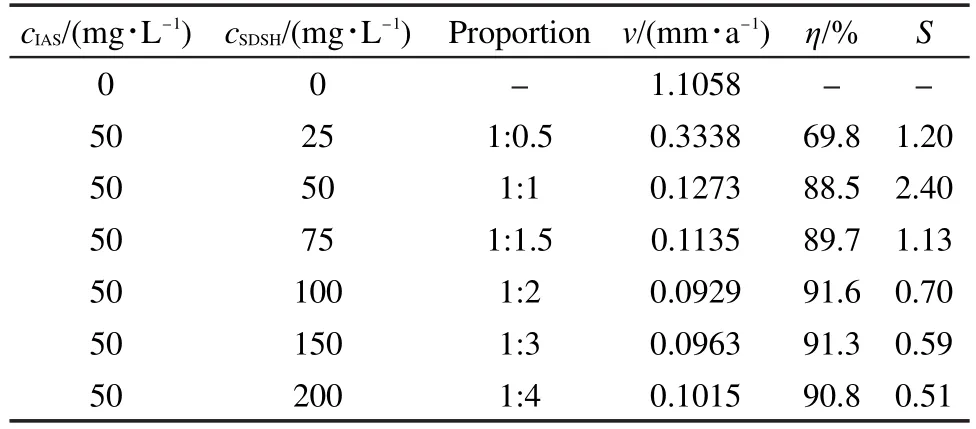
表2 CO2饱和盐水中同时添加两种缓蚀剂后Q235钢的v和缓蚀剂的ηTable 2 v of Q235 steel and η of inhibitors measured in the solution with two corrosion inhibitors in CO2saturated brine solution
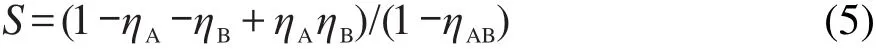
式中ηA和ηB分别表示A与B各自单独使用时测得的缓蚀率;ηAB表示A与B混合使用时测得的缓蚀率.
计算得到的S值,若小于或等于1,表示协同效应不明显;若大于1,表示存在协同效应.S值越大,表明协同作用程度越大.
图2是利用表1和表2中的部分数据绘制而得,其中横坐标为SDSH的添加浓度,纵坐标为缓蚀率和S数值.从图2可以看出:(1)SDSH与IAS复配使用时,当SDSH的添加浓度较低时(25-75 mg·L-1),二者之间存在协同效应;并且当二者的浓度比为1:1(50 mg·L-1:50 mg·L-1)时,协同效应最明显,复配缓蚀剂的缓蚀率可达88.5%;(2)单独使用SDSH及其与IAS复配使用时,缓蚀率均随SDSH浓度的增加而提高;当SDSH的添加浓度超过100 mg·L-1后,两条缓蚀率曲线相互逼近,说明SDSH与IAS复配使用时,添加较高浓度的SDSH会使IAS逐渐失去对碳钢的缓蚀作用,复配后缓蚀剂的性能主要取决于SDSH自身的缓蚀性能,二者的协同效应逐渐消失,这一结论从协同参数S值的变化中也可以看出.
3.2 电化学实验结果
3.2.1 极化曲线

图2 CO2饱和盐水中添加不同浓度缓蚀剂后测得的η及S值曲线Fig.2 η and S curves measured with different concentrations of corrosion inhibitors in CO2-saturated brine solution
为了进一步确认IAS和SDSH之间的缓蚀协同效应,进行了动电位极化曲线测试,所得极化曲线如图3.其中图3(a)为Q235钢在空白溶液和IAS与SDSH单独使用及1:1复配时的极化曲线;图3(b)为单独使用不同浓度的SDSH时测得的极化曲线;图3(c)为IAS与SDSH以不同配比使用时的极化曲线.从图3可以看出,溶液中添加了IAS或SDSH后,腐蚀电位正移,说明它们均为阳极型缓蚀剂,对阳极过程起到抑制作用.用软件(corrTest电化学测试系统Ver4.3)对每组极化曲线进行拟合,可得到阴极塔菲尔斜率(βc)、阳极塔菲尔斜率(βa)、自腐蚀电位(Ecorr)、自腐蚀电流密度(icorr)以及缓蚀效率η,各参数值列于表3.从表3中的缓蚀率可知,50 mg·L-1的IAS与50 mg·L-1的SDSH复配使用时,二者间存在较好的缓蚀协同效应;SDSH单独使用及其与IAS复配时,缓蚀效率均随SDSH浓度的增加而提高.与静态失重实验所得结论完全一致.
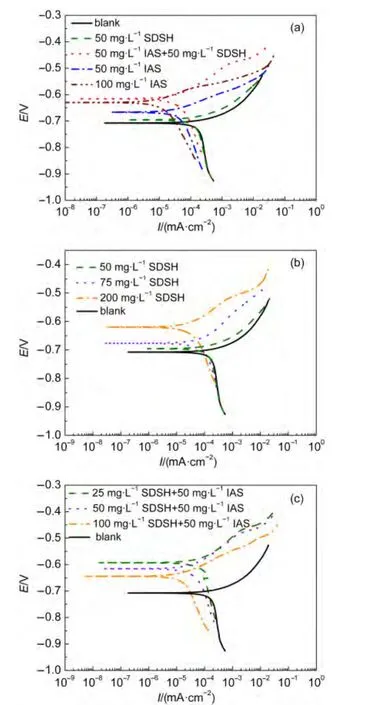
图3 Q235钢在添加不同浓度缓蚀剂的CO2饱和盐水中的极化曲线Fig.3 Polarization curves of Q235 steel measured with different concentrations of corrosion inhibitors in CO2 saturated brine solution
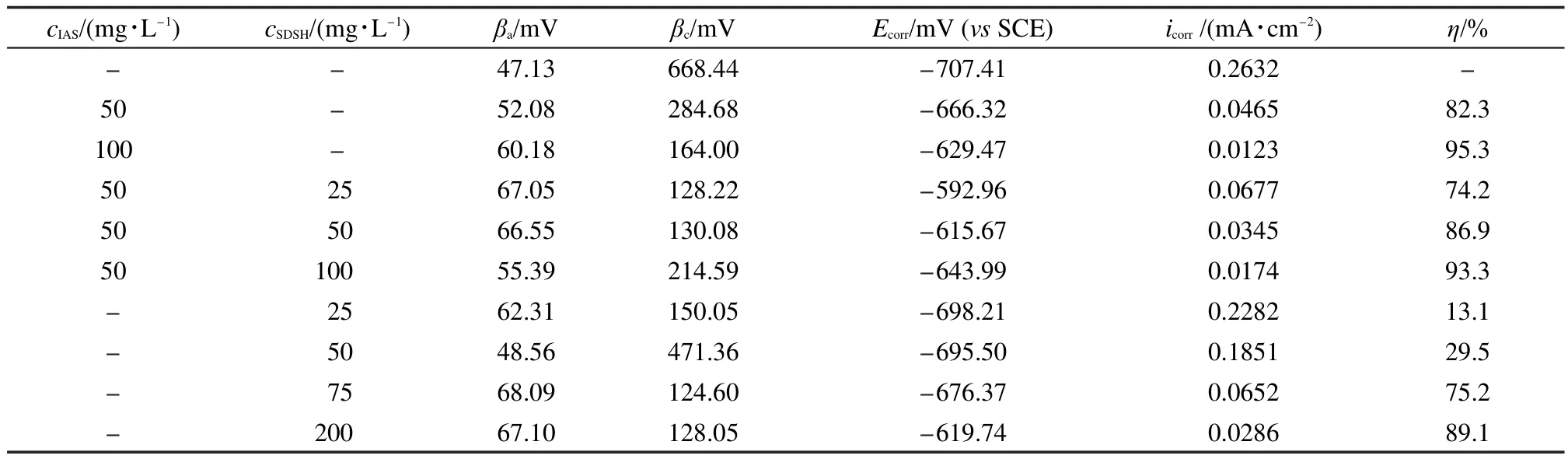
表3 Q235钢在添加不同浓度缓蚀剂的CO2饱和盐水中的电化学参数Table 3 Electrochemical parameters of Q235 steel measured with different concentrations of corrosion inhibitors in CO2 saturated brine solution
3.2.2 电化学阻抗
EIS实验依然是对SDSH与IAS间缓蚀协同效应的验证.图4为测试得到的电化学阻抗Nyquist图谱:(a)为Q235钢在空白溶液和IAS与SDSH单独使用及复配时的阻抗谱;(b)为单独使用不同浓度的SDSH时测得的阻抗谱;(c)为IAS与SDSH以不同配比复配使用时的阻抗谱.从(a)中可以看出,50 mg·L-1的IAS与50 mg·L-1的SDSH复配使用后,阻抗弧半径明显增大,说明二者复配使用可有效抑制金属腐蚀,协同效果明显;图(b)与(c)表明SDSH单独使用及其与IAS复配时,阻抗弧半径均随SDSH浓度的升高而增大,即对金属腐蚀的抑制作用逐渐增强.另外,由表4可知,溶液中存在缓蚀剂时的Q值(代表双电层电容)与空白体系相比会有所减小.Rct与Q的改变均与电极界面结构的变化有关.Rct的增加表明缓蚀剂对碳钢的溶解反应产生了一定阻力;Q的减小是因为介电常数较低的缓蚀剂分子替代了部分水分子而吸附在电极表面,形成了缓蚀剂吸附膜.阻抗弧半径Rct及计算得到的缓蚀效率列于表4.虽然电化学测得的缓蚀效率与失重实验的结果不完全吻合,但数据的变化趋势及所得结论完全一致.
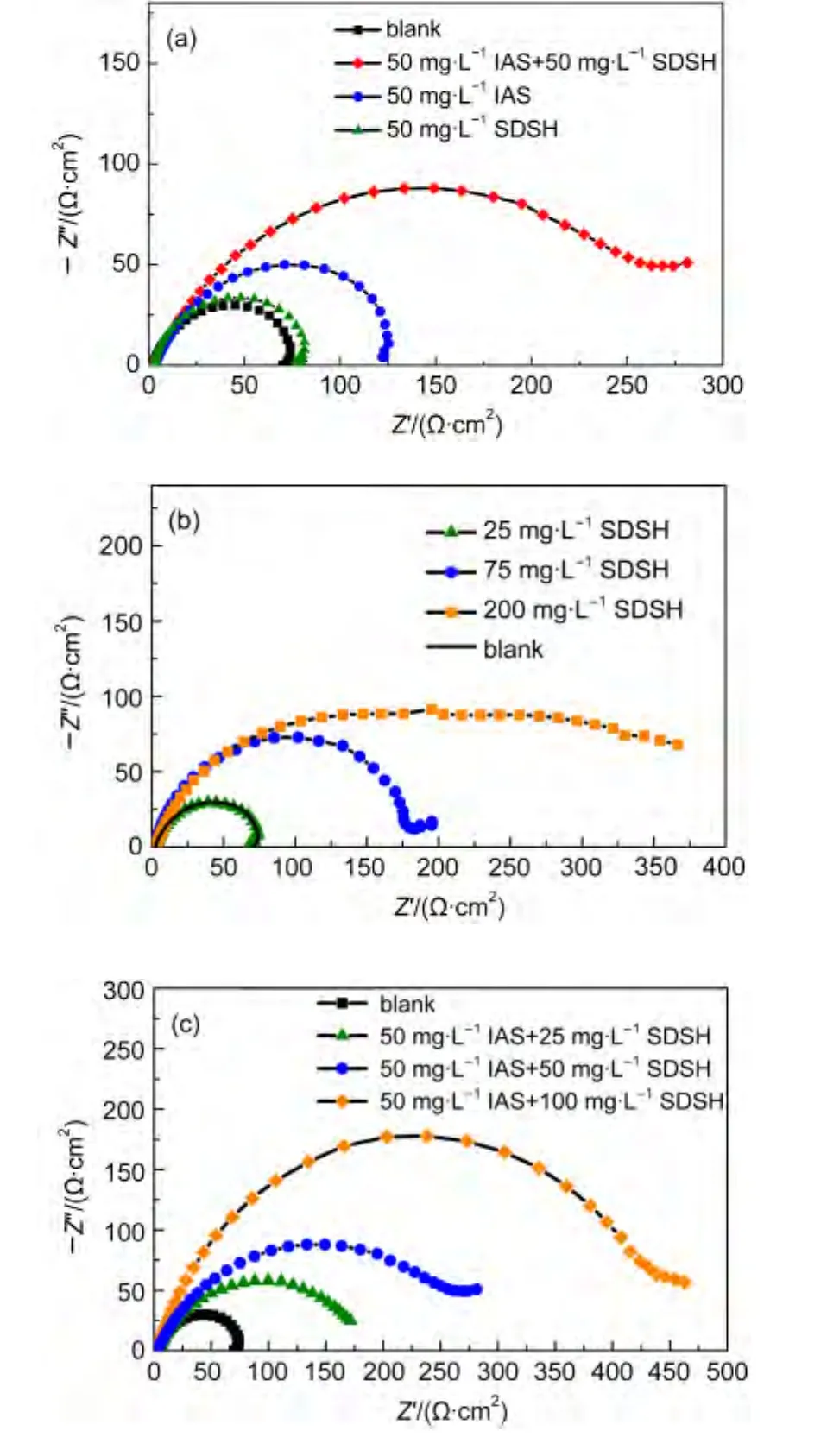
图4 Q235钢在添加不同缓蚀物质的CO2饱和盐水中的电化学阻抗Nyquist图谱Fig.4 Nyquist graphs of Q235 steel measured with different corrosion inhibitors in CO2saturated brine solution
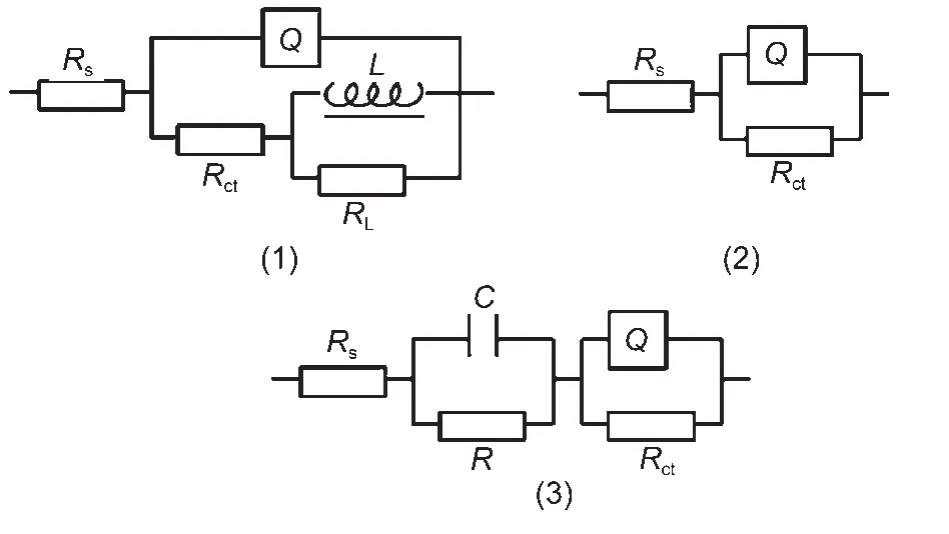
图5 Q235钢在添加不同缓蚀物质的CO2饱和盐水中的EIS图谱拟合等效电路Fig.5 Electrochemical equivalent circuits modeling of the impedance data for Q235 steel measured with different corrosion inhibitors in CO2saturated brine solution
通过对图4中的图谱进行拟合,可以得到图5的三种等效电路图,由于所有的图谱均存在一个被压扁的半圆,说明腐蚀体系所含的不再是理想双电层电容(Cdl),可以用常相角元件(CPE)来替代;26溶液中不添加缓蚀物质,或缓蚀物质浓度很低时,金属腐蚀比较严重,可以用电路(1)进行拟合,感抗的产生可能是由于吸附中间产物(如FeOHads或Hads)的生成;27,28缓蚀物质浓度升高后,腐蚀速率降低,感抗可能已经消失,故用电路(2)进行拟合;继续提高缓蚀物质的添加浓度后,缓蚀物质可能在已经形成的内层膜外又形成疏松的膜层,故用电路(3)拟合.等效电路图中Rs代表溶液电阻;Rct代表电荷转移电阻;Q代表双电层电容,是常相位角元件;C与R分别代表疏松膜层的电容和电阻;L与RL分别代表电感和电感电阻.各参数的拟合结果列于表4.
3.3 等温吸附方程

图6 Frumkin等温吸附方程拟合结果Fig.6 Fitting result by Frumkin isothermal adsorption equation
假设缓蚀剂在碳钢表面覆盖的部分不发生腐蚀,那么缓蚀剂在碳钢表面的覆盖度可以用缓蚀率来表示.将表1中的实验结果与各种等温吸附方程逐一拟合,发现SDSH与IAS在Q235钢表面的吸附过程分别符合Frumkin与Temkin吸附模型.
3.3.1 SDSH的等温吸附方程
以表面覆盖率θ为横坐标(x),ln[θ/c×(1-θ)]为纵坐标(y),拟合公式为:
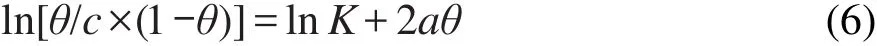
式中,K为吸附平衡常数.线性拟合后结果见图6,拟合后的等式为:

拟合精度R2为0.997.拟合过程中只选取SDSH添加浓度小于或等于100 mg·L-1时的数据,原因在于使用高浓度的表面活性剂时,容易在溶液中产生胶束.胶束也会吸附在金属表面,使得SDSH在金属表面的吸附行为不再是简单的几何覆盖,影响拟合的准确性.
图6中截距的值为lnK,计算得到K的值约为0.9 m3·mol-1;斜率值为2a,计算得a=1.665.根据吸附平衡常数K,应用下式可以计算出吸附自由能:
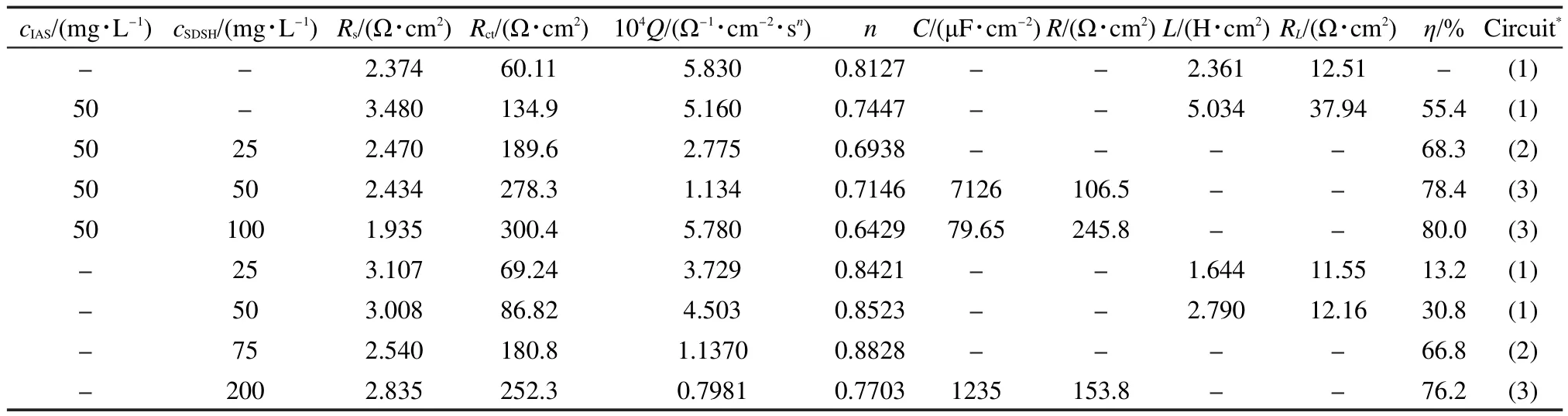
表4 添加不同缓蚀物质的CO2饱和盐水中测得的Nyquist图谱拟合参数和ηTable 4 Electrochemical parameters of impedance and η measured with different corrosion inhibitors in CO2saturated brine solution
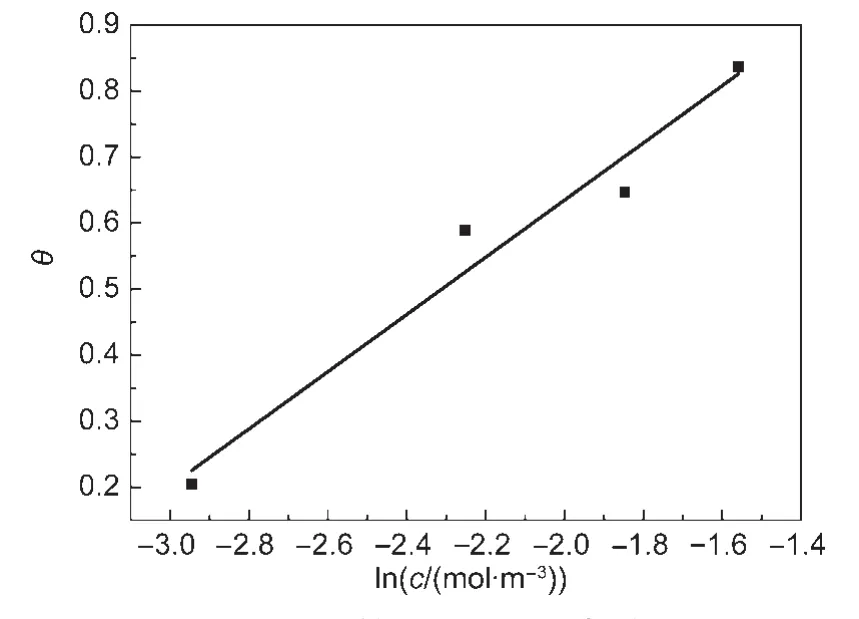
图7 Temkin等温吸附方程拟合结果Fig.7 Fitting result by Temkin isothermal adsorption equation
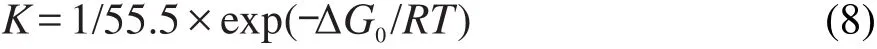
计算得到的ΔG0=-10.83 kJ·mol-1.ΔG0为负值,表示吸附过程自发进行.其绝对值小于20 kJ·mol-1时,说明为物理吸附.
3.3.2 IAS的等温吸附方程
以lnc为横坐标(x),θ为纵坐标(y),拟合公式为:线性拟合后的图像如图7所示,拟合后的等式为:


拟合精度R2=0.964.计算得到的ΔG0=-20.72 kJ·mol-1,ΔG0为负值表示吸附过程自发进行.其绝对值略大于20 kJ·mol-1,说明主要发生物理吸附,也可能兼有化学吸附.
3.4 协同作用机理分析
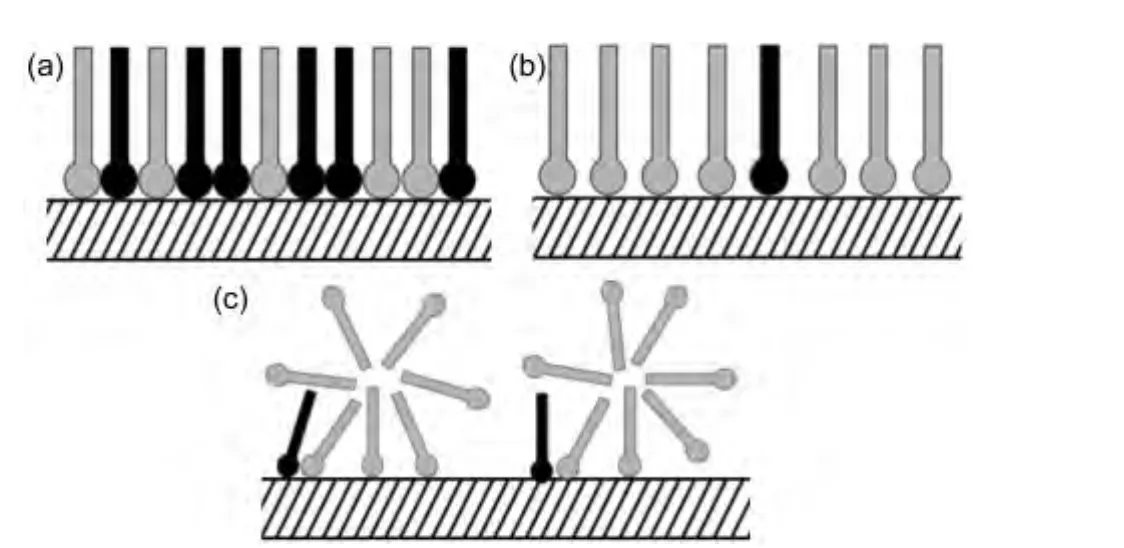
图8 IAS阳离子(深色)与SDSH阴离子(浅色)在碳钢表面可能的吸附形式Fig.8 Possible adsorption forms between cationic of IAS(deep color)and anionic of SDSH(light color)on the surface of carbon steel
有机缓蚀剂及表面活性剂均是通过吸附作用在碳钢表面形成一层吸附膜,将碳钢表面与腐蚀介质隔开,以达到抑制腐蚀的目的.因此,可以通过对吸附过程的研究来探讨协同作用机理.
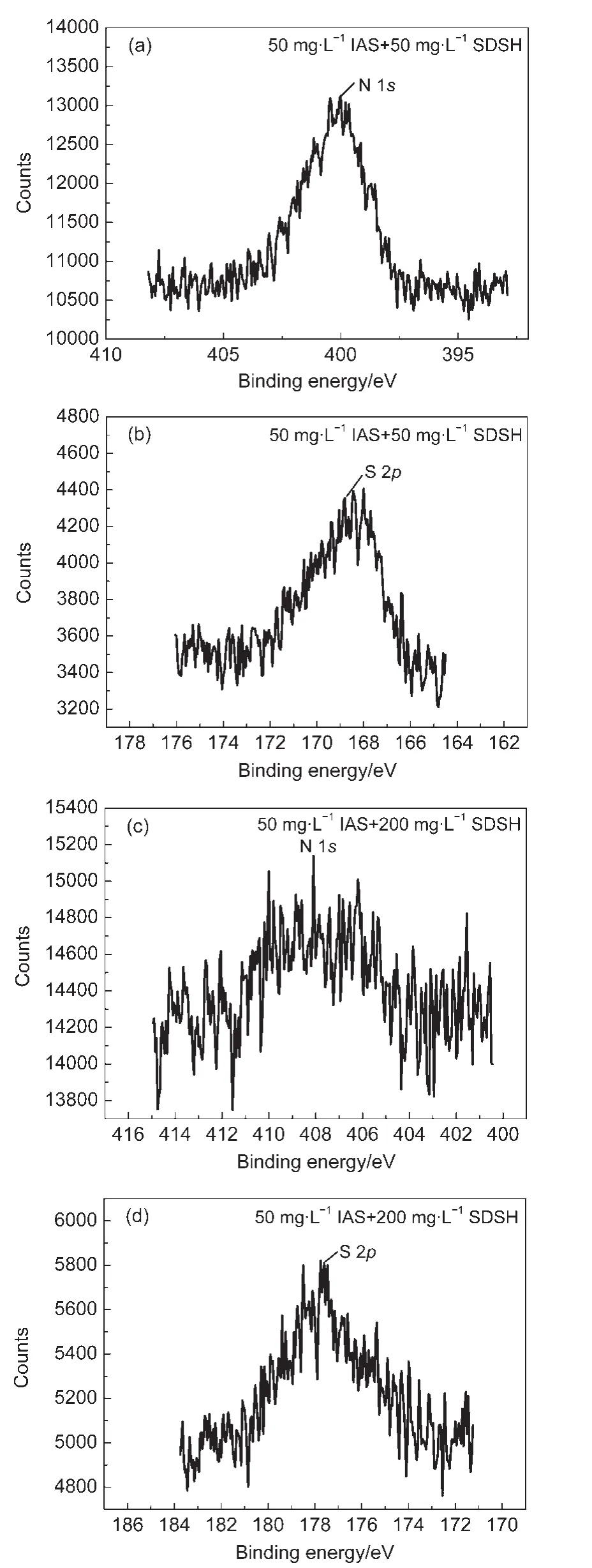
图9 添加不同复配比缓蚀物质的CO2饱和盐水中测得的N 1s与S 2p谱图Fig.9 N 1s and S 2p spectra measured with different ratios of corrosion inhibitors in CO2saturated brine solution

表5 N、S元素单位面积原子含量及缓蚀剂在膜层中的含量Table 5 Per proportion atom contents of S and N elements and contents of corrosion inhibitors in the coating

图10 碳钢表面腐蚀形貌的SEM图Fig.10 Scanning electron microscopy(SEM)images of surface corrosion morphology of carbon steel
SDSH添加到溶液后会电离出缓蚀性的阴离子,而IAS会电离出缓蚀性的阳离子.当50 mg·L-1IAS与低浓度的SDSH(25-75 mg·L-1)复配时,溶液中各缓蚀剂离子的浓度均较低,这些离子均有机会落在碳钢表面的吸附活性点上,此时阴阳离子在碳钢表面发生共吸附,离子有序排列,形成致密膜层,如图8(a)所示.当SDSH浓度超过100 mg·L-1后,由于阴阳离子间存在静电吸引,且此时SDSH的添加量远大于IAS,因此大部分IAS阳离子会被SDSH阴离子所束缚,不能在碳钢表面吸附,或者是以胶团形式吸附,此时碳钢表面吸附的主要是SDSH阴离子.此种情形下的吸附示意图如图8(b)和图8(c)所示.
为了验证IAS与SDSH的竞争吸附关系,采用XPS测试了试样表面缓蚀剂膜层的成分.图9为实测的XPS谱.对数据进行拟合后可以得到单位面积上N、S原子的百分含量;由于仅IAS与SDSH中分别含有N和S元素,因此可以计算得到IAS与SDSH在膜层中的相对含量,拟合得到的结果见表5.
从表5中的数据可以看出,50 mg·L-1IAS与50 mg·L-1SDSH复配使用时,IAS在金属表面的吸附量略大于SDSH;当SDSH的添加浓度为200 mg·L-1时,IAS的吸附量明显减少,说明SDSH优先抢占了金属表面的吸附活性点,进一步证明了IAS与SDSH的竞争吸附关系.
3.5 碳钢表面腐蚀形貌分析
在腐蚀介质中添加不同的缓蚀物质后,金属表面的腐蚀形貌会有所不同,图10是利用扫描电镜(SEM)(Quanta 200F场发射环境扫描电镜,生产厂家FEI)拍摄得到的金属表面腐蚀形貌图.图10(a)为Q235钢在CO2饱和盐水中的腐蚀,主要为全面腐蚀,但仍可找到腐蚀严重的局部腐蚀区域;图10(b)为单独加入50 mg·L-1的IAS后,未被缓蚀剂覆盖的区域,腐蚀非常严重;图10(c)为单独加入50 mg·L-1的SDSH后,金属以全面腐蚀为主,但可以找到面积较大的“椭圆形”点蚀;图10(d)为当50 mg·L-1IAS与50 mg·L-1SDSH复配使用时,金属以全面腐蚀为主,表面较光滑,虽然也会有点蚀产生,但点蚀面积明显减小,未见其它严重的局部腐蚀.因此,IAS与SDSH复配使用时,不仅可以大幅提高缓蚀率,还可以抑制金属发生严重的局部腐蚀.
4 结论
(1)在IAS浓度为50 mg·L-1,SDSH浓度低于75 mg·L-1时,IAS与SDSH间存在较好的协同效应,当复配比例为1:1(50 mg·L-1:50 mg·L-1)时,协同效应最明显,复配后的缓蚀率为88.5%.
(2)当SDSH浓度高于100 mg·L-1时,SDSH阴离子与IAS阳离子在金属表面会发生竞争吸附.此时起缓蚀作用的物质主要为SDSH.
(3)SDSH单独使用时,对Q235钢也具有良好的缓蚀性能,且随着添加浓度的增加,缓蚀率不断提高,最终趋于一个稳定值,其值约为90%.
(4)SDSH与IAS在Q235钢表面的吸附行为可以分别用Frumkin与Temkin等温吸附方程进行描述.
(1) Sun,L.;Xu,Q.L.;Fang,J.Welded Pipe&Tube 2009,32(3),23.[孙 丽,徐庆磊,方 炯.焊管,2009,32(3),23.]
(2) Li,Y.T.;Wang,L.Y.;Shi,D.Q.Mater.Prot.2011,44(12),50.[李言涛,王路遥,史德青.材料保护,2011,44(12),50.]
(3) Wu,Y.S.;Zheng,J.S.Electrochemical Protection and Application of Corrosion Inhibitor Technology,1st ed.;Chemical Industry Press:Beijing,2006;pp 502-506.[吴荫顺,郑家燊.电化学保护和缓蚀剂应用技术.第一版.北京:化学工业出版社,2006:502-506.]
(4)Bouklah,M.;Hammouti,B.;Aouniti,A.;Benkaddour,M.;Bouyanzer,A.Appl.Surf.Sci.2006,252(18),6236.doi:10.1016/j.apsusc.2005.08.026
(5) Çalι kan,N.;Bilgiç,S.Appl.Surf.Sci.2000,15(2-3),128.
(6) Lv,Z.P.;Zheng,J.S.;Peng,F.M.Corros.Prot.1999,20(9),395. [吕战鹏,郑家燊,彭芳明.腐蚀与防护,1999,20(9),395.]
(7) Okafor,P.C.;Liu,C.B.;Liu,X.;Zheng,Y.G.;Wang,F.;Liu,C.Y.;Wang,F.J.Solid State Electrochem.2010,14(8),1367.doi:10.1007/s10008-009-0963-6
(8) Zhao,J.M.;Liu,H.X.;Di,W.;Zuo,Y.Electrochemistry 2004,10(4),440.[赵景茂,刘鹤霞,狄 伟,左 禹.电化学,2004,10(4),440.]
(9) Zhao,J.M.;Chen,G.H.J.Chin.Soc.Corros.Prot.2013,33(3),226.[赵景茂,陈国浩.中国腐蚀与防护学报,2013,33(3),226.]
(10) Zhao,T.P.J.Kunming Inst.Technol.1995,20(2),95.[赵天培.昆明工学院学报,1995,20(2),95.]
(11) Mu,G.N.;Li,L.;Zhao,T.P.Chem.Cleaning 1999,15(1),1.[木冠南,李 琳,赵天培.化学清洗,1999,15(1),1.]
(12)Yang,S.P.;Xu,H.;Mu,C.Y.J.Zhengzhou Univ.(Nat.Sci.Ed.)1996,28(Suppl.2),91.[杨仕平,徐 虹,穆翠英.郑州大学学报(自然科学版),1996,28(增刊.2),91.]
(13)Deng,S.D.;Li,X.H.;Bai,W.;Fu,H.;Mu,G.N.Cleaning World 2007,23(7),1.[邓书端,李向红,白 玮,付 惠,木冠南.清洗世界,2007,23(7),1.]
(14)Yuan,L.B.;Liu,X.X.;Zhao,Q.R.;Li,X.H.;Mu,G.N.J.Yunnan Norm.Univ.2003,23(6),58.[袁朗白,刘晓轩,赵黔榕,李向红,木冠南.云南师范大学学报,2003,23(6),58.]
(15) Zhang,J.;Zhu,Z.Q.;Zhang,H.B.;Liu,Q.J.J Funct.Mater.2004,35,2069.[张 瑾,朱忠其,张海斌,柳清菊.功能材料,2004,35,2069.]
(16)An,Y.;Xu,Q.Plating&Finishing 2012,34(3),228.[安洋,徐 强.电镀与精饰,2012,34(3),228.]
(17)Xu,X.M.;Ge,H.H.;Wu,J.N.;Sun,R.;Han,J.X.;Xu,H.L.;Liu,Z.Z.Corros.Prot.2012,33(9),740. [徐学敏,葛红花,吴佳妮,孙 冉,韩建勋,许贺丽,刘坐镇.腐蚀与防护,2012,33(9),740.]
(18) Zhao,J.M.;Li,J.Acta Phys.-Chim.Sin.2012,28(3),623.[赵景茂,李 俊.物理化学学报,2012,28(3),623.]doi:10.3866/PKU.WHXB201112293
(19) Gu,N.;Li,C.M.J.Hebei Acad.Sci.2001,18(4),231.[谷 宁,李春梅.河北省科学院学报,2001,18(4),231.]
(20) Gu,N.;Li,C.M.Surf.Technol.2003,32(1),57.[谷 宁,李春梅.表面技术,2003,32(1),57.]
(21) Lalitha,A.;Ramesh,S.;Rajeswari,S.Electrochim.Acta 2005,51,47.doi:10.1016/j.electacta.2005.04.003
(22) Gao,H.;Li,Q.;Dai,Y.;Luo,F.;Zhang,H.X.Corrosion Sci.2010,52,1603.doi:10.1016/j.corsci.2010.01.033
(23) Zhao,J.M.;Chen,G.H.Electrochim.Acta 2012,69,247.doi:10.1016/j.electacta.2012.02.101
(24)Wei,B.M.Metal Corrosion Theory and Application,1st ed.;Chemical Industry Press:Beijing,1991;p 272.[魏宝明.金属腐蚀理论及应用.第一版.北京:化学工业出版社,1991:272.]
(25)Tavakoli,H.;Shahrabi,T.;Hosseini,M.Mater.Chem.Phys.2008,No.109,281.
(26) Shi,J.J.;Sun,W.Corros.Sci.Prot.Technol.2011,23(5),387.[施锦杰,孙 伟.腐蚀科学与防护技术,2011,23(5),387.]
(27) Lebrini,M.;Lagrenee,M.;Vezin,H.Corrosion Sci.2005,47,485.doi:10.1016/j.corsci.2004.06.001
(28)Zhang,G.A.;Chen,C.F.;Lu,M.X.Mater.Chem.Phys.2007,105,331.doi:10.1016/j.matchemphys.2007.04.076

