雪花梨的离体培养与快速繁殖
段莹莹,田彩芳,宋宇琴,李六林
(山西农业大学 园艺学院,山西 太谷 030801)
雪花梨的离体培养与快速繁殖
段莹莹,田彩芳,宋宇琴,李六林
(山西农业大学 园艺学院,山西 太谷 030801)
以雪花梨的单芽茎段为外植体,建立了雪花梨离体培养和快速繁殖体系。试验表明,5月中旬为雪花梨取材的最佳时间;基本培养基、6-BA和NAA等3种因素对黄冠芽增殖影响差异较大,按影响大小依次为6-BA、基本培养基、NAA;最佳的雪花梨组培苗增殖培养基为MS+6-BA 1.0 mg·L-1+NAA 0.15 mg·L-1+GA30.5 mg·L-1,增殖系数达3.9;适宜雪花梨组培苗的生根培养基为1/2MS+IBA 1.0 mg·L-1,生根率达41.4%。
雪花梨;单芽茎段;生根;离体培养;快速繁殖
雪花梨(PyrusbretschneideriRehd.)属白梨系统,是华北地区主栽的大果型传统品种,以其品质优良和独特风味倍受国内外市场的青睐[1]。雪花梨适应区域广,不仅适宜北方大部分地区栽培,而且适于长江流域及其以南多数地区栽培。但雪花梨在生产中表现出果实石细胞较多、易感黑星病等问题,严重影响着雪花梨的品质和经济价值。由于梨树生物学特性的限制,用常规育种手段改良梨品种的周期长、效率低,现代生物技术的发展为梨育种提供了新方法[2]。随着生物技术的不断发展,可通过引入外源目的基因定向地改变植株的不良性状[3]。
为此本试验以雪花梨为试材,对影响雪花梨离体培养的因素进行了研究,以期建立雪花梨的高效离体繁殖体系,为梨的快速繁殖、脱毒及基因转化提供基础。
1 材料与方法
1.1 试验材料
于山西省农科院果树研究所梨树资源圃选取生长健壮、无病虫害的雪花梨树体,采集当年生幼嫩枝条,去叶片带回备用。
1.2 试验内容与方法
1.2.1 初代培养
取样时间为2012年5月1日,5月20日,6月10日和6月30日。流水冲洗材料2 h。剪取3 cm带单芽茎段,在超净工作台上进行消毒。先用75%酒精消毒30 s,无菌水冲洗3次。再用0.1% HgCl2消毒4 min(加2滴吐温),无菌水漂洗5次。然后将其接入新鲜的初代培养基MS+6-BA1.0 mg·L-1+IBA0.1 mg·L-1,附加蔗糖30g·L-1,琼脂6 g·L-1,pH 5.8,放在培养室中(培养室温度为25±2℃,光周期(光照/黑暗)16 h/8 h,光强为2000 Lx),培养。每个处理30个茎段,重复3次,接种30天后统计褐化率、污染率及萌发率。
1.2.2 增殖培养
取初代培养获得的雪花梨的试管苗接入增殖培养基中,观察芽苗的生长情况。增殖培养基采用3因素3水平正交设计,以基本培养基、6-BA、NAA为试验因素,共9个处理(表1),每个处理附加0.5 mg·L-1GA3。每个处理30个茎段,重复3次,继代40天后统计增殖倍数。增殖倍数=gt;0.5 cm的茎段总数/接种时总茎数。
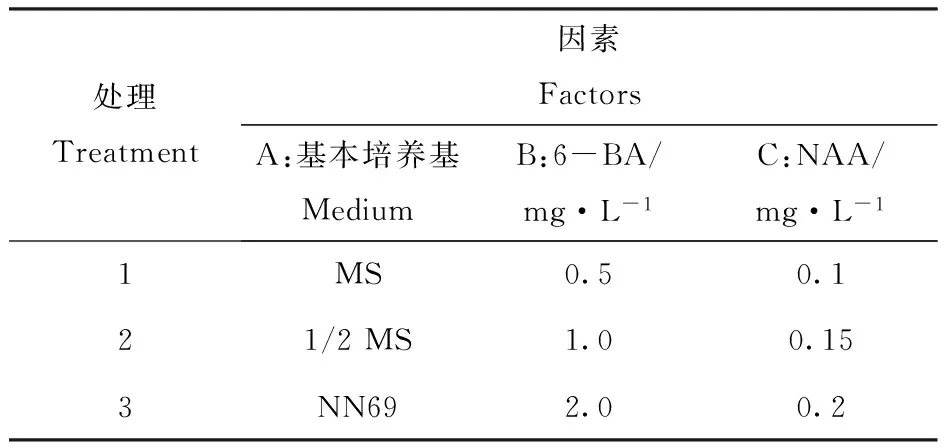
表1 增殖培养基正交试验设计L9(33)
1.2.3 生根培养
将2~3 cm长势较好的试管苗接种到1/2MS+IBA(0.5、1.0、1.5、2.0 mg·L-1)的生根培养基上,暗培养1周后转到光下培养,35 d后观察生根情况。
1.3 数据分析
用Excel软件统计数据,SAS8.0进行数据处理,Origin6绘制三维图形。
2 结果分析
2.1 取材时间对雪花梨初代培养的影响
由图1可见,雪花梨5月20日的存活率最高达到56.67%,5月1日污染率最低(12.22%),6月30日褐化率最低(21.11%)。5月20日的存活率与6月10日(54.44%)之间差异不显著,显著高于5月1日(37.78%)和6月30日(33.33%)。6月30日的褐化率与6月10日(22.22%)和5月20的(22.22%)差异不显著,极显著低于5月1日(50.00%)。5月1日的污染率与5月20日(21.11%)的差异不显著,极显著低于6月10日(23.33%)和6月30 日(45.56%)的。综合考虑认为5月中旬是雪花梨采集外植体的最佳时间。

图1 取材时间对雪花梨初代培养的影响
2.2 不同因素对雪花梨单芽茎段增殖的影响
从表2可见,3种因素对雪花梨组培苗增殖影响差异较大,按影响大小依次为6-BA、基本培养基、NAA。由表2的K值得出最佳培养基为A1B2C2,即MS+6-BA 1.0 mg·L-1+NAA 0.15 mg·L-1+GA30.5 mg·L-1,以此培养基作为雪花梨组培苗的增殖培养基,增殖系数达3.9。
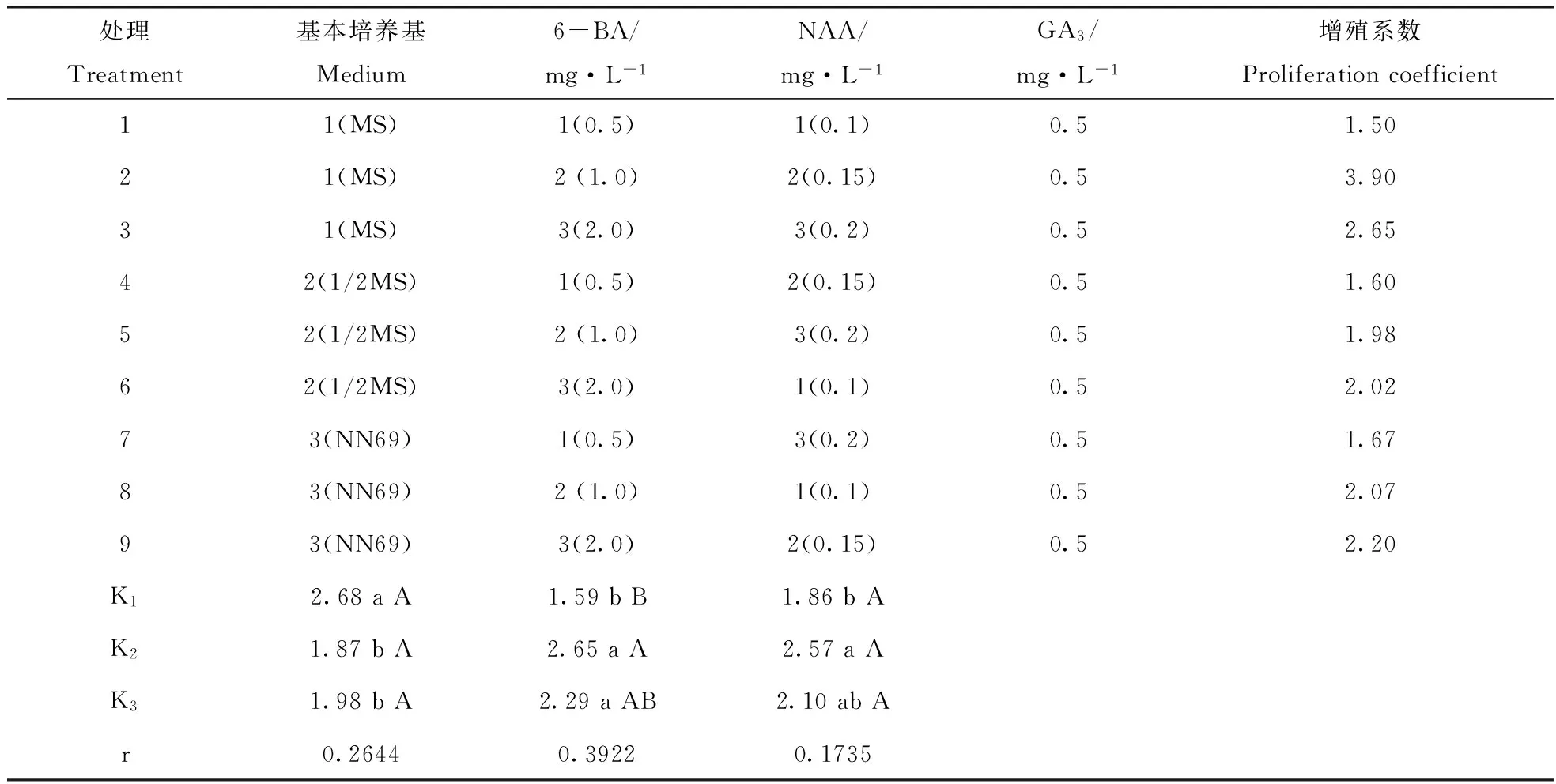
表2 雪花梨增殖培养正交试验结果
基本培养基MS对雪花梨增殖影响最大,与其它2种培养基的增殖系数差异显著。6-BA 1.0 mg·L-1和2.0 mg·L-1对雪花梨增殖影响最大,1.0 mg·L-16-BA的增殖倍数与2.0 mg·L-16-BA相比差异不显著,与0.5 mg·L-16-BA的增殖系数差异极显著。NAA0.15 mg·L-1和0.2 mg·L-1对雪花梨增殖影响最大,0.15 mg·L-1NAA的增殖倍数与0.2 mg·L-1NAA的差异不显著,与0.1 mg·L-1NAA的差异显著。综合考虑,对增殖系数要求不高时可将最佳培养基的NAA含量降到0.1 mg·L-1,降低成本。
2.3 MS培养基中6-BA与NAA对增殖系数的影响
由图2可看出,在MS培养基中,随着6-BA和NAA浓度的升高,雪花梨单芽茎段的增殖系数整体呈先上升后下降的趋势。当6-BA浓度为0.2~0.8 mg·L-1时,随着NAA浓度的增加,增殖系数先增加后趋于稳定;当6-BA浓度为0.8~1.0 mg·L-1时,随着NAA浓度的增加,增殖系数先急剧上升到达峰值(3.9)后降低;当6-BA浓度为1.0~2.0 mg·L-1时,随着NAA浓度的增加,增殖系数呈缓慢上升。由此可得出,0.8~1.0 mg·L-16-BA和0.1~0.12 mg·L-1NAA是雪花梨增殖的最佳条件。当试验对组培苗增殖要求不是很高时,可以调整6-BA浓度到0.2~0.8 mg·L-1,既节约成本还能避免因长期使用较高浓度细胞分裂素引起的玻璃化。
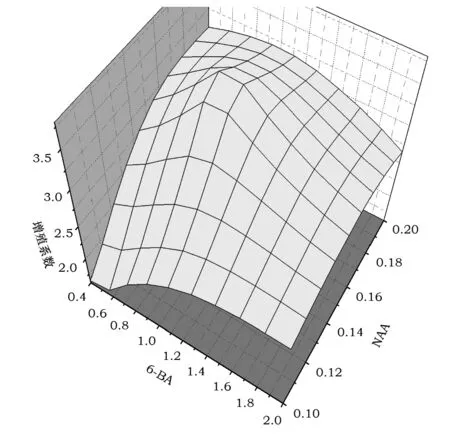
图2 MS培养基中6-BA与NAA对增殖系数的影响
2.4 不同浓度IBA对组培苗生根的影响
由表3可见,当IBA浓度为1.0 mg·L-1时,生根率达41.4%,生根较快,根系生长正常,根较多,分别是0.5、1.5、2.0 mg·L-1IBA的2.5、1.8、2.2倍。因此1/2MS+IBA 1.0 mg·L-1为雪花梨组培苗生根培养的最佳培养基。

表3 不同浓度IBA对组培苗生根的影响
3 讨论
在雪花梨单芽茎段初培阶段,采集外植体的时间不同,其污染率和褐化率存在着很大的差异,这与张玉娇[4]对黄冠梨组培快繁的研究结果相一致。污染是组织培养过程中的难题,按其来源可分为3大类:材料带菌、接种污染和培养过程污染。初代培养过程中的污染主要是外植体本身带菌或其表面杀菌不彻底造成的。可对采集树体或外植体做一些预处理和多不同的外植体采取不同的消毒方式来降低污染。Rugge BA[5]等在采集外植体前用敌菌丹杀菌剂处理田间的披散山龙眼母树, 使污染从对照的90%减少至14%。Langens[6]等将美丽百合的鳞茎外植体放入试管中进行43℃热击处理,有效的减少了污染。褐化也是影响初代培养效率的主要因素之一,本试验继代过程中发现雪花梨组培苗极易褐化,大大影响了组培效率。合适的取材时间、对外植体进行预处理[7,8]、适宜的培养基和培养条件、加抗氧化剂如Vc、活性炭[9]、抗坏血酸[10]、PVP[11]等和连续转移[12]可有效地防止褐化。
本试验研究结果表明基本培养基种类和附加激素6-BA、NAA均能影响黄冠单芽茎段的增殖,且基本培养基的影响最大。在MS基本培养基上,雪花梨组培苗叶片颜色浓绿,这与张俊林等对核桃的研究结果相一致[13]。植物生长调节剂是芽增殖培养基中必不可少的,本试验结果表明6-BA对增殖系数的影响比NAA大,但是6-BA浓度并不是越大越好,0.8~1.0 mg·L-16-BA对雪花梨组培苗的增殖影响最大。张锋[14]研究表明6-BA浓度过低,对组培苗生长的促进作用较小,浓度过高,虽然能提高分化系数,但会导致玻璃化率过高,不利于组培苗的生长。0.1~0.12 mg·L-1NAA对雪花梨的增殖影响最大,这与金青[15]等对砀山酥梨的研究结果相一致。GA3能促进茎的伸长[16],添加适当的GA3,能提高组培苗的增殖系数。
4 结论
于5月中下旬采集生长健壮的雪花梨单芽茎段接种在MS+6-BA 1.0 mg·L-1+IBA 0.1 mg·L-1培养基上进行初代培养,其存活率最高。30天后转接到继代培养基MS+6-BA 1.0 mg·L-1+NAA 0.15 mg·L-1+GA30.5 mg·L-1上其增殖系数最大,达3.9。组培苗在生根培养基1/2MS+IBA 1.0 mg·L-1上生根率最大,达41.4%,成功建立了雪花梨快速繁殖体系。
[1]郭文场,刘东宝,周淑荣,等.赵县雪花梨栽培管理[J].果树园地,2011(1):47-49.
[2]蔡小东,李志保.黄花梨茎段培养及植株再生[J].北方园艺,2011(13):128-129.
[3]韩延超,陈德龙,李六林.曲面分析在'雪花梨'叶片不定芽诱导培养基筛选上的应用[J].北方果树,2011(1):3-6.
[4]张玉娇,蔺经,丛郁,等.雪花梨组织培养与快繁技术研究[J].江苏农业科学,2009(3):35-36.
[5]Rugge BA.Wright MG.Micropropagation ofProtearepens[J].Acta Horticulturae,1995,387:121-127.
[6]Langens Gerrits M, Albers M, Klerk GJ de, et al.Hot water treatment before tissue culture reduces initial contamination in Lilium and Acer[J].Plant cell tissue and organ culture,1998,52:75-77.
[7]李焕秀,乔霓娇.降低苍溪梨外植体组培褐变途径的研究[J].西南大学学报(自然科学版),2001(6):524-526.
[8]赵滢,杨树华,李秋香,等.热激处理对蝴蝶兰组培褐变的抑制及其生理机制[J].北京林业大学学报,2003(1):103-108.
[9]李树丽.Vc液和活性炭对中华红叶杨外植体褐变的影响[J].安徽农业科学,2008(26):11232-11233.
[10]彭筱娜,易自力,蒋建雄,等.观赏凤梨组织培养中防止外植体褐化的初步研究[J].湖南农业科学,2007(4):67-69.
[11]余慧琳,王爱武,赵辉,等.蝴蝶兰花梗腋芽离体快繁控制褐变的研究[J].中国农学通报,2009(9):192-195.
[12]张振霞,郑玉忠.番荔枝组培中的褐化及防止措施研究[J].中国南方果树,2009,(3):41-42.
[13]张俊林,刘庆忠,樊靖,等.核桃茎尖增殖培养基筛选试验[J].中国果树,2008(2):40-42.
[14]张锋.6-BA对西瓜组培幼苗生长发育的影响[J].现代农业科技,2010(17):106-109.
[15]金青,蔡永萍.砀山酥梨的组织培养和脱毒快速繁殖[J].植物生理学通讯,2006,42(5):900.
[16]卢绪娟.玫瑰微体快繁技术体系的建立[D].山东农业大学,2007.
InvitroCultureandRapidPropagationofPearXuehuali
Duan Yingying, Tian Caifang, Song Yuqin, Li Liulin
(CollegeofHorticulture,ShanxiAgriculturalUniversity,TaiguShanxi030801,China)
Single bud stem of Pear Xuehuali were used as explants to establishinvitroculture and rapid propagation system. The results showed that mid-May was the best sampling time for Xuehuali, effect of culture medium, 6-BA and NAA on proliferation coefficient showed great difference, their impacts followed a descending order of 6-BA, culture medium, NAA; the MS medium with 1.0 mg·L-16-BA+0.15 mg·L-1NAA+0.5 mg·L-1GA3was optimal for the shoot multiplication, the proliferation coefficient was up to 3.9 after culturing for 40 days, the MS medium with 1.0 mg·L-1IBA was optimal for rootinginvitro, rooting rate could be up to 41.4%.
Xuehuali; Single bud stem; Rooting;invitroculture; Rapid propagation
2014-05-21
2014-06-20
段莹莹(1989-),女(汉),在读硕士,研究方向:果树栽培生理。
S661.2
A
1671-8151(2014)05-0464-04
(编辑:马荣博)

