吴茱萸致肝毒性研究
臧宝珊,孙向明,李文兰
(1. 哈尔滨商业大学 生命科学与环境科学研究中心,哈尔滨150076; 2. 国家教育部 抗肿瘤天然药物工程研究中心,哈尔滨150076)
传统观点认为,中药取材于天然的植物、动物、矿物,安全性高,不良反应少,且对一些西药无效的疾病具有一定的疗效,往往忽略了其潜在的毒副作用.李文兰、薛佳等[1-2]等研究发现,穿心莲提取物和穿心莲内酯对雄性小鼠具有生殖毒性作用,并呈现一定的“时-毒”、“量-毒”关系.
随着中药在东西方国家中日益广泛的应用,有关中药诱发药源性肝损伤(DILI)的报道也逐渐增多[3-5].药源性肝损伤是指药物在治疗过程中,肝脏由于药物的毒性损伤或对药物过敏反应所致的疾病.在全球死亡原因中,根据WHO统计的数据显示,药源性损伤导致的肝毒性因素位于第五位[6].在我国,中药所致的急性肝损伤仅次于抗结核药物位列第二[7-8],近年来已引起临床高度重视.
吴茱萸为芸香科植物吴茱萸(Evodia rutaecarpa(Juss.)Benth.)、石虎(Evodia rutaecarpa(Juss)Benth Var.officinalis(Dode)Huang.)或疏毛吴茱萸(Evodia rutaecarpa(Juss)Benth Var.bodinier(Dode)Huang.)的干燥近成熟果实.辛、苦、热,有小毒.归肝、脾、胃、肾经.具有散寒止痛,降逆止呕,助阳止泻的功效[9].吴茱萸始载于《神农本草经》,列为中品,属传统的中药温理药.在历代中医药书籍中记载其有小毒,《别录》言其“大热,有小毒”;《药性论》记载:“吴茱萸,味苦、辛,大热,有毒”;李时珍认为吴茱萸“有小毒,动脾火,病目者忌之”等.随着国内外学者对吴茱萸的化学成分及药理作用的深入研究,已为揭示吴茱萸药效物质基础奠定了一定的基础[10-14].近年来,吴茱萸的临床应用日趋广泛,临床上因服用吴茱萸不当而产生中毒的报道也时有发生[15-18],亦有部分文献指出其可以引起肝毒性[19],吴茱萸的用药安全引起了人们的高度重视.因此,笔者对近年来吴茱萸所致的肝毒性及其作用机制进行综述,以便为吴茱萸临床安全用药和科学研究提供依据及方法.
1 吴茱萸不同部位致肝毒性作用
目前已经从吴茱萸植物中分离得到了100多个化合物,研究发现吴茱萸植物所含的化学成分种类较多,包括生物碱、黄酮类、萜类、香豆素、甾体、精油、木脂素、核苷酸及其他成分,其中生物碱、苦味素为主要成分[20-22].
1.1 吴茱萸水提物致肝毒性
通过收集近些年关于吴茱萸水提物致肝毒性的研究发现,吴茱萸水提物引起的肝毒性多呈现一定的急性毒性.研究发现[18],多次灌胃吴茱萸水提物可导致明显的肝损伤,且存在一定的肝毒性的“量-时-毒”关系.吴茱萸水提物的剂量的不同会对肝脏造成不同程度的损伤,伴随着肝脏指数的变化、血清谷丙转氨酶(ALT)、谷草转氨酶(AST)的明显升高,且呈现剂量依赖相关性.周璐等[23]报道,吴茱萸水提取物影响大、小鼠部分肝药酶亚型的活性具有一定的差异性.根据大、小鼠实验结果显示,吴茱萸水提取物可以诱导大、小鼠CYP1A、CYP2C和CYP2E1的活性,且对CYP1A活性的诱导更为显著.吴茱萸水提取物可以诱导小鼠CYP3A活性,抑制大鼠CYP2D的活性,而对小鼠CYP2D、大鼠CYP3A的活性无显著影响.
1.2 吴茱萸醇提物致肝毒性
李波等[24]等研究发现,吴茱萸乙醇提物灌胃给予大鼠后,对其会产生不同程度的毒性.实验将80只SD雌雄各半的大鼠随机分成4组,分别给予吴茱萸乙醇提物15、30、60 g(原生药)/kg及等量蒸馏水灌胃14 d,于第3、14 d测定血液生化学、血液细胞学指标,观察肝脏组织病理变化,计算脏器系数.给药3 d后,吴茱萸乙醇提物30、60 g(原生药)/kg组尿素氮(BUN)、血清总胆红素(TBIL)和碱性磷酸酶(ALP)较对照组升高,白蛋白(ALB)和血清总蛋白(TP)明显降低,肝脏系数显著增大.给药14 d后,与对照组相比,吴茱萸乙醇提物30、60 g(原生药)/kg组血清谷草转氨酶(AST)升高,吴茱萸乙醇提物60 g(原生药)/kg组脏器系数较正常组明显增大.根据对各组大鼠肝脏病理组织学的观察,如图1、2所示,主要表现为肝脏中央静脉及小叶下静脉周围肝细胞变形、灶性坏死,毒性无性别差异,并呈现一定的“时-毒”、“量-毒”关系.

图1 吴茱萸乙醇提取物一次灌胃急性毒性试验肝脏病例变化(给药3 d后)
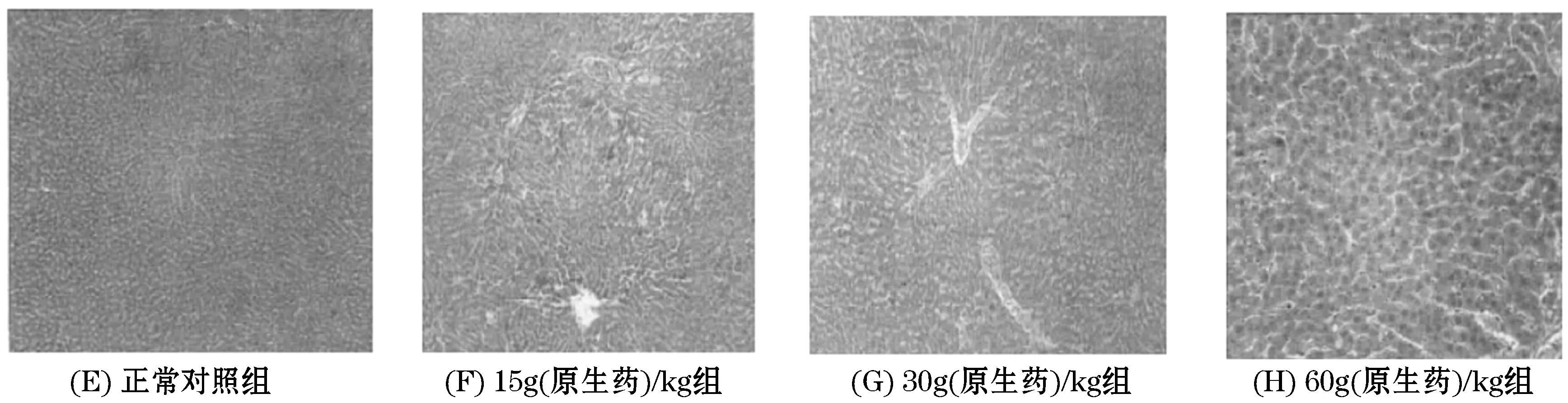
图2 吴茱萸乙醇提取物一次灌胃急性毒性试验肝脏病例变化(给药14 d后)
由此可知吴茱萸乙醇提物具有一定毒性,肝脏是其主要毒性靶器官之一,推测吴茱萸醇提物的肝毒性是通过其吸收代谢的产物影响肝药酶活性来损害肝脏.
1.3 吴茱萸挥发油致肝毒性
吴茱萸挥发油会产生一定程度的肝损伤.孙蓉等[25]用小鼠研究吴茱萸挥发油肝毒性“量-时-毒”关系,发现单次灌胃小鼠6 h后血清谷丙转氨酶(ALT)、谷草转氨酶(AST)达到峰值,8~72 h内造成明显肝损伤,且呈一定剂量依赖相关性.黄伟等[26]研究发现,多次灌胃小鼠吴茱萸挥发油会导致一定程度的肝损伤,与时间、剂量呈现一定相关性.根据实验结果显示,给药7 d之内小鼠血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(AKP)及总胆红素(TBI)升高,白蛋白(ALB)降低,脏器系数增大,以及不同程度的肝细胞水肿、脂肪变性和间质充血.
2 吴茱萸致肝毒性机制的研究
吴茱萸致肝毒性的机制复杂,其毒理学基础尚不完全明确,目前研究认为,吴茱萸致肝毒性机制可能与氧化应激和炎症反应有关.
2.1 与其引起机体氧化应激有关
正常情况下,机体内的氧化系统和抗氧化系统处于动态平衡状态.谷胱甘肽过氧化物酶(GSH-Px)、谷胱甘肽(GSH)、超氧化物歧化酶(SOD)和丙二醛(MDA)等都是抗氧化系统的重要成员.GSH-Px可以催化GSH变为GSSG,使有毒的过氧化物还原成无毒的羟基化合物,同时促进H2O2的分解,从而达到保护细胞膜的结构及功能不受过氧化物的干扰及损害的目的.GSH是机体内主要的低分子清除剂,保护许多蛋白质和酶等分子中的巯基,它是GSH-Px和GST两种酶的底物GSH,GSH含量的降低会产生毒性作用,因此GSH的含量是影响机体抗氧化作用的重要因素.
根据研究报道[27],吴茱萸水提物可引起血和肝中MDA含量的显著升高,GSH-Px、SOD活性的降低,NO含量的升高,NOS活性的增大, GHS含量的下降,且呈现出一定的剂量依赖相关性.血和肝中MDA含量升高,阻碍线粒体氧化磷酸化,损害线粒体功能,导致自由基增多,损害肝细胞;GSH-Px、SOD活性的降低,机体内自由基含量的升高,破坏了氧化系统和抗氧化系统之间的动态平衡,引起细胞凋亡;NO含量的升高和NOS活性的增大导致自由基增多,产生肝毒性;GSH含量的减少,降低了抗氧化作用.由此推测,引起机体氧化应激后诱导脂质过氧化可能是吴茱萸致肝毒性机制之一.
2.2 与其引起机体炎症反应有关
IL-1β、IL-6及TNF-α等均是与炎症反应十分相关的炎症介质.IL-1β是致炎性的细胞因子,它可以促进细胞增殖,释放炎性介质,参与炎症后期纤维化的形成.IL-1β会促进病理性成纤维细胞分泌更多的IL-6和IL-8.IL-6是活化的T细胞和成纤维细胞产生的淋巴因子,能使B细胞前体成为产生抗体的细胞;和集落刺激因子协同,能促进原始骨髓源细胞的生长和分化,增强自然杀伤细胞的裂解功能.TNF-α是一种由激活的巨噬细胞产生的能抑制成骨细胞和刺激破骨细胞的细胞因子,其被证实在肝纤维化中发挥重要的作用,TNF-α的过度分泌会引起肝损伤.周璐等[28]在研究吴茱萸水煎液致小鼠肝毒性机制中发现,连续21 d给予高、中、低3个剂量的吴茱萸水煎液后,如表1所示,与正常组相比,给药组的小鼠肝脏中IL-1β、IL-6及TNF-α的含量明显增高.提示大量炎症介质释放与产生,是吴茱萸致肝损伤的原因之一,见表1.
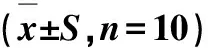

组别生药剂量/(g·kg-1·d-1)IL-1β/(ng·L-1)IL-6/(pg·L-1)TNF-α/(ng·L-1)正常- 15.33±0.74 24.99±1.96104.89±8.86吴茱萸1018.71±1.03∗27.14±1.71∗125.04±8.722020.95±0.86∗29.89±1.81∗ 131.13±9.963027.64±1.43∗41.57±3.59∗155.84±8.9∗
与正常组比较*P<0.01
3 结 语
中药是中国传统文化和传统医学的精华,中药治疗具有丰富的临床经验和独特的理论体系,对人类健康做出了不可磨灭的贡献.近些年临床上因服用了未炮制透的中药或直接服用了生品中药或因超剂量服用或因配伍不当而引起肝脏毒性的报道日益增多.如何避免中药可能存在的肝脏毒性,提高中药临床用药安全,是中药走向现代化、产业化、国际化的关键所在.
吴茱萸为临床常用中药,其水煎剂为常用剂型,历代本草中一般记载其有小毒,从日益增多的吴茱萸临床不良反应报道中得知肝损害占大部分,吴茱萸的用药安全引起了人们的重视.目前,认为吴茱萸致肝毒性的作用机制为:一是与引起机体氧化应激后诱导脂质过氧化有关;二是与引起机体炎症反应有关.吴茱萸引起肝毒性的物质基础和作用机制的进一步深入的研究和明确,是解决吴茱萸致肝毒性问题的有效途径.
参考文献:
[1] 李文兰, 丁振铎, 王铁山, 等. 穿心莲生殖毒性的量效关系研究[J]. 哈尔滨商业大学学报:自然科学版, 2013, 29(3): 257-261.
[2] 薛 佳, 李文兰, 王学志, 等. 穿心莲生殖毒性的时效关系研究[J]. 哈尔滨商业大学学报:自然科学版, 2011, 27(5): 645-666.
[3] 高 尚, 孙向明, 许 颖, 等. 中药致肝毒性相关机制研究[J]. 哈尔滨商业大学学报:自然科学版, 2014, 30(3): 257-270.
[4] WANG J, JI L, LIU H,etal. Study of the hepatotoxicity induced by Dioscorea bulifera L. rhizome in mice [J]. Bioscience Trends, 2010, 4(2): 79-85.
[5] CHAU T N. Drug-induced liver injury: an update [J]. The Hong Kong Medical Diary, 2008, 13(3): 23-26.
[6] LARREY D. Epidemiology and individual susceptibility to adverse drug reactions affecting the liver [J]. Seminars in Liver Disease, 2002, 22(2): 145-155.
[7] TESCHKE R, WOLFF A, FRENZEL C,etal. Herbal hepatotoxicity: a tabular compilation of reported cases [J]. Liver International, 2012, 32(10): 1543-1556.
[8] MEIER Y, CAVALLARO M, ROOS M,etal. Incidence of drug induced liver injury in medical inpatients [J]. European Journal of Clinical Pharmacology, 2005, 61(2): 135-143.
[9] 中华人民共和国药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2010: 160.
[10] YAN R, WANG Y, SHEN W J,etal. Relative determination of dehydroevodiamine in rat plasma by LC-MS and study on its pharmacokinetics [J]. Journal of Chromatographic Science, 2012, 50(7): 582-585.
[11] XIAO B Y, MAO S J, LI X D. Variations in the composition of Fructus Evodiae after processing with Radix Glycyrrhizae extract [J]. Chinese Journal of Integrative Medicine, 2012, 18(10): 782-787.
[12] HUANG X, LI W, YANG X W. New cytotoxic quinolone alkaloids from fruits of Evodia rutaecarpa [J]. Fitoterapia, 2012, 83(4): 709-714.
[13] CHEN F, LI S, LI D,etal. Transdermal behaviors comparisons among Evodia rutaecarpa extracts with different purity of evodiamine and rutaecarpine and the effect of topical formulation in vivo [J]. Fitoterapia, 2012, 83(5): 954-960.
[14] NOH K, SEO Y M, LEE S K,etal. Effects of rutaecarpine on the metabolism and urinary excretion of caffeine in rats [J]. Archives of Pharmacal Research, 2011, 34(1): 119-125.
[15] 朱兰兰, 黄 伟, 黄幼异, 等. 基于功效和物质基础的吴茱萸毒性研究思考[J]. 中国药物警戒, 2011, 8(6): 366-369.
[16] 蔡雪映, 孟 楠, 杨 冰. 服用吴茱萸过量致中毒1例分析[J]. 北京中医药, 2006, 25(3): 171-172.
[17] LI L, ZHAO J N, YI J H,etal. Research on toxicity characteristics in Evodia Fructus of different orgins and producing areas [J]. China Journal of Chinese Materia Medica, 2012, 37(15): 2219-2222.
[18] HUANG W, LI X J Y, SUN R. “Dose-time-toxicity” relationship study on hepatotoxicity caused by multiple dose water extraction components of Evodiae Fructus to mice [J]. China Journal of Chinese Materia Medica, 2012, 37(15): 2223-2227.
[19] 周 绮, 张 茜, 金若敏. 茱萸致小鼠肝毒性时效、量效关系研究[J]. 中国实验方剂学杂志, 2011, 17(9): 232.
[20] 张起辉, 高慧媛, 吴立军, 等. 吴茱英的化学成分[J]. 沈阳药科大学学报, 2005, 22(1): 12-14.
[21] 孟 娜, 陈凤凰, 惠 斌. 吴茱萸化学成分研究[J]. 贵州大学学报, 2006, 23(2): 188-190.
[22] 张 璐, 冯育林, 王跃生. 吴茱萸现代研究概况[J]. 江西中医学院学报, 2010, 22(2): 78-82.
[23] 周 璐, 徐婷婷, 金若敏, 等. 吴茱萸水煎液对大、小鼠肝药酶亚型影响的比较研究[J]. 中国药理学通报, 2014, 30(2): 279-282.
[24] 李 波, 李 莉, 赵军宁, 等. 吴茱萸乙醇提取物对大鼠急性毒性及肝毒性的影响[J]. 中药药理与临床, 2013, 29(2): 120-124.
[25] 孙 蓉, 黄 伟, 吕丽莉. 吴茱萸挥发油单次给药对小鼠肝毒性“量-时-毒”关系研究[J]. 中国药理与临床, 2012, 28(3): 55-58.
[26] 黄 伟, 孙 蓉, 李晓宇. 吴茱萸挥发油多次给药致小鼠肝毒性“量-时-毒”关系研究[C]//中国药学大会暨第十三届中国药师周论文集, 2013.
[27] 黄 伟, 孙 蓉. 吴茱萸水提组分多次给药致小鼠肝毒性氧化损伤机制研究[J]. 中国药理与临床, 2012, 28(5): 114-116.
[28] 周 璐, 姚广涛, 曹智丽, 等. 吴茱萸水煎液致小鼠肝毒性机制研究[J]. 中国实验方剂学杂志, 2013, 19(22): 269-272.

