红土镍矿HCl浸出液中Mg的回收和浸出剂再生
葛 , , , ,
(上海大学 上海市现代冶金与材料制备重点实验室,上海 200072)
红土镍矿HCl浸出液中Mg的回收和浸出剂再生
葛勇,胡尊玉,丁伟中,谈定生,郭曙强
(上海大学 上海市现代冶金与材料制备重点实验室,上海200072)
简述了近年来红土镍矿HCl浸出液中Mg的回收及浸出剂再生工艺的研究现状,介绍了对浸出液采用MgCl2溶液的水解、硫酸盐水合物的结晶、碱式MgCl2的沉淀、纳米级Mg(OH)2的制备以及MgCl2溶液的雾化干燥与焙烧等处理方法和应用进展.
红土镍矿;HCl浸出;Mg回收; 浸出剂再生
0 前 言
目前,地球上已探明的陆基镍资源72%以红土镍矿的形式存在,而全球只有近42%的镍产量源于红土镍矿.近年来,随着镍产品需求量的增加和可开采硫化镍矿资源的逐渐减少,红土镍矿的开发利用愈来愈受到重视[1-2].低成本、高效益的工艺是加快红土镍矿开发利用的关键.
红土镍矿主要分布在热带和雨水充足的地区.红土镍矿的最表层主要是赤铁矿和针铁矿等矿物,该层含镍很低,基本上不具备利用价值.在表层下方是褐铁矿层,主要矿物为针铁矿、赤铁矿和高岭土,通常含Ni的质量分数为0.7%~1.5%,而Mg的质量分数为0.5%~5%.褐铁矿层下方是腐殖土层,腐殖土层的主要成分特征是由下向上Mg的含量逐渐减少,而Ni和Si的含量逐渐增高.腐殖土层主要是叶蛇纹石及蒙脱石,通常含Ni的质量分数为1%~4%,最高可达10%,但是Mg的质量分数达到15%~35%.在褐铁矿层与腐殖土层之间,有时还存在过渡层,Ni的质量分数一般在1%~3%,Mg的含量也较高,质量分数为5%~15%[3].
HCl作为浸出剂湿法处理红土镍矿提取Ni,具有较高的浸出率和较快的浸出速率.然而,高的Mg浸出率使得酸耗增加,降低了HCl浸出工艺的经济性,所以浸出液中的HCl再生是此类工艺的关键环节之一.另外,从环保和资源的综合利用方面考虑,浸出液中的Mg也需要得到适当的回收处理.
1 MgCl2溶液水解
捷豹镍业根据 Harris等[4]的专利设计了以HCl-MgCl2混合物溶液作为浸出剂的红土镍矿常压浸出工艺(Jaguar工艺),指出,浸出剂中加入氯化物使得水的活度<<1,因而可显著提高浸出剂中氢离子的活度.同时,由于同离子效应,浸出剂中高浓度的MgCl2可以抑制红土镍矿中Mg的浸出.该工艺的流程如图1所示.浸出液在用MgO除杂和提取有价金属后,剩余的MgCl2溶液经过预蒸发,部分循环用于浸出,部分用于水解再生HCl,副产品MgO出售或者循环利用.水解反应式如下:
MgCl2(aq)+H2O = MgO(s)+2 HCl(g)
(1)

图1 Jaguar工艺流程Fig.1 Jaguar Process
水解本身是高效的,但是预蒸发和水解前水的蒸发需要耗费大量的能量以及设备投入,运营费用较高使得该工艺不经济,因此,捷豹镍业目前已暂停了这一工艺的实施[5].
2 硫酸盐结晶
2.1 硫酸钙水合物
由于水解法再生HCl在经济性方面的限制,Moyes等[6]在湿法处理红土镍矿的Intec工艺中提出了通过H2SO4与氯化物溶液反应制得硫酸盐沉淀以再生HCl的方法.此方法是用价格较便宜的H2SO4再生较昂贵的HCl,据此选择CaCl2作为原料再生HCl,反应如下:
CaCl2(aq)+H2SO4(aq)+1/2 H2O=
CaSO4·1/2 H2O(s)+2HCl(aq)
(2)
图2为Intec工艺流程图.Intec工艺类似于Jaguar工艺,以HCl-CaCl2溶液作为浸出剂,浸出液中加入CaO以除去杂质,并且得到Ni/Co的氢氧化物沉淀,Mg以MgO形式沉淀,最后得到CaCl2溶液用于再生HCl,浸出过程中消耗的盐酸可以全部再生得到.副产品CaSO4·1/2 H2O用于出售或煅烧生成CaO和SO2循环使用.但是CaSO4·1/2 H2O和MgO作为副产品出售,必须有一定的纯度.此外,CaSO4·1/2 H2O用于煅烧生成CaO和SO2,过程中可能生成中间产物,产生的CaO循环使用时活性不高.
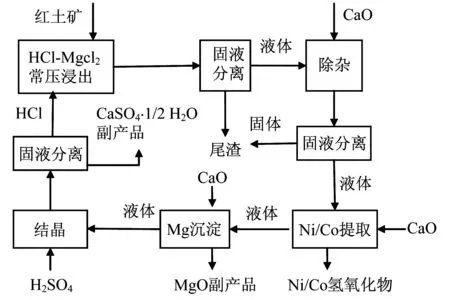
图2 Intec工艺流程Fig.2 Intec Process
Li等[7]对利用CaCl2溶液生成CaSO4水合物结晶并再生HCl进行了深入的研究,测定了不同温度下各种CaSO4水合物在CaCl2-HCl溶液中的溶解度,分析了不同温度下NaCl、MgCl2、FeCl2、FeCl3和 AlCl3对CaSO4各种水合物在CaCl2-HCl溶液中溶解度的影响[8],建立并改进了不同温度下各种CaSO4水合物在CaCl2-HCl溶液中的溶解度计算模型[9-10],并探索了各CaSO4水合物的生成、物相间转变的动力学[11-13].根据以上研究,结合浸出工艺,Demopoulos[14]提出了如图3所示的CaSO4水合物结晶再生HCl的流程,同时指出该流程具有以下特点:
(1) 可得到各种CaSO4水合物产品;
(2) 再生HCl的体积分数可达5.5 mol/L.
根据预算,在不计副产品的效益下,此流程较水解法节省1/3的成本[14].
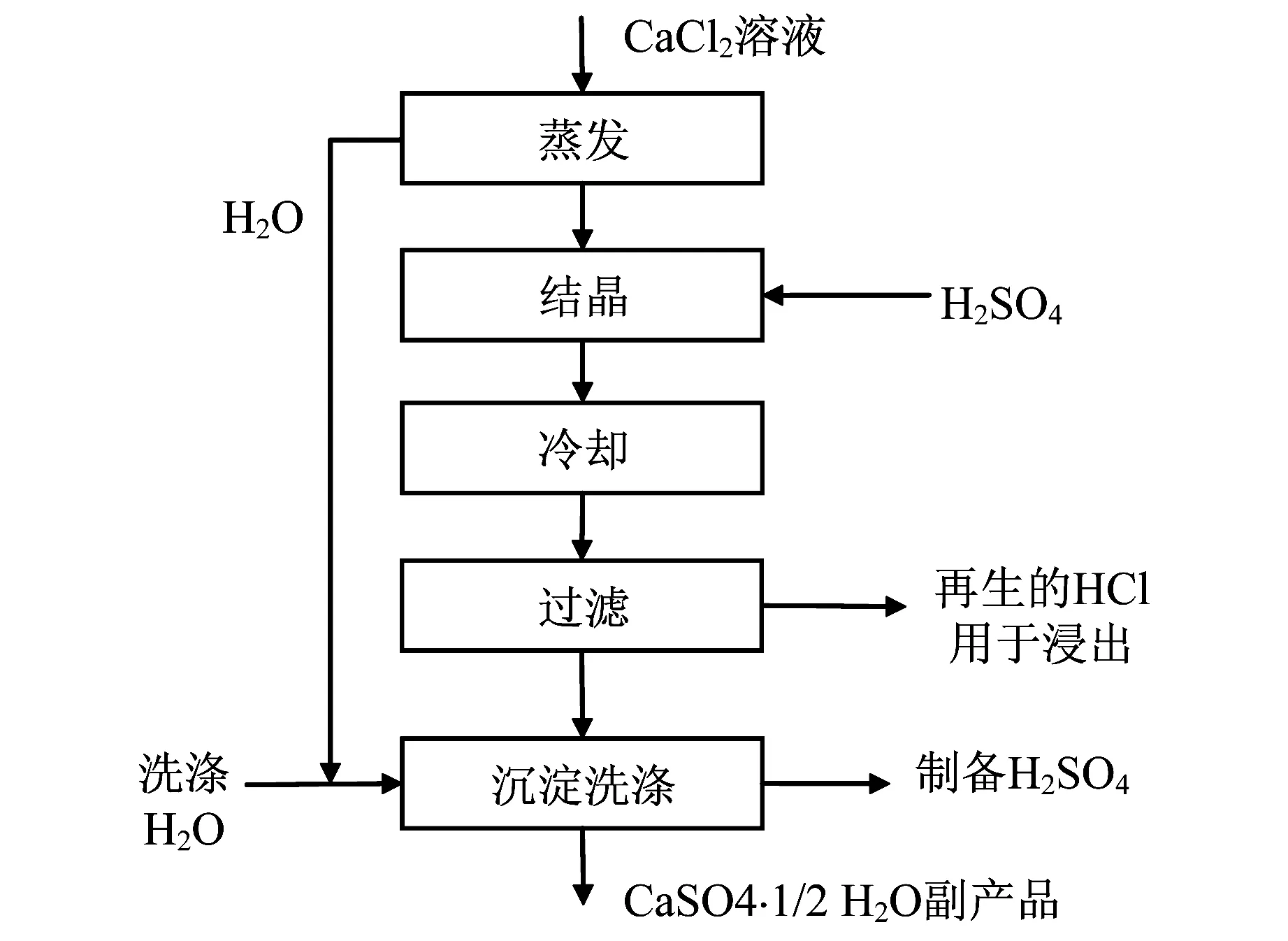
图3 CaSO4水合物结晶再生HCl的流程Fig.3 Process of crystallization of CaSO4 hydrates with regeneration of HCl
2.2 MgSO4水合物
鉴于Jaguar工艺与Intec工艺的不足,Smit 等[15]提出了利用MgSO4水合物结晶的方法再生HCl的Anglo工艺.Anglo工艺的浸出、除杂和有价金属的提取方法与Jaguar工艺相同,在HCl再生部分则以MgSO4水合物结晶的方法取代后者的水解方法.如图4[15]中,MgSO4的溶解度随溶液中MgCl2含量的增高变得很低,同时在较高温度下,溶解度随温度升高而降低.因此,向MgCl2溶液中加入H2SO4会发生以下反应:
MgCl2(aq)+ H2SO4+nH2O=MgSO4·
nH2O(s)+2HCl(aq)
(3)
MgSO4结晶有多种水合物,MgSO4·H2O 是Anglo工艺再生HCl时的目标副产物,因为由MgSO4结晶水合物煅烧制取MgO时,较少的结晶水可以减少能耗.
MgSO4溶液在67.5 ℃以上时饱和析出MgSO4·H2O[16],MgSO4-MgCl2混合溶液在50 ℃饱和析出MgCl2·6H2O、MgSO4·6H2O、MgSO4·4H2O、MgSO4·H2O稳定物相,在75 ℃饱和析出MgCl2·6H2O和MgSO4·H2O稳定物相[17].控制温度和初始MgCl2溶液浓度,反应(3)得到的MgSO4·H2O作为副产品可以出售或者煅烧生成MgO和SO2循环使用,剩余的溶液作为浸出剂用于循环.
对于反应(3),Matthew等[18]研究了65~105 ℃下MgSO4·H2O在FeCl3+MgCl2+HCl溶液中的溶解度.反应生成的MgSO4·H2O纯度和剩余溶液所含各物质的浓度以及用于循环浸出的效果仍需进一步研究.
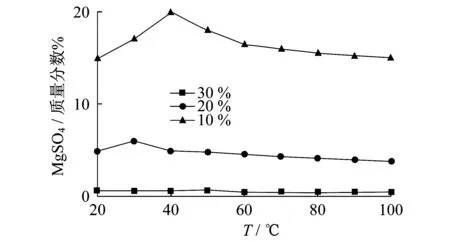
图4 MgSO4在不同质量分数MgCl2溶液中的溶解度Fig.4 Solubility of MgSO4 in MgCl2 solutionwith different concentrations
3 碱式MgCl2沉淀
浸出液中的MgCl2可以用来制取Sorel水泥.Sorel水泥是高浓度的MgCl2水溶液和适量的MgO粉末混合后形成的具有水泥性质的胶凝物.对Sorel水泥的组成和化学性质的研究表明,其主要成分为碱式MgCl2,可以用通式xMgO·MgCl2·yH2O表示,x、y值随形成水泥时的温度和MgCl2质量分数的不同而发生改变.
Sorel水泥高温分解可生成MgO和HCl,Bakker[19]将此方法与红土矿的浸出工艺相结合,用于浸出液中Mg的处理和HCl的再生,并对各温度下不同体积分数的MgCl2溶液中碱式MgCl2的析出物相、各物相的热分解反应进行研究[20-21],结果显示:2型相(2MgO·MgCl2·6H2O)和3型相(3MgO·MgCl2·11H2O)碱式MgCl2在一定温度下分解,可再生得到HCl,分解反应为:
2型相
2MgO·MgCl2·6H2O(s)= MgO(s)+
2MgOHCl(s)+5 H2O(g)(229 ℃)
(4)
2MgOHCl(s)=2 MgO(s)+2HCl(g)(565 ℃)
(5)
3型相
3MgO·MgCl2·11H2O = 2MgO(s)+
2MgOHCl(s)+10 H2O(g)(181 ℃)
(6)
2MgOHCl(s)=2 MgO(s)+2HCl(g)(565 ℃)
(5)
Bakker[19]推测,HCl是由碱式MgCl2分解产生的中间产物MgOHCl进一步分解得到.
为了生成2型相和3型相的碱式MgCl2,以回收利用Mg并再生HCl,必须控制碱式MgCl2形成时的条件,避免其他物相,如Mg(OH)2和9MgO·MgCl2·13H2O的生成,同时,通过添加晶种和控制结晶速率,以确保2型相和3型相的碱式MgCl2过滤性能良好.
以此,Bakker[19]研究设计了红土矿HCl浸出液再生HCl工艺,并对之进行了能耗和效益分析,指出此工艺较Jaguar工艺更具经济性.
4 其他技术
胡启阳等[22]公开了一种从低品位红土镍矿HCl浸出液中提取Mg制备纳米级Mg(OH)2的方法.常温下,将浸出液中的Fe萃取分离;调节pH除Al、Cr;加硫化剂分离浸出液中有价金属Ni、Co、Mn、Cu;加过量草酸铵除Ca;在30~90 ℃下,向浸出液中加碱作为沉淀剂,并加入质量分数为2%~10%的表面活化剂,恒温反应10~120 min,陈化30~240 min,即得到纳米级Mg(OH)2.此法虽然没有考虑到HCl的再生,但是Mg利用率高,工艺简单、能耗低、生产成本低,一定程度上提高了红土镍HCl浸出的经济性.
李新海等[23]提出了一种HCl浸出全闭路循环法从红土镍矿中提取有价金属的方法.通过雾化干燥,焙烧实现HCl再生及Mg、Fe的综合利用.将提取Ni、Co后的MgCl2溶液或MgCl2与FeCl3的混合溶液浓缩,控制Cl的总量>250 g/L,再在200~400 ℃下雾化干燥,得到含有不同结晶水的MgCl2、FeCl3的固体混合物.将混合物进行高温还原焙烧,得到Fe与MgO的混合物,采用磁选实现Fe与MgO的分离,焙烧产生的炙热的HCl气体冷却后吸收生成HCl.此方法中的雾化干燥、焙烧等步骤虽然均有热能回收利用,但是过程中消耗的能量可能使得此方法不经济.
5 结 语
红土镍HCl浸出液中Mg的回收利用和浸出剂的再生有多种方法.MgCl2溶液水解或雾化干燥与焙烧,在能耗方面使之不经济.纳米级Mg(OH)2的制备虽然提高了Mg的回收利用,但是没有考虑HCl的再生,而HCl的消耗是整个浸出工艺的主要经济指标.硫酸盐水合物的结晶在物料的使用和能耗方面都较经济,但是CaSO4水合物的纯度与焙烧产物的活性还需要进一步研究;同样MgSO4水合物的纯度以及剩余溶液的使用也需要进一步研究;对于碱式MgCl2的沉淀,MgCl2-MgO-H2O体系的相图和各物相的热分解反应分析需要进一步研究.只有通过对产物的回收利用及HCl再生过程的本质和经济性分析,才能判断出是否符合工业上浸出液中Mg的回收利用和浸出剂再生的要求.
[1]McDonald R G,Whittington B.Atmospheric acid leaching of nickel laterites review.Part I.Sulphuric acid technologies[J].Hydrometallurgy,2008,91:35-55.
[2]McDonald R G,Whittington B.Atmospheric acid leaching of nickel laterites review.Part II.Chloride and biotechnologies[J].Hydrometallurgy,2008,91:56-69.
[3]石文堂.低品位镍红土矿硫酸浸出及浸出渣综合利用理论及工艺研究[D].长沙:中南大学,2011.
[4]Harris G B,Lakshmanan V I, Sridhar R. Process for the recovery of value metals from material containing base metal oxides:US Patent,0228783 A1[P].2004.
[5]Harris B,White C,Jansen M,etal.A new approach to the high concentration chloride leaching of nickel laterites[C]∥ALTA Nickel/Cobalt 11 perth,Melbourne:ALTA Metallurgical Services,2006:203-223.
[6]Moyes J,Houllis F,Tong A.Recovery of metals from oxidised metalliferous materials:World Patent,093107 A1[P].2005.
[7]Li Z,Demopoulos G P.Solubility of CaSO4phases in aqueous HCl+CaCl2solutions from 283 to 353 K [J].JChem.EngData,2005,50:1971-1982.
[8]Li Z,Demopoulos G P.Effect of NaCl,MgCl2,FeCl2,FeCl3,and AlCl3on solubility of CaSO4phases in aqueous HCl or HCl+CaCl2solutions at 298 to 353 K[J].JChemEngData,2006,51:569-576.
[9]Li Z,Demopoulos G P.Model-based construction of calcium sulfate phase-transition diagrams in the HCl-CaCl2-H2O system between 0 and 100 ℃[J].IndEngChemRes,2006,45:4517-4524.
[10]Li Z,Demopoulos G P.Development of an improved chemical model for the estimation of CaSO4solubilities in the HCl+CaCl2+H2O system up to 100 ℃[J].IndEngChemRes,2006,45:2914-2922.
[11]Amani A O,Demopoulos G P.Gypsum crystallization and hydrochloric acid regeneration by reaction of calcium chloride solution with sulfuric acid[J].Hydrometallurgy,2009,96:95-102.
[12]Thomas F,Demopoulos G P.Phase transformation kinetics of calcium sulfate phases in strong CaCl2-HCl solutions[J].Hydrometallurgy,2012,129-130:126-134.
[13]Thomas F,Demopoulos G P.The crystal growth kinetics of alpha calcium sulfate hemihydrates in concentrated CaCl2-HCl solutions[J].JournalofCrystalGrowth,2012,351:9-18.
[14]Demopoulos G P,Li Z.New technologies for HCl regeneration in chloride hydrometallurgy[J].WorldofMetallurgy-ERZMETALL,2008,61(2):89-98.
[15]Smit J T,Steyl J D T.Leaching process in the presence of hydrochloric acid for the recovery of a value metal from an ore:World Patent,043158 A1[P].2006.
[16]胡福庆.镁化合物生产与应用[M].北京:化学工业出版社,2004.
[17]Chr B,Tepavitcharova S,Rabadjieva D,etal.Solubility and crystallization in the system MgCl2-MgSO4-H2O at 50 and 75 ℃[J].JournalofSolutionChemistry,2001,30(9):815-823.
[18]Matthew W J,Vladimiros G P,Johann D T.Kieserite solubility in the aqueous FeCl3+MgCl2+HCl system between(338 and 378) K[J].JChemEngData,2009,54:1986-1990.
[19]Bakker J.The recovery of magnesium oxide and hydrogen chloride from magnesium chloride brines and molten salt hydrates[D].Kingston:Queen’s University,2011.
[20]Bakker J,Peacey J,Davis B.The phase stabilities of magnesium hydroxychlorides[J].MetallurgicalandMaterialsTransactions, 2012,43(4):758-763.
[21]Bakker J,Peacey J,Davis B.Thermal decomposition studies on magnesium hydroxychlorides[J].CanadianMetallurgicalQuarterly,2012,51(4):419-423.
[22]胡启阳,付芳铭,李新海.低品位红土镍矿盐酸浸出液提镁制备纳米级氢氧化镁的方法:中国,CN 101376510 B[P].2008.
[23]李新海,郭华军,胡启阳.盐酸全闭路法从红土镍矿中提取有价金属的方法:中国,CN 101509072 B[P].2009.
RecoveryofMagnesiumandRegenerationofLixiviantfromHClLeachingLiquidofNickelLaterite
GEYong,HUZun-yu,DINGWei-zhong,TANDing-sheng,GUOShu-qiang
(ShanghaiKeyLaboratoryofModernMetallurgy&MaterialsProcessing,ShanghaiUniversity,Shanghai200072,China)
Abstract:The recent years′ researches on the recovery of magnesium and regeneration of hydrochloric acid from HCl leaching liquid of Nickel Laterite are reviewed and presented in this paper.The processes like hydrolysis of MgCl2solution,crystallization of metal sulfate hydrates, precipitation of basic magnesium chloride, production of nano-sized magnesium hydroxide and spray-roast of MgCl2solution,and the progress of their applications are also introduced in this paper.
nickel laterite; hydrochloric acid leaching; recovery of magnesium; regeneration of lixiviant
1005-2046(2014)01-0033-05
2013-06-11
国家重点基础研究发展(“973”)计划项目(2012CB722805)
葛勇(1989-)男,硕士,主要从事冶金与新材料制备研究.E-mail:geyongnl@163.com.
丁伟中,男,教授,博士生导师.
TF803.25
A

