苏北沿海互花米草入侵盐沼自然移除外源苯乙烯的特征研究
王进欣, 李 超, 郭 楠, 张 威, 王今殊
(江苏师范大学 城市与环境学院,江苏 徐州 221116)
0 引言
苯乙烯是一种低毒有机化学品,具有挥发性,其在环境中长期暴露可致人体产生黏膜和眼睛刺激,肠胃功能紊乱,甚至产生疼痛、疲劳、乏力、抑郁和神经病变,严重危害人体健康,已于1990年被美国“清洁空气修正案”认定为有毒气体[1].中国《GB 14554—93 恶臭污染物排放标准》[2]将其认定为8种恶臭物质之一,并规定厂界大气中苯乙烯的排放限值为3.0 mg/m3(折算为体积分数约为6.46×10-7).大气中苯乙烯主要来自化学和石化工业在聚苯乙烯、苯乙烯-丁二烯橡胶、丙烯腈-丁二烯-苯乙烯共聚物和树脂的生产、应用、运输和储藏过程中的大量排放[3-4],其自然来源来自微生物和真菌代谢[1].
为了有效降低苯乙烯在环境中的浓度和暴露风险,减排措施和增汇技术被广泛研究和使用,并已成为大气控制领域重要的研究课题,常用的处理方法有吸附、吸收、化学氧化和催化燃烧[5-6].相对于这些工业去除苯乙烯技术,苯乙烯的生物修复技术具有应用成本低、生态风险小和对环境副作用小等优点,在修复挥发性有机气体污染方面具有巨大的潜力和显著的优势.但是,目前对苯乙烯的去除技术和生物修复实践主要集中在高浓度和大批量生产流程中,很少有人关注自然环境中低浓度、长期暴露的苯乙烯的环境归趋,导致大气、水体和土壤环境中苯乙烯的环境命运仍然是一个盲点[7-8].对苯乙烯环境命运信息的缺失大大影响了苯乙烯环境暴露风险的有效评估.
海岸带盐沼受海陆的共同作用,接受来自海洋和陆地的物质输入[9],是各种污染物重要的天然汇,在苯乙烯等污染物的环境归趋上具有重要的生态和环境功能.因此,深入研究海岸带盐沼对外源恶臭气体苯乙烯污染物的自然移除能力及影响因素,对认识和探讨海岸带大气、水体和土壤环境中苯乙烯等污染物的环境归趋是非常重要和必要的.
基于此,本文旨在研究互花米草(Spartinaalterniflora)入侵盐沼对外源苯乙烯自然移除能力的时空变化特征,以及盐沼对苯乙烯的自然移除能力是否存在物种依赖性.
1 采样与研究方法
研究样地位于江苏省盐城国家珍禽自然保护区的核心区内(图1),分别于2004年7月(生长季)和2005年1月(非生长季)在固定点采用静态箱法采集气体样品,样地基本情况、采样方法及气体分析方法等详见文献[10].利用二元方差分析苯乙烯的季节变化、空间分布以及收获前后的差异.
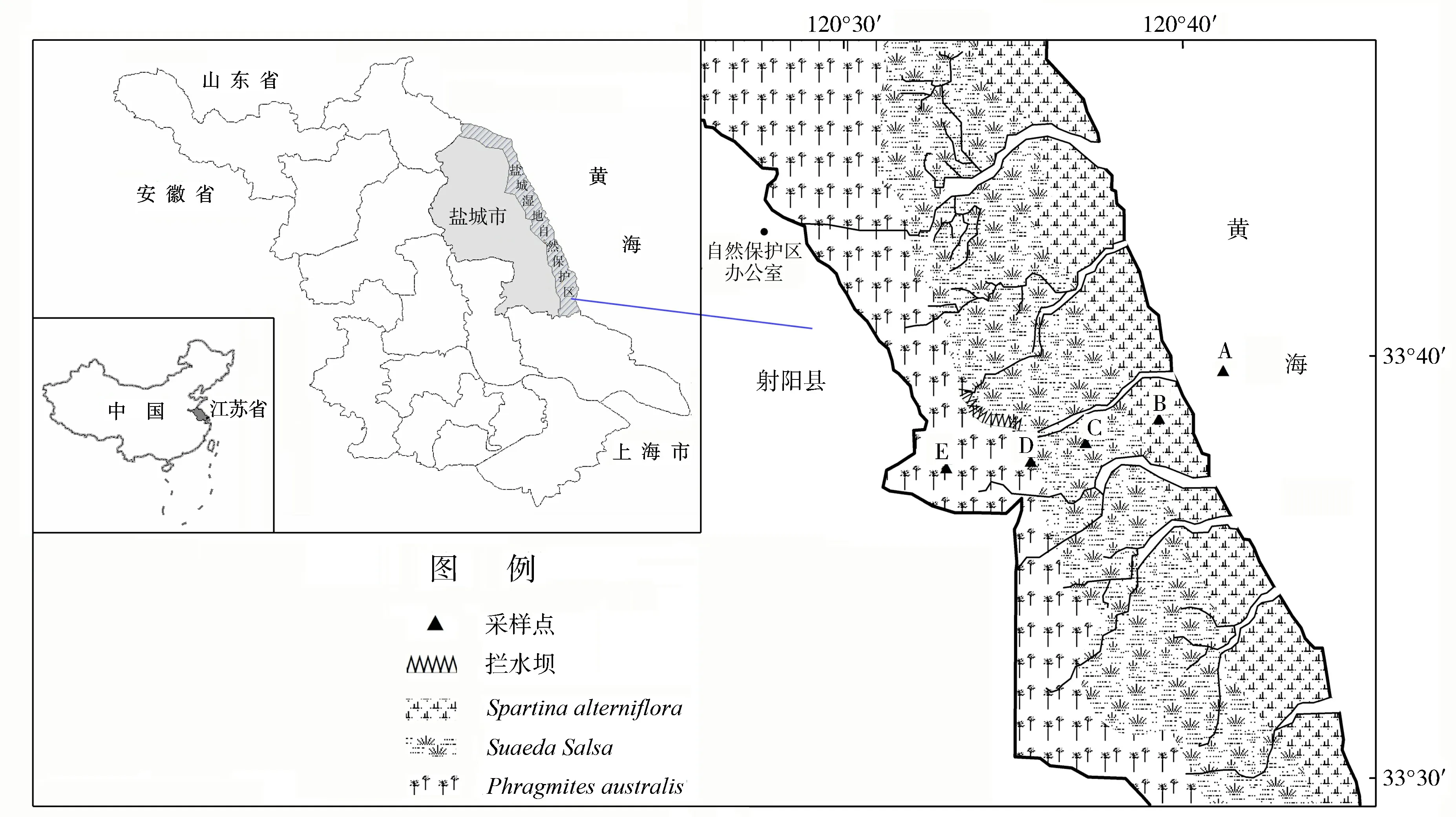
A: 光滩 B: 互花米草盐沼 C: 盐地碱蓬盐沼 D:獐茅盐沼 E: 芦苇盐沼
2 结果分析与讨论
2.1 大气中苯乙烯的浓度变化特征及输入途径
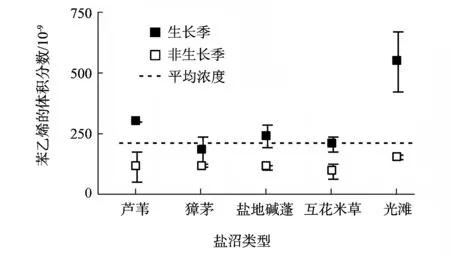
图2 盐沼生态系统中苯乙烯浓度的时空变化
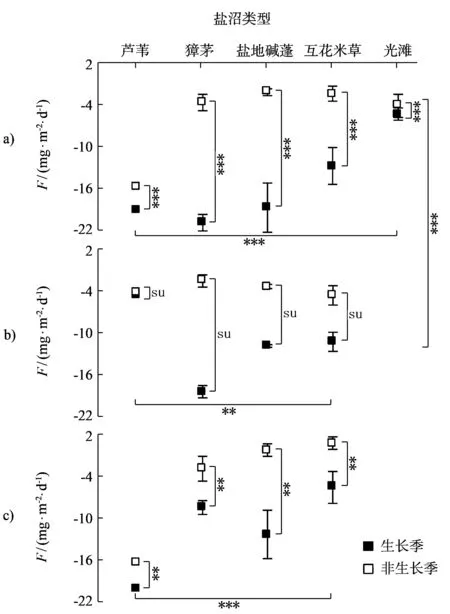
* p<0.05 ** p<0.01 *** p<0.001 nsp>0.5 n=30
盐沼生态系统大气中苯乙烯的年平均体积分数为204.24×10-9,其中生长季和非生长季平均体积分数分别为292.4×10-9和116.1×10-9(图2).自然生态系统中苯乙烯的平均体积分数接近于国家《GB 14554—93 恶臭污染物排放标准》规定的厂界排放源的排放限值,尤其是光滩,其自然大气中苯乙烯的体积分数在生长季高达544.37×10-9,非常接近于国家规定的排放限值[2].大量研究表明,大气中苯乙烯主要源自化学和石化工业排放[3-4],而研究区位于自然保护区,大气中浓度如此高的苯乙烯主要来自那里?
在由陆向海的空间剖线上,大气中苯乙烯的浓度变化表现为两侧高中间低,即在距海陆较近的一侧浓度高,远离海陆的盐地碱蓬带浓度最低(图2).在季节变化上,具有显著的季节变化性,生长季显著地高于非生长季(图2).因此,可以推断本区大气中苯乙烯主要来源于沿海化学和石化工业排放的横向输送(可能包括污染源的大气扩散和输送作用、潮流的水平携带作用)以及外海运输泄漏苯乙烯的横向输送(主要包括大气、海流和潮流的横向输送作用).
2.2 苯乙烯自然移除能力的变化及影响因素
高等植物地上部分去除前,盐沼生态系统对苯乙烯的自然吸收能力具有显著的时空变异性(p<0.001)和明显的物种依赖性,生长季显著大于非生长季.具体表现为:生长季芦苇、獐茅、盐地碱蓬和互花米草盐沼对苯乙烯的自然移除能力分别为-19.1, -20.9, -18.7, -12.8 mg·m-2·d-1,分别是光滩的3.6, 3.9, 3.5和2.4倍;非生长季芦苇、獐茅、盐地碱蓬和互花米草盐沼对苯乙烯的自然移除能力分别为-15.9, -3.7, -2.2, -2.5 mg·m-2·d-1,分别是光滩的3.9, 0.9, 0.5和0.6倍(图3-a).
与其他盐沼相比,互花米草盐沼对苯乙烯自然去除能力并不具有明显的优势.其生长季对苯乙烯自然去除能力分别为芦苇、獐茅、盐地碱蓬和光滩的0.7, 0.6, 0.7和2.4倍,非生长季分别为0.2, 0.7, 1.1和0.6倍(图3-a).综合看来,互花米草入侵替代其他植物并不具有增汇作用,其增汇作用可能体现在向光滩的扩张替代作用.由此可见,尽管互花米草盐沼表现出很好的自然去除能力,但是相对于其他盐沼,互花米草的入侵对苯乙烯并没有起到显著的增汇作用.造成盐沼生态系统自然去除苯乙烯能力时空差异性的主要原因可能有3个:盐沼生态系统组分植物和生理活性,土壤理化性质的异质性和大气中苯乙烯的初始浓度.
首先,高等植物是盐沼生态系统的重要组分,其在盐沼苯乙烯自然去除能力上的作用可能主要体现在3个方面.第一,盐沼高等植物具有丰富的叶片蜡质和气孔等导气组织,已有研究表明,植物叶片蜡质和气孔在植物吸附挥发性有机气体的过程中发挥着重要的作用[11],而且,不同的植物,蜡质成分和气孔数量是不同的,因此,苯乙烯气体的吸附能力必然存在种间差异.第二,植物的光合和呼吸作用等生态过程也会影响其对苯乙烯的自然去除能力,与植物生态过程相关的生态因子也可能通过影响植物生态过程而影响其对苯乙烯的自然去除,这一点在自然移除能力与生态因子的相关程度上具有很好的体现.比如,与植物生长具有直接关系的生物量和光照强度等生态因子与自然去除能力具有显著的正相关作用,这些生态因子对自然移除能力具有正向影响(表1).生态因子的季节变化性和空间分布差异性(图4)也是高等植物对苯乙烯自然移除能力时空差异的重要原因.第三,高等植物的导气作用,可将大气中的苯乙烯输送至植物的根际,为根际土壤吸收和吸附以及以苯乙烯为代谢碳源的共生微生物降解作用创造了有利条件(图3),而且已有研究表明,土壤对苯乙烯的吸附作用非常有利于根际共生微生物的生物分解[7-8].
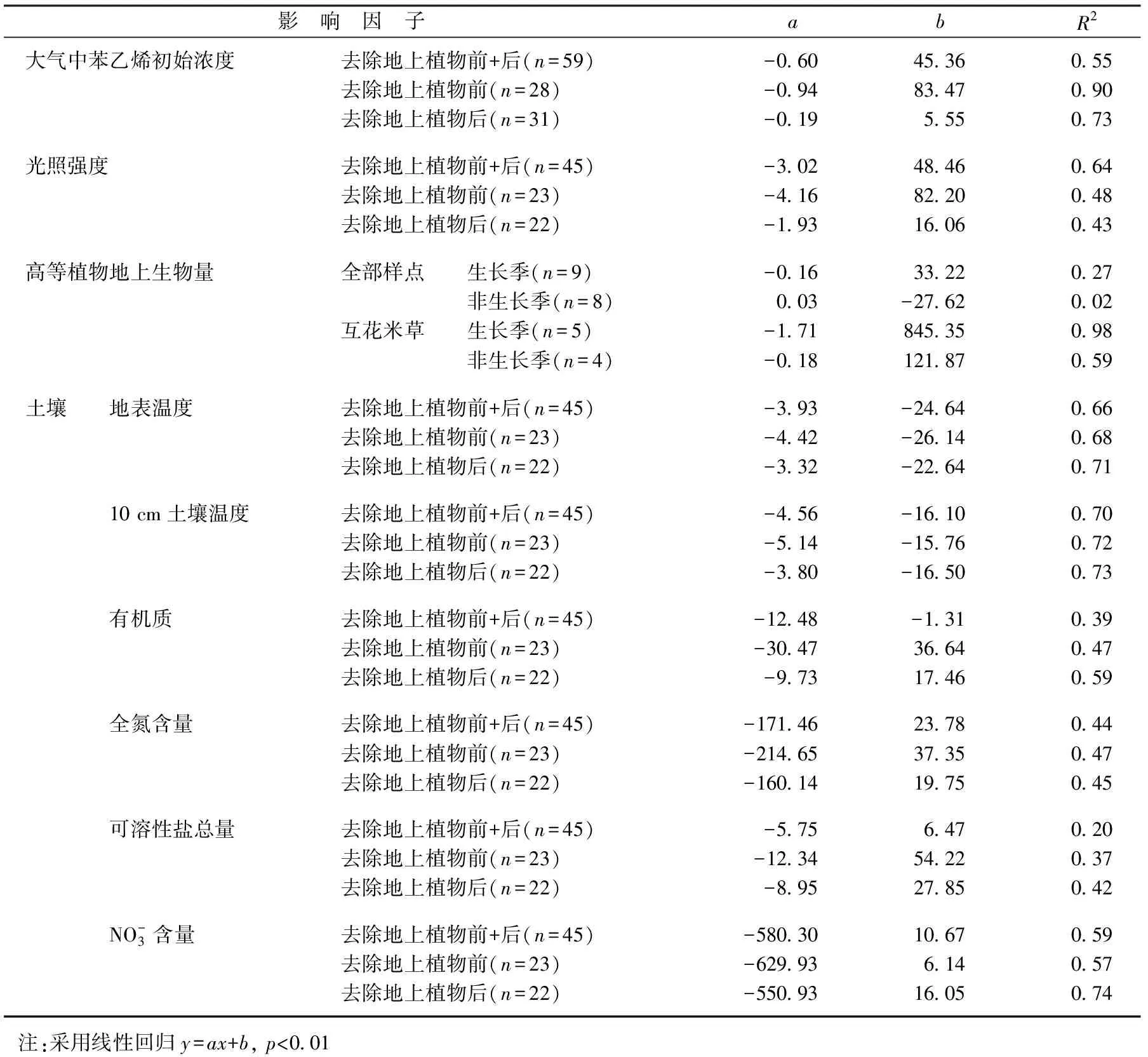
表1 大气中苯乙烯被自然移除的能力与影响因子的关系
其次,土壤和植物根际微环境同样是盐沼生态系统的重要部分,他们对苯乙烯的自然移除能力的贡献主要体现在:第一,土壤的孔隙和土壤胶体对苯乙烯具有重要的吸收和吸附作用,土壤孔隙的丰富度和土壤胶体的交换吸附能力的大小将直接影响土壤对苯乙烯的吸收和吸附能力;第二,植物根际微环境的综合作用,可能包括根际土壤的吸附作用,植物的吸收、吸附和传导作用,根际微生物对苯乙烯的生物降解作用等.高等植物地上部分去除实验结果表明,高等植物地上部分去除后盐沼仍然具有很强的自然移除能力(图3-b),这表明盐沼土壤也是苯乙烯被自然去除的主要贡献者.因此,土壤温度、湿度、孔隙率、有机质含量、全氮含量、盐分含量、硝酸盐含量等土壤理化性质以及生长在其上的植物和微生物的生物活性将很大程度上影响盐沼对苯乙烯的自然移除能力.它们与盐沼对苯乙烯自然去除能力间的正相关关系可以很好地说明他们之间的关系(表1),因此盐沼土壤理化性质的时空差异性也是导致盐沼自然移除苯乙烯能力时空差异的重要因素(图4-b,c,d).
* p<0.05, ** p<0.01, *** p<0.001, nsp>0.5, n=30
第三,大气中苯乙烯的浓度将直接影响其在大气-土壤-植物连续体中的界面行为,尤其是植物内的传导作用和土壤的吸附作用.另外,大气中苯乙烯浓度高本身就是外源输入和局地自然去除综合作用的结果.
2.3 土壤对苯乙烯自然移除能力的时空变化
去除地上植物后,植物根际土壤自然移除苯乙烯的能力仍然表现为很强的自然吸收能力和显著的空间差异性(图3-b),具体表现为:生长季芦苇、獐茅、盐地碱蓬和互花米草盐沼对苯乙烯的自然移除能力分别为-3.3, -14.5, -9.2, -8.7 mg·m-2·d-1,分别是光滩的0.62, 2.71, 1.72, 1.63倍;非生长季芦苇、獐茅、盐地碱蓬和互花米草盐沼对苯乙烯的自然移除能力分别为-15.9, -3.7, -2.2, -2.5 mg·m-2·d-1,分别是光滩的3.9, 0.9, 0.5, 0.6倍(图3-b).去除高等植物地上生物量后,芦苇、獐茅、盐地碱蓬和互花米草盐沼对苯乙烯的去除能力仍然能够保留原来的17.5%,69.4%,49.1%和68.1%.这进一步表明,盐沼土壤是盐沼对苯乙烯自然去除的重要贡献者,盐沼土壤的时空变化也是盐沼自然去除能力产生时空变异性的重要因素.与其他盐沼相比,互花米草盐沼生长季对苯乙烯的自然移除能力分别为芦苇、獐茅、盐地碱蓬盐沼和光滩的2.6, 0.6, 1.0和1.6倍,非生长季自然去除能力分别为芦苇、獐茅、盐地碱蓬盐沼和光滩的1.1, 2.0, 1.4和0.8倍(图3-b).去除高等植物地上部分贡献后,互花米草盐沼的贡献率却明显提高.这从另一个侧面表明,互花米草的入侵并没有起到增汇的作用.
2.4 地上生物量对苯乙烯自然移除能力的时空变化
高等植物地上部分去除后,盐沼生态系统自然移除苯乙烯的能力在生长季显著降低(图3-a,b),由植物地上部分去除造成的自然移除能力差值具有显著的时空差异性(图3).具体表现为:去除地上植物后,生长季芦苇、獐茅、盐地碱蓬和互花米草盐沼对苯乙烯的自然移除能力分别为-15.7, -6.4, -9.5, -4.1 mg·m-2·d-1,分别是去除前自然移除能力的82.5%, 30.6%, 50.9%和31.9%;非生长季芦苇、獐茅、盐地碱蓬和互花米草盐沼对苯乙烯的自然移除能力分别为-12.8, -2.0, -0.2, -0.9 mg·m-2·d-1,分别是去除前自然移除能力的80.4%, 54.4%, 7.1%和36.9%(图3).与其他盐沼相比,互花米草盐沼生长季对苯乙烯的自然移除能力分别为芦苇、獐茅、盐地碱蓬盐沼和光滩的26.0%, 64.0%, 42.9%和76.5%,非生长季自然去除能力分别为芦苇、獐茅、盐地碱蓬盐沼和光滩的7.2%, 45.7%, 587.9%和22.3%(图3-c).即使是在高等植物地上部分的直接影响上,互花米草的入侵对大气中的外源苯乙烯也没有起到增汇的作用.
3 结论与建议
研究区大气中苯乙烯的浓度非常接近国家规定的厂界排放源排放的最大允许值,在海-陆变化梯度上,大气中苯乙烯浓度呈现海陆两侧高和远离海陆中间低的空间变化趋势,由此推断,本区大气中苯乙烯主要来源于沿海化学和石化工业排放的横向输送以及外海苯乙烯的大气、潮水和潮流的横向输送.
海岸带盐沼生态系统本身及其组成部分(盐沼植物和土壤)对外源输入的苯乙烯的自然移除是海岸带大气中苯乙烯的重要汇,海岸带盐沼对外源输入的苯乙烯的自然移除能力具有显著的季节和空间变化性,具有显著的物种依赖性,盐沼土壤对苯乙烯的自然吸收强度大于盐沼植物,高等植物对苯乙烯自然移除能力可能与高等植物生物量、叶面蜡质含量以及气孔丰度有关.而土壤对苯乙烯的自然移除能力可能取决于土壤温度、孔隙度、有机质含量、全氮含量以及可溶性盐总量.
互花米草的入侵并没有增加海岸带盐沼对苯乙烯气体的自然移除能力,没有表现出明显的增汇作用.
综上所述,海岸带盐沼对外源输入的苯乙烯具有重要的移除作用,对外源输入的苯乙烯在盐沼的归趋具有重要的指示作用,可以用来解释与之相关的挥发性有机气体和恶臭气体等污染物的源汇特点和分布.因此,在海岸带管理和生态系统服务功能及生态风险评价中,应该将盐沼生态系统植物和土壤组分在自然移除苯乙烯污染物的能力作为重要的评估指标.
参考文献:
[1] USEPA.Integrated risk information system (IRIS) on styrene.National Center for Environmental Assessment[R].Washington,DC:Office of Research and Development,1999.
[2] GB 14554—93 恶臭污染物排放标准[S].北京:中国标准出版社,1994.
[3] Dehghanzadeh R,Torkian A,Bina B,et al.Biodegradation of styrene laden waste gas stream using a compost-based biofilter[J].Chemosphere,2005,60(3):434.
[4] 王树坤,孙珮石,吴献花.苯乙烯微生物降解的生理、生化、遗传和微生态学特征[J].中国微生态学研究,2007,19(1):105.
[5] 袁青彬,李景义,庞金钊.生物滴滤塔净化苯乙烯废气的实验研究[J].环境工程学报,2012,6(2):589.
[6] Zhang Hongbo,Li Kan,Sun Tonghua,et al.Removal of styrene using dielectric barrier discharge plasmas combined with sol-gel prepared TiO2coated γ-Al2O3[J].Chem Eng J,2014,241:92.
[7] Fu Minhong,Alexander M.Biodegradation of styrene in samples of natural environments[J].Environ Sci Technol,1992,26(8):1540.
[8] Fu Minhong,Mayton H,Alexander M,et al.Desorption and biodegradation of sorbed styrene in soil and aquifer solids[J].Environ Toxicol Chem,1994,13(5):749.
[9] 张茂恒,孙志宏.淮河入湖三角洲的形成、演变及发展趋势[J].徐州师范大学学报:自然科学版,2001,19(3):53.
[10] 王进欣.苏北海岸带盐沼二氯甲烷和1,2-二氯乙烷通量沿高程梯度的变化特征[J].生态学报,2009,29(8):4026.
[11] Treesubsuntorn C,Thiravetyan P.Removal of benzene from indoor air byDracaenasanderiana:effect of wax and stomata[J].Atmos Environ,2012,57:317.
——乌尤尼盐沼

