淋巴管密度与鼻咽癌淋巴结转移的关系
邓 恋 刘陶文 屈元姣 曹轶林 陈 熙 彭丽芳
鼻咽癌(nasopharyngeal carcinoma,NPC)是1种常见的头颈部恶性肿瘤,初诊时发现颈部淋巴结转移者达75%以上[1-2]。淋巴管密度(lymphatic vessel density,LVD)是评估肿瘤淋巴管生成的重要指标。已观察到实体瘤瘤组织周围淋巴管与瘤内淋巴管的分布存在差异,尤其是瘤周淋巴管与肿瘤发生淋巴结转移及患者预后有关[3-4]。但是,关于鼻咽癌淋巴管密度与淋巴结转移关系的研究较少,其临床意义有待明确。本研究应用淋巴管内皮细胞高度特异性和敏感性标记物单克隆抗体D2-40标记鼻咽低分化鳞状细胞癌组织中的淋巴管,以探讨LVD与鼻咽癌患者淋巴结转移的关系。
1 材料与方法
1.1 临床资料
2011年10月至2012年10月,广西壮族自治区南溪山医院肿瘤科收治的、并经病理检查确诊为鼻咽癌患者66例,均为低分化鳞状细胞癌,具有完整的相关临床病理资料;患者均为初治且取组织标本前未接受放化疗;排除存在明显炎症、坏死及严重出血的组织标本。其中男性51例,女性15例,中位年龄48.5岁(19~77岁)。按照我国鼻咽癌2008分期(福州2008分期)标准分期:Ⅰ期1例,Ⅱ期6例,Ⅲ期26例,Ⅳa期27例,Ⅳb期6例,其中T1期2例,T2期11例,T3期31例,T4期22例;N0期11例,N1a期6例,N1b期12例,N2期22例,N3期15例;M0期60例,M1期6例。对照组:30例同期就诊于该院,并经病理检查确诊为轻度鼻咽黏膜炎的鼻咽组织,其中男性18例,女性12例,中位年龄49.5岁(16~78岁)。
1.2 试剂及方法
即用型免疫组化EliVisionTM super 试剂盒(鼠/兔)、商品化即用型D2-40鼠抗人单克隆抗体、DAB显色试剂盒均购自于福州迈新生物技术开发有限公司。石蜡标本经2 μm连续切片,采用免疫组化Elivison二步法,严格按照说明书进行染色。阴性对照组用PBS液代替一抗,以已知阳性反应片作为阳性对照。
1.3 结果判断
D2-40免疫组化染色以细胞胞质或胞膜呈黄色或棕黄色颗粒为阳性,LVD计数采用Weidner等[5]报道的方法,以D2-40染色阳性的单层扁平上皮且管腔内无红细胞聚集的脉管视为淋巴管,D2-40染色阳性的单个内皮细胞或内皮细胞簇同样视为1个淋巴管。瘤周区域为癌细胞团块周围2 mm范围以内的组织区域。先在低倍镜下(10×)分别找到瘤内及瘤周区域阳性脉管的集中区,即“热点”,再在高倍镜下(200×)计数3个视野的淋巴管数量,然后取均值即为LVD。
1.4 统计学方法

2 结果
2.1 鼻咽癌淋巴管的形态特征及分布
鼻咽癌组织D2-40免疫组化染色阳性的淋巴管管腔形状和大小不规则。轻度鼻咽黏膜炎组织D2-40标记的淋巴管散在分布,其淋巴管管腔形状及大小规则。鼻咽癌组织LVD高于对照组,差异有统计学意义(P=0.033)(表1)。

表1 鼻咽癌组织与对照组LVD的比较
鼻咽癌组织中D2-40免疫组化染色阳性的淋巴管主要分布于肿瘤组织周围,尤其是癌组织与正常组织的交界处。瘤周淋巴管管腔呈扩张状态。瘤内淋巴管分布较少或缺如,多呈塌陷或闭塞状态。66例鼻咽癌组织中瘤周LVD明显高于瘤内LVD,差异有显著性意义(P<0.01)(表2)。
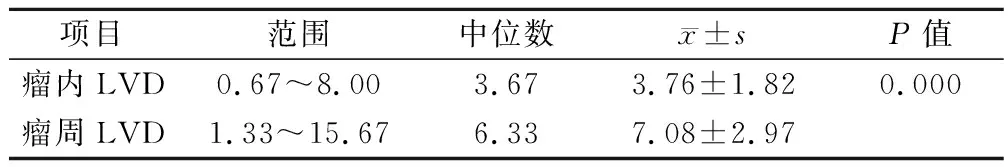
表2 鼻咽癌组织中瘤周LVD与瘤内LVD的比较
2.2 LVD与鼻咽癌组织临床病理特征的关系
鼻咽癌淋巴结转移者瘤周LVD大于无淋巴结转移者,差异有统计学意义(P<0.05);不同年龄、性别、远处转移、临床分期及T分期的瘤周LVD比较,差异无统计学意义(P>0.05);年龄<49岁的鼻咽癌患者与年龄≥49岁的患者瘤内LVD比较有统计学意义(P<0.05);不同性别、T分期、N分期、M分期及临床分期的瘤内LVD比较无统计学意义(P>0.05)(表3)。
2.3 LVD与鼻咽癌淋巴结转移的关系
鼻咽癌瘤周LVD与其N分期有关,N分期越高,瘤周LVD越大(P<0.05),瘤内LVD与N分期无明显相关性(P>0.05)(表4)。
3 讨论
近年研究证实肿瘤组织中存在淋巴管的新生,淋巴管密度是评估肿瘤淋巴管生成的重要指标[6]。有学者报道胰腺癌、上尿路移行细胞癌组织存在淋巴管生成,并认为瘤周淋巴管为功能性淋巴管,瘤内淋巴管为非功能性淋巴管[3-4]。肿瘤细胞可能通过高表达某些促淋巴管生成因子,如VEGF-C诱导肿瘤组织淋巴管的生成,从而对肿瘤的生长、发展及转移提供基础[7]。而且,Shi等[8]通过对大鼠胰腺癌原位移植模型静脉注射或瘤内注射ShRNA靶向阻断VEGF-C结合通路,并应用RT-qPCR和ELISA检测肿瘤组织对VEGF-C的表达,而且借助D2-40、CD31免疫组化标记肿瘤组织中的淋巴管和血管,发现VEGF-C ShRNA可明显移植肿瘤生长和下调VEGF-C mRNA表达,造成肿瘤组织微淋巴管密度减少。

表3 鼻咽癌淋巴管密度与其临床病理特征的关系

表4 瘤周LVD及瘤内LVD与鼻咽癌淋巴结转移的关系
本实验研究结果显示NPC组织LVD显著高于轻度鼻咽黏膜炎的鼻咽组织,这说明鼻咽癌组织存在淋巴管的新生。本组鼻咽癌瘤周LVD明显高于瘤内,迄今认为其机制是肿瘤组织分泌大量的促淋巴管新生分子。而且,瘤周淋巴管呈开放状态,而瘤内淋巴管常呈闭塞或塌陷状态,这与冯正虎等[9]的研究结果一致。推测肿瘤组织周围区域的淋巴管为功能性淋巴管,这有利于肿瘤细胞转移。本研究尚观察到存在淋巴结转移的鼻咽癌瘤周LVD明显高于无淋巴结转移者,尤其是瘤周LVD与鼻咽癌患者N分期升高呈一致性,此可能有助于为鼻咽癌淋巴结转移提供病理生理学基础,其主要机制是瘤周LVD的增加使肿瘤细胞与淋巴管接触面积增大,导致瘤细胞更易于进入淋巴管和向区域淋巴结转移。近来,Bolenz等[10]应用D2-40和CD34双重免疫组化染色65例上尿路移行细胞癌组织,结果显示瘤周LVD分别高于瘤内LVD及周围正常组织的LVD,该学者认为瘤周淋巴管在肿瘤淋巴道转移过程中为功能性淋巴管,而瘤周LVD可作为判断上尿路移行细胞癌预后的指标之一。同时,学者们观察到存在淋巴结转移的口腔鳞癌、输尿管癌组织LVD显著高于无淋巴结转移组,LVD与临床病理特征如肿瘤大小、类型、分级及淋巴管侵犯无明显关系[11-12]。
然而,也有一些结果与上述不一致。例如,Ozardili等[13]观察到瘤内LVD与肾癌的远处转移及淋巴结转移密切相关,但是与该肿瘤的分级、分期及淋巴管的侵犯无明显关系。另有报道宫颈鳞癌、直肠癌中的淋巴管与淋巴结转移无关[14-15],这可能与肿瘤的发生部位、组织学类型及微环境产生的淋巴管生成因子有关。
本研究提示鼻咽癌组织存在淋巴管新生,尤其是瘤周淋巴管在肿瘤的生长、发展过程起到重要作用。然而淋巴管新生对肿瘤发生淋巴结转移的确切病理机制有待研究。肿瘤组织淋巴管新生的研究有益于开拓肿瘤治疗的新策略,如针对肿瘤淋巴管新生的靶向治疗的开发与应用。
[1] Luo DH,Zhou CW,Li EN,et al.Post-radiation CT changes and recurrent nasopharyngeal carcinoma〔J〕.Chin Med J,2008,121(10):916-922.
[2] Bensouda Y,Kaikani W,Ahbeddou N,et al.Treatme-nt for metastatic nasopharyngeal carcinoma〔J〕.Eur Ann Otorhinolaryngol Head Neck Dis,2011,128(2):79-85.
[3] Cheng P,Jin G,Hu X,et al.Analysis of tumor-induced lym-phangiogenesis and lymphatic vessel invasion of pancreatic carcinoma in the peripheral nerve plexus〔J〕.Cancer Sci,2012,103(10):1756-1763.
[4] Bolenz C,Fernández MI,Trojan L,et al.Lymphangiogenesis occurs in upper tract urothelial carcinoma and correlates with lymphatic tumour dissemination and poor prognosis〔J〕.BJU Int,2009,103(8):1040-1046.
[5] Zhang SQ,Yu H,Zhang LL.Clinical implications of incre-ased lymph vessel density in the lymphatic metastasis of early stage invasive cervical carcinoma: a clinical immunohistochemical method study〔J〕.BMC Cancer,2009,9(10):64.
[6] Wang Z,Wu J,Li G,et al.Lymphangiogenesis and biological behavior in pancreatic carcinoma and other pancreatic tumors〔J〕.Mol Med Rep,2012,5(4): 959-963.
[7] Chen SX,Li XY,Kong XL,et al.The expression of vascular endothelial growth factor-C in oral squamous cell carcinoma and its associations with angiogenesis,lymphangiogenesis and lymph node metastasis〔J〕.Hua Xi Kou Qiang Yi Xue Za Zhi,2010,28(3):319-323.
[8] Shi Y,Tong M,Wu Y,et al.VEGF-C ShRNA Inhibits Pancr-eatic Cancer Growth and Lymphangiogenesis in an Orthotopic Fluorescent Nude Mouse Model〔J〕.Anticancer Res,2013,33(2):409-417.
[9] 冯正虎,李春青,杨 兰,等.口腔鳞癌中D2-40表达的特点及临床意义〔J〕.中国组织化学与细胞化学杂志,2009,12(18):701-704.
[10] Bolenz C,Fernández MI,Trojan L,et al.Lymphangiogenesis occurs in upper tract urothelial carcinoma and correlates with lymphatic tumour dissemination and poor prognosis〔J〕.BJU Int,2009,103(8):1040-1046.
[11] De Sousa SF,Gleber-Netto FO,de Oliveira-Neto HH,et al.Lymphangiogenesis and podoplanin expression in oral squamous cell carcinoma and the associated lymph nodes〔J〕.Appl Immunohistochem Mol Morphol,2012,20(6):588-594.
[12] Lee SK,Cho EY,Kim WW,et al.The prediction of lymp-h node metastasis in ductal carcinoma in situ with microinvasion by assessing lymphangiogenesis〔J〕.J Surg Oncol,2010,102(3):225-229.
[13] Ozardili I,Guldur ME,Ciftci H,et al.Correlation between l-ymphangiogenesis and clinicopathological parameters in renal cell carcinoma〔J〕.Singapore Med J,2012,53(5): 332-335.
[14] Xiong Y,Cao LP,Rao HL,et al.Clinical significance of peritumoral lymphatic vessel density and lymphatic vessel invasion detected by D2-40 immunostaining in FIGO Ib1-IIa squamous cell cervical cancer〔J〕.Cell Tissue Res,2012,348(3): 515-522.
[15] Cacchi C,Arnholdt HM,Jahnig H,et al.Clinical significance of lymph vessel density in T3 colorectal carcinoma〔J〕.Int J Colorectal Dis,2012,27(6):721-726.

