慢病毒载体过表达SATB1蛋白对乳腺癌细胞侵袭性的影响
孙正魁 张 超 邹学森 徐宗全 姜桂香 董 赟
特殊富含AT序列结合蛋白1(special AT rich sequence binding protein,SATB1)的表达与乳腺癌的不良预后和化疗耐药相关[1],本研究构建人SATB1 基因慢病毒表达载体,评价其在乳腺癌细胞中的表达水平和对乳腺癌细胞侵袭性的影响,为进一步研究SATB1 在乳腺癌中的作用及机制奠定实验基础。
1 材料与方法
1.1 材料
DMEM 培养基(Gibco,美国);胎牛血清(Hy-clone,美国);GV287 载体(含绿色荧光蛋白GFP)、pHelper 1.0载体、pHelper 2.0载体、293T细胞、PCR引物(上海吉凯基因技术有限公司);Taq 聚合酶(Takara,日本);QIAGEN Plasmid 大抽Kit(QIAGEN,德国);琼脂糖(北京赛百盛基因技术有限公司);DNA ladderMarker(上海捷瑞生物工程有限公司);T4 DNA 连接酶、AgeⅠ、BamHⅠ(NEB,美国);脂质体Lipofectamine 2000 (Invitrogen,美国);Western blot 检测试剂盒(上海碧云天生物技术有限公司);SATB1单克隆抗体(Santa Cruz Biotechnology,美国)。
1.2 方法
1.2.1 SATB1 基因获取和真核表达载体酶切 参考GeneBank 的SATB1 基因序列(NM-002971.4)设计出合成一对SATB1 基因引物。引物序列:上游引物5'-GAGGATCCCCGGGTACCGGTCGCCACCATGGATCATT
TGAACGAGGCAAC-3',下游引物5'-TCCTTGTAGTCCATACCGTCTTTCAAATCAGTATTAATGTC-3'。抽提人SATB1cDNA,并以此为模板进行PCR 扩增。
1.2.2 GV287-SATB1 重组质粒构建、扩增、鉴定 通过限制性内切酶AgeⅠ(ACCGGT)和BamH Ⅰ(GGATCC)使慢病毒表达质粒GV287 载体线性化,通过T4 DNA 连接酶将线性化的载体和DNA 构建为带有目的基因SATB1 序列的质粒载体。连接后的重组质粒转化大肠杆菌感受态细胞,培养筛选后,挑取单克隆并扩大培养以进行PCR 鉴定及测序。
1.2.3 病毒颗粒包装和浓缩 将对数生长期的293T细胞接种于细胞培养皿,培养24 h使密度达70%~80%,加入所制备的各DNA溶液(GV287-SATB1 20 μg,pHelper 1.0载体15 μg,pHelper 2.0载体10 μg)、相应体积的Opti-MEM、Lipfectamine 2 000试剂(100 μl)。收集转染48 h后的293T细胞上清液。离心除去细胞碎片,过滤上清液,离心得到需要的病毒浓缩体积。分装保存病毒浓缩液,-80℃保存。
1.2.4 病毒转染MCF-7细胞 取处于对数生长期的MCF-7细胞接种于6 孔培养板中,待细胞生长融合约70%左右进行转染。共分为3 组:MCF-7细胞对照组;转染单纯含GFP 病毒液组;转染含有目的基因SATB1组。转染条件:每孔1 mL培养基,含10% 胎牛血清,109 TU/mL 病毒液(7 μL),转染12 h 后倒去培养基,PBS 清洗,加入2 mL完全培养基,48 h后更换完全培养基,荧光显微镜下检测转染效率。大量扩增细胞,备用。
1.2.5 Western blot 检测SATB1 蛋白表达 以细胞裂解液裂解筛选后的细胞,提取细胞总蛋白,测定蛋白的浓度,制备SDS-PAGE 胶,每泳道加入20 μg总蛋白,电泳。转至PVDF 膜,5%脱脂牛奶室温封闭2 h,加一抗(SATB1单抗)孵育,4 ℃过夜,次日室温下1 h,PBST 清洗5次,5 min/次,加二抗,室温2 h,PBST 清洗3次,10 min/次;入化学发光剂,暗房曝光。
1.2.6 侵袭实验 采用Transwell小室,取上述3组的细胞,胰酶消化后用DMEM培养液悬浮。调整细胞密度至2.5×105/mL,加200 μL细胞悬液至上室,下室加入30%胎牛血清的DMEM培养液600 μL,每株细胞设3个复孔,24 h后用0.1%结晶紫染色,观察穿过Transwell小室的细胞数量,作为评价侵袭能力的指标。显微镜下计数每个小室的穿膜细胞数,实验重复3次,取均值。
2 结果
2.1 PCR 扩增SATB1
PCR 成功扩增出SATB1 序列的DNA 片段,电泳可见大小约2 333 bp 的特异性条带(图1)。
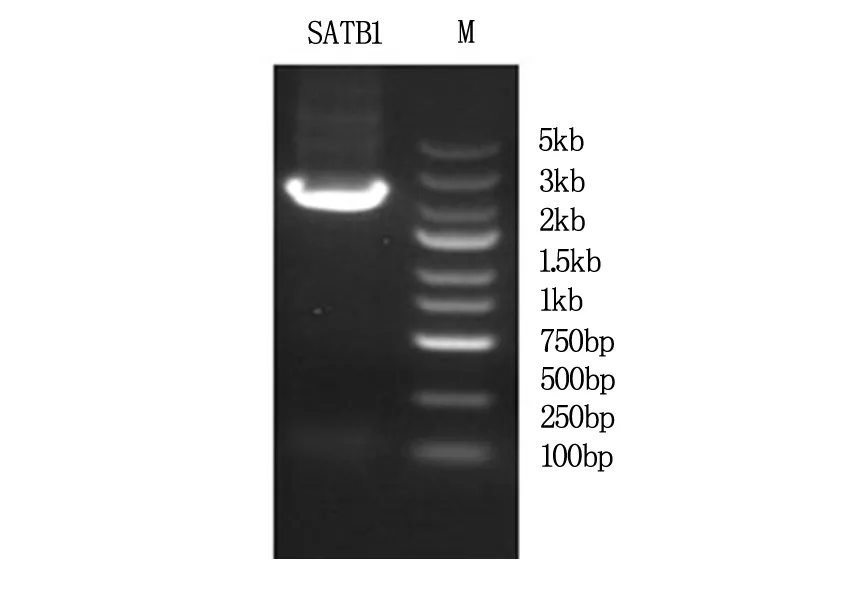
SATB1为2333bp的扩增条带,M为Marker。
2.2 重组质粒的鉴定
提取重组质粒,以KL5911-P3 / EGFP-N-R为引物进行PCR 扩增,得到910bp 的扩增产物,即阳性克隆(图2) 。阳性克隆测序由上海吉凯基因技术有限公司完成,测序结果与目标序列完全一致。
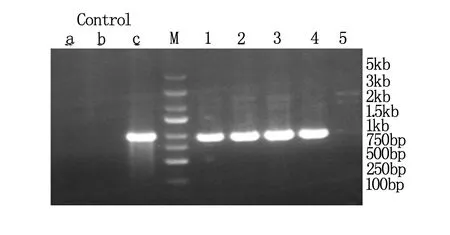
a为阴性对照(ddH2O);b为阴性对照(空载体自连对照组);c为阳性对照(GAPDH);M为Marker;1~5分别为SATB1 1~5号转化子。
图2 电泳鉴定PCR 产物
2.3 转染MCF-7细胞后荧光显微镜观察结果
以完全培养基筛选2周后大量扩增细胞,倒置荧光显微镜(×200)观察发现,转染后的大部分细胞均有GFP 表达,转染效率达70%以上(图3)。
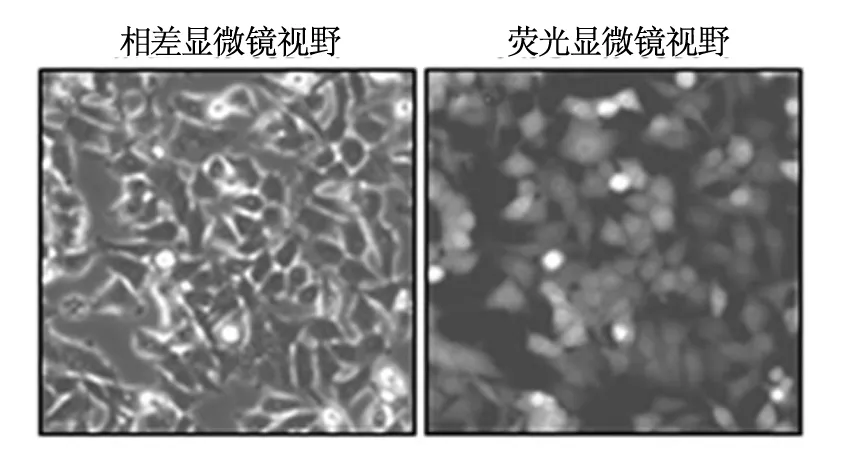
图3 转染后荧光表达情况(免疫荧光×200)
2.4 Western blot 检测SATB1 表达
将转染后的细胞提取总蛋白,β-actin 作为内参,结果显示SATB1 转染组较空白对照组及GFP对照组SATB1表达水平明显上调(图4)。
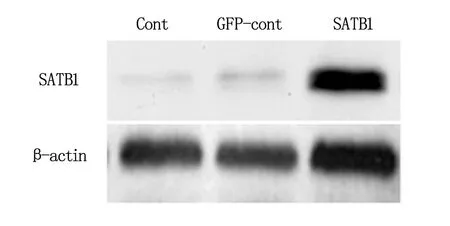
Cont为空白对照;GFP-cont为GFP 空质粒转染组;SATB1为目的基因转染组。
图4 Satb2 表达的Western bolt 结果
2.5 SATB1过表达对MCF-7细胞侵袭性的影响
采用Transwell法检测转染GV287-SATB1的MCF-7细胞的穿膜能力,结果显示SATB1 转染组较空白对照组及GFP对照组的穿膜细胞数显著增加,P<0.01(图5)。
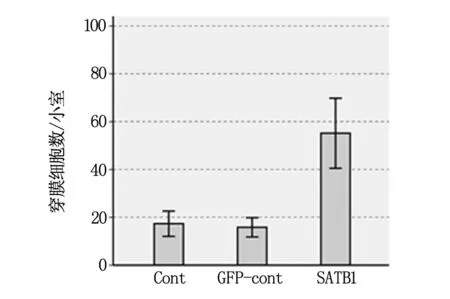
Cont为空白对照;GFP-cont为GFP 空质粒转染组;SATB1为目的基因转染组。
图5 SATB1过表达对MCF-7细胞侵袭性的影响
3 讨论
乳腺癌的发病率逐年上升,现居女性恶性肿瘤首位[2]。采用目前治疗方法,疗效仍不尽如人意,重要脏器的转移是造成乳腺癌死亡的原因,与乳腺癌侵袭转移相关的生物学标志物是目前乳腺癌研究的热点。
SATB1是1种组织特异性表达的核基质结合蛋白,编码基因位于3号染色体3P23区,能以非常高的亲和力与核基质结合区的ATC序列相结合,参与染色质重塑、DNA甲基化和组蛋白乙酰化,调控多种基因表达[3]。Han等用免疫组化的方法发现在人乳腺癌组织细胞核中有SATB1的异常显著表达,进一步研究发现表达水平不仅与乳腺癌的恶性程度呈正相关,而且在其表达的同时能上调乳腺组织中1000余种基因的表达,可能成为控制乳腺癌转移的关键蛋白[4]。因此,研究SATB1在乳腺癌组织中的生物功能具有十分重要的意义。
慢病毒表达载体转染细胞具有能够转染非分裂期细胞,体内较长期稳定的表达,免疫反应小,安全性较好等优点[5]。本研究成功构建表达SATB1蛋白的慢病毒载体GV287-SATB1。该慢病毒载体使用的病毒包装系统由GV287、pHelper 1.0和pHelper 2.0组成。其中,GV287质粒中含有PUbi启动子,能在宿主细胞中持续表达SATB1,同时该质粒能表达由PSV40启动子驱动的GFP,可用于病毒包装时转染效率及感染目的细胞的感染效率的检测,pHelper1.0和pHelper2.0载体则表达病毒结构和包装所需要蛋白。
本研究采用的MCF-7乳腺癌细胞株是从一例69岁的白人女性乳腺癌患者的胸腔积液中分离建立的,该细胞保留了多个分化乳腺上皮的特性,表达雌激素受体,侵袭性较弱[6],是在乳腺癌研究中被广泛应用的代表性细胞株。我们发现GV287-SATB1慢病毒载体能够被高效率的转染MCF-7细胞并在MCF-7细胞中过表达SATB1蛋白,过表达SATB1的MCF-7细胞侵袭性显著增强。为进一步研究SATB1基因对人乳腺癌细胞生物学行为的影响并探讨其机制奠定基础。
[1] Yamayoshi A,Yasuhara M,Galande S,et al.Decoy-DNA against special AT-rich sequence binding protein 1 inhibits the growth and invasive ability of human breast cancer〔J〕.Oligonucleotides,2011,21(2):115-121.
[2] Jemal A,Bray F,Center MM,et al.Global cancer statistics〔J〕.CA Cancer J Clin,2011,61(2):69-90.
[3] Yamasaki K,Akiba T,Yamasaki T,et al.Structural basis for recognition of the matrix attachment region of DNA by transcription factor SATB1〔J〕.Nucleic Acids Res,2007,35 (15):5073-5084.
[4] Han HJ,Russo J,Kohwi Y,et al.SATB1 reprogrammes gene expression to promote breast tumour growth and metastasis〔J〕.Nature,2008,452 (7184):187-193.
[5] Naldini L,BlomerU,Gallay P,et al.In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector〔J〕.Science,1996,272(5259):263-267.
[6] Lacroix M,Leclercq G.Relevance of breast cancer cell lines as models for breast tumours:an update〔J〕.Breast Cancer Res Treat,2004,83(3):249-289.

