乳腺癌组织中HSG和EGFR基因mRNA表达与其临床病理因素的相关性研究
章 骏 赵 怡 王 群 张 舟 邢戍健
乳腺癌是女性恶性肿瘤中最为常见的肿瘤之一,具有高度的异质性,主要体现在其临床特点、病理特征、不同预后及分子生物学的差异[1]。随着医疗技术的进步,分子生物学领域得到很好的发展,为临床早期诊治及预后提供了实验依据。增殖抑制基因(hyperplasia suppressor gene,HSG)亦称作线粒体融合素基因,其主要作用是抑制细胞的增殖,对细胞凋亡产生一定影响[2]。表皮生长因子(epidermal growth factor receptor,EGFR)属于跨膜糖蛋白的1种,酪氨酸激酶型受体,定位在人类的第7号染色体上,主要促进细胞进行有丝分裂[3]。本文通过比较乳腺癌组织及正常乳腺组织中HSG及EGFR的表达情况,分析与乳腺癌患者的临床病理因素的关系,为临床乳腺癌的诊断及预后提供治疗经验,现报告如下。
1 材料与方法
1.1 临床资料
选取2011年1月2012年6月在我院就诊的乳腺癌患者50例作为研究对象,同时选取正常乳腺组织标本40例及乳腺纤维腺瘤组织标本40例,所有组织均取自女性患者,年龄22~67岁,所有乳腺癌患者均经病理检查确诊。浸润型导管癌34例,浸润性小叶癌10例,导管内癌4例及髓样癌2例。TNM分期,其中Ⅰ期、Ⅱ期共29例,Ⅲ期共21例。所有乳腺癌患者未进行过放、化疗干预,术前均未发现远处转移。
1.2 主要试剂
HSG鼠抗人单克隆抗体及EGFR小鼠抗人多克隆抗体均购于武汉博士德生物公司。免疫组化染色试剂盒SP-9000、DAB显色液及磷酸盐缓冲液(PBS)等均购于北京赛驰生物科技有限公司。
1.3 实时荧光定量逆转录-聚合酶链反应
实时荧光定量逆转录-聚合酶链反应监测,乳腺癌组织、乳腺纤维腺瘤组织和正常乳腺组织中HSG和EGFR的mRNA表达情况。
1.4 免疫组化染色
标本用10%福尔马林液固定,常规石蜡包埋,5 μm连续切片,采用免疫组化SP法,染色步骤严格按照试剂盒要求进行,以磷酸盐缓冲液代替一抗作为空白对照,以乳腺癌阳性切片作为阳性对照。应用免疫组织化学方法检测HSG、EGFR在人乳腺癌组织、纤维腺瘤组织、正常乳腺组织中的表达。
1.5 结果判定
以细胞质和细胞膜中有棕黄色颗粒为HSG和EGFR表达阳性细胞。评价HSG和EGFR阳性表达标准采用四级分类方法[4]:无阳性细胞、阳性细胞数≤25%、25%~50%及>50%分别记为0、1、2、3分。同时结合染色强度:无着色细胞、浅黄色、棕黄色、棕褐色分别记为0、1、2、3分。两者分值之和为最后得分:0~1分为阴性,记为(-);2~3分为弱阳性,记为(+);4分为中度阳性,记为(++);5分以上为强阳性,记为(+++)。本研究中所有阴性患者记为(-),所有阳性患者均记为(+)。
1.6 统计学方法
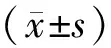
2 结果
2.1 HSG和EGFR基因mRNA表达比较
单因素方差分析表明,正常乳腺组、纤维腺瘤组及乳腺癌组中HSG、EGFR mRNA表达均具有显著性差异(P<0.05),其中乳腺癌组HSG mRNA表达水平显著低于正常乳腺组和纤维腺瘤组(P<0.05),EGFR mRNA表达水平显著高于正常乳腺组和纤维腺瘤组(P<0.05),而正常乳腺组与纤维腺瘤组HSG、EGFR mRNA表达水平无显著性差异,见表1。

表1 各组HSG和EGFR mRNA表达情况
注:与正常乳腺组织及纤维腺瘤组织比较,★为P<0.05。
2.2 不同乳腺组织中HSG、EGFR mRNA表达情况
乳腺癌组HSG mRNA表达率明显低于正常乳腺组和乳腺纤维腺瘤组,差异有统计学意义(P<0.05);乳腺癌组EGFR mRNA表达率明显高于正常乳腺组和乳腺纤维腺瘤组,差异有统计学意义(P<0.05);正常乳腺组与乳腺纤维腺瘤组间比较无显著性差异(P>0.05),见表2。

表2 各组乳腺组织中HSG、EGFR mRNA表达情况比较
2.3 乳腺癌组织中 HSG和EGFR mRNA表达与其临床病理特征的关系
HSG和EGFR mRNA表达与乳腺癌淋巴结转移、病理分级、ER和HER-2表达显著相关(P<0.05);HSG、EGFR mRNA表达与肿瘤大小、临床分期和患者年龄等无明显相关性(P>0.05),见表3。
2.4 乳腺癌组织中HSG与EGFR、HER-2、ER、PR表达的相关性
在乳腺癌组织中,HSG与EGFR mRNA表达呈负相关性,γ=-0.427,P<0.05;与HER-2表达呈正相关性,γ=0.311,P<0.05;与ER表达呈正相关性,γ=0.301,P<0.05;与PR表达无相关性,P>0.05。

表3 HSG和EGFR的 mRNA表达与乳腺癌临床病理特征的关系(例,%)
3 讨论
乳腺癌是女性最常见的恶性肿瘤,众多生长因子、细胞因子及体内激素参与乳腺癌肿瘤的发生、进展及远处组织的转移[5]。随着医疗技术的发展,分子生物学技术在医学领域的应用逐渐增多,大量关于分子标志物与乳腺癌的研究发展迅速,肿瘤特异性基因改变渐渐为人们所认识,越来越多基因最为肿瘤的标志基因被研究,在评估分子标志物与乳腺癌的治疗效果及乳腺癌病理发生机制发挥重要作用[6]。
增殖抑制基因(HSG),主要位于人类1号染色体短臂位置,这一区域的缺失或者易位,会导致机体发生肿瘤[7]。国外研究发现,HSG以激活抗癌基因的表达,有效阻止细胞周期并抑制多种细胞的增殖的作用,同时在细胞凋亡的过程中,也发挥重要作用[8]。本实验中,HSG在乳腺癌组织中的阳性表达率明显低于乳腺纤维腺瘤组织和正常乳腺组织,有研究发现,乳腺癌组织中HSG低表达与淋巴结转移有关,与本研究结果一致[9]。淋巴结是人体免疫的重要防线,同时也是肿瘤远处转移的重要途径,随着肿瘤组织学分级的升高及淋巴结转移的进展,HSG的表达逐渐下降,使正常组织中的细胞增殖分化出现障碍,导致细胞分化不良,细胞随之出现异常增殖倾向。HSG的变达在临床乳腺癌分级及治疗效果评价中可作为重要参考指标。
表皮生长因子受体(EGFR),基因位于7q11.13,是连接糖蛋白中的1种,众多研究证实EGFR的过度表达与细胞的异常增殖有关,与乳腺癌淋巴结转移及TNM分期显著相关,而与发病年龄及肿块大小表现无明显相关性[10]。在多种肿瘤中,EGGR的过度表达,通常伴有癌基因的异常扩增。在不同种类的肿瘤中,EGFR的表达也有差异,肿瘤的分化程度不同,其表达的多少也存在差异,浸润性及分化程度差的肿瘤有较高水平的表达,淋巴结转移者的EGFR的阳性率也较高。本研究结果显示,EGFR阳性表达与肿瘤大小、临床分期、年龄等因素无明显关系,与淋巴结转移和组织学分级等差异显著,有统计学意义。
综上所述,对HSG及EGFR的检测发现,HSG与EGFR的表达呈负相关,通过研究两者之间的相关性及表达关系,能够加深对肿瘤发生、发展过程的理解,对肿瘤的临床防治提供可靠的实验依据,同时对肿瘤的治疗提供更加有效的治疗方案。检测乳腺癌的HSG、EGFR的水平,明确其表达情况,能够准确的评估乳腺癌的分型,判断乳腺癌的生物学行为,更好的为临床提供个性化治疗。HSG和EGFR或许能够成为今后治疗乳腺癌的新的靶点,通过基因转染的方法,抑制肿瘤细胞的增殖,防止因细胞过度增殖导致的肿瘤的发生,对临床治疗恶性肿瘤性疾病提供新的治疗方案及研究方向,有重要的临床意义,值得临床进一步研究。
[1] 李广丽,陈继红,刘校瑾,等.青年乳腺癌和绝经后乳腺癌的病理特点对比分析〔J〕.中华全科医学,2011,9(8):1224,1283.
[2] 付玉环,张自忠,徐泊文,等.乳腺癌中HSG和MMP-2/MMP-9与MVD的关系〔J〕.中国妇幼保健,2012,27(33):5385-5388.
[3] 廖佳建,叶长生,刘民锋,等.青年乳腺癌VEGF和EGFR的表达及其与临床病理的关系〔J〕.重庆医学,2010,39(13):1652-1653.
[4] 刘正泉,薄爱华.VEGF、EGFR和UPA在乳腺癌表达的意义及其相关性〔J〕.中国老年学杂志,2010,30(23):3444-3446.
[5] Rahm AK,Dearing J,Barela B,et al.PS2-30:implementing CHESS eHealth Breast Cancer Support in Population-Based Care〔J〕.Clin Med Res,2013,11(3):160-161.
[6] Kalinyak JE,Berg WA,Schilling K,et al.Breast cancer detection using high-resolution breast PET compared to whole-body PET or PET/CT〔J〕.Eur J Nucl Med Mol Imaging,2014,41(2):260-275.
[7] 张景华,王保信,汪 萍,等.乳腺癌组织中HSG和EGFR的表达及其与临床病理特征的关系〔J〕.实用癌症杂志,2013,28(1):24-27.
[8] Collins IM,Milne RL,McLachlan SA,et al.Do BRCA1 and BRCA2 mutation carriers have earlier natural menopause than their noncarrier relatives results from the kathleen cuningham foundation consortium for research into familial breast cancer〔J〕.J Clin Oncol,2013,31(31):3920-3925.
[9] 张景华,王保信,张德才,等.乳腺癌组织HSG和EGFR基因mRNA表达与临床病理因素相关性分析〔J〕.中华肿瘤防治杂志,2013,20(12):930-934.
[10] 李 毅,张雪霞,李展宇,等.TA方案新辅助化疗对青年乳腺癌中VEGF及EGFR表达的影响〔J〕.中华全科医学,2013,11(7):1027-1029.

