低剂量辐射联合阿霉素对荷乳腺癌裸鼠肾脏组织SOD、GSH-PX和MDA的影响
洪亚琼 鄢 鸿 孟欣欣 李苗苗 金慧实 姜宏宇
(吉林大学第一医院体检中心,吉林 长春 130021)
以阿霉素(ADM)为代表的蒽环类抗肿瘤药物是多种化疗方案中的核心药物,但因严重的肾毒性使其临床应用受限。如何有效降低与防治ADM的肾毒性是目前临床医生面临的重要课题。既往研究表明低剂量辐射(LDR)对机体正常细胞具有兴奋效应和适应性反应,而对肿瘤细胞并不产生这种反应〔1~3〕。体内及体外试验证实:LDR不但不会降低随后放化疗对肿瘤细胞的疗效,反而由于其对正常组织有益的兴奋效应和适应性反应,提高了正常组织对放化疗的耐受和损伤修复能力〔1~5〕。本课题拟探讨LDR联合ADM是否可减轻ADM所致肾脏毒性。
1 材料与方法
1.1细胞株 人乳腺癌细胞株MCF-7由吉林大学第一医院肿瘤科细胞生物学实验室提供。
1.2动物来源及饲养 试验动物为BALB/C-nu/nu品系裸小鼠雌雄各半,体重(21±2)g,购于北京华阜康生物科技股份有限公司(许可证编号:SCXK京2009-0004),饲养于吉林大学公共卫生学院动物中心SPF条件下的超净层流架中。每次试验操作,动物室常规紫外线消毒30 min,更换无菌衣帽,戴无菌手套。定期更换高压灭菌的垫料、鼠笼,添加灭菌处理的食水。
1.3照射条件 美国X-Ray生物辐照器(文件号码:X-RAD320UM-SU);电压199 kV;电流0.2 mA;滤光片2.0 mm铝;全身照射靶皮距60 cm;75 mGy剂量率为12.5 mGy/min。
1.4荷乳腺癌裸鼠移植瘤模型的建立、分组及标本处理 无菌试验条件下,每只裸鼠右后肢背部皮下注射含1×107个细胞的无血清的MCF-7细胞悬液0.1 ml,3~4 d后出现结节,12 d后全部成瘤,当肿瘤长径为0.6~1.0 cm时进行试验。共36只荷瘤裸鼠,随机分为正常对照组,荷瘤假照组(0 mGy),LDR组(75 mGy全身照射),ADM组(ADM腹腔注射40 mg/kg),LDR-6 h-ADM组(LDR后6 h给予ADM 腹腔注射40 mg/kg),LDR-12 h-ADM组(LDR后12 h给予ADM 腹腔注射40 mg/kg),每组6只。
1.5肾脏组织匀浆酶学检测 ADM腹腔注射后4 d,颈椎脱臼法处死裸鼠,剥离左侧肾脏,滤纸拭干,称重,按照重量体积比1∶9加入9倍体积生理盐水(如0.1 g+0.9 ml生理盐水),离心取上清,检测肾组织匀浆中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)活力及丙二醛(MDA)水平(试剂盒购于南京建成科技有限公司),操作步骤按试剂盒说明书进行。
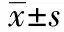
2 结 果
2.1肾组织匀浆中酶学活性检测结果 荷瘤假照组与正常对照组相比,SOD和GSH-PX活力显著降低,MDA水平显著增高 (P<0.05);与假荷瘤照组相比,ADM组SOD、GSH-PX活力均明显下降,MDA水平明显增高,LDR组SOD、GSH-PX活力均显著增高,MDA水平显著降低(P<0.05);与ADM组相比,LDR+ADM组的SOD、GSH-PX活力明显增高,MDA水平明显降低(P<0.05)。见表1。

表1 肾组织酶学检测结果
3 讨 论
目前普遍认为氧自由基引起的氧化应激损伤是ADM毒副作用的主要原因。自由基可以引起线粒体、微粒体脂质过氧化,对多种细胞产生强烈的损伤作用。肾脏氧供应丰富,可产生大量的氧自由基。有研究发现〔6~8〕,肾脏病变的主要发病机制之一即为活性氧对肾脏组织的损伤作用,活性氧也是众多细胞因子损伤肾组织的最终介质,多种肾病患者的肾小球及肾间质活性氧明显增加。因此,抑制氧化应激反应是减轻肾损伤、发挥肾脏保护作用的重要手段之一。
低水平电离辐射对生物体的刺激作用可能对机体有益。LDR兴奋效应可表现为促进生长发育、上调机体抗氧化酶活性、增强免疫功能、促进骨髓造血等〔9,10〕。在研究LDR的兴奋效应的同时,发现预先给予LDR可以对其后给予的高剂量辐射损伤产生保护作用,即适应性反应。正是因为LDR与传统大剂量辐射不同的生物学效应——“兴奋效应”及“适应性反应”,使LDR具有广泛的临床应用前景而倍受放射生物学及临床学者关注。Yamaoka 等〔11〕报道LDR可激活肝组织中的SOD活动,并认为该酶活性增强加速了体内自由基的清除,促进了DNA修复能力,并能减轻其后大剂量辐射对DNA的损伤。Yu等〔12〕发现LDR可诱导机体抗氧化酶系活性增强,促进自由基清除,减轻化疗药物引起的肝脏组织的损伤。LDR对肾脏组织抗氧化酶的影响国内外尚未见相关报道。本研究结果显示LDR可增强机体抗氧化酶系统,使肾脏抗氧化酶SOD、GSH-PX活力增强,脂质过氧化产物MDA生成减少,在ADM处理前应用LDR可以显著增强肾脏组织抗氧化酶SOD、GSH-PX活力,减少MDA的生成。
综上所述,本实验初步认为LDR可增强荷乳腺癌裸鼠肾脏组织抗氧化酶活性,减少脂质过氧化产物生成,抑制氧化应激反应,从而减轻ADM对肾脏组织的损伤,对肾脏具有一定的保护作用。
4 参考文献
1Jiang H, Li W, Li X,etal. Low-dose radiation induces adaptive response in normal cells, but not in tumor cells: in vitro and in vivo studies〔J〕. J Radiat Res,2008;49(3):219-30.
2Jiang H, Xu Y, Li W,etal. Low-dose radiation does not induce proliferation in tumor cells in vitro and in vivo〔J〕. Radiat Res,2008;170(4):477-87.
3Yu H, Liu N, Wang H,etal. Different responses of tumor and normal cells to low-dose radiation〔J〕. Contemp Oncol (Pozn),2013;17(4):356-62.
4Yu HS, Fei CH, Shen FZ. Effects of low dose radiation combined with cyclophosphamide on tumor cell apoptosis, cell cycle and proliferation of bone marrow in tumor-bearing mice〔J〕. Chin J Radiol Med Prot (Chinese), 2004;24:117-9.
5冯乐平, 赵丽纯, 刘柏林. 低剂量辐射对荷瘤小鼠肝脏抗氧化酶的影响及肿瘤组织的病理改变〔J〕. 中国辐射卫生, 2000;1:2.
6Khan SR. Stress oxidative: nephrolithiasis and chronic kidney diseases〔J〕. Minerva Med,2013;104(1):23-30.
7Leung JC, Chan LY, Tang SC,etal. Oxidative damages in tubular epithelial cells in IgA nephropathy: role of crosstalk between angiotensin Ⅱ and aldosterone〔J〕. J Transl Med, 2011;9(1): 169.
8Stanton RC. Oxidative stress and diabetic kidney disease〔J〕. Current Diabetes Rep, 2011;11(4): 330-6.
9Cheda A, Nowosielska EM, Wrembel-Wargocka J,etal. Production of cytokines by peritoneal macrophages and splenocytes after exposures of mice to low doses of X-rays〔J〕. Radiat Environ Biophys, 2008;47(2): 275-83.
10张忠新, 刘建功, 刘红艳, 等. 低剂量电离辐射生物效应研究〔J〕. 辐射研究与辐射工艺学报, 2013;31(5): 1-050101.
11Yamaoka K, Edamatsu R, Mori A. Increased SOD activities and decreased lipid peroxide levels induced by low dose X irradiation in rat organs〔J〕. Free Rad Biol Med,1991;11(3): 299-306.
12Yu H, Yu L, Song A,etal. Effects of low dose pre-irradiation on the toxicity of cyclophosphamide〔J〕. Chin Germ J Clin Oncol, 2011;10(2):70-6.

