青蒿琥酯上调HO-1对老龄脓毒症小鼠急性肝损伤的作用
曹天辉 费东生 潘尚哈 廉志远 桂明国 赵鸣雁
(哈尔滨医科大学附属第一医院ICU,黑龙江 哈尔滨 150001)
脓毒症以及其诱发的脓毒性休克已成为当今重症监护病房(ICU)患者住院死亡率的重要原因〔1〕。老龄患者因机体抵抗力低下,器官功能减退,脓毒症发生后的预后更差。在脓毒症发生与形成过程中,肝脏是最容易受损的器官之一。血红素氧合酶(HO)-1又称热休克蛋白32,是体内血红素代谢主要的起始酶与限速酶。在机体处于应激、创伤、炎症反应以及缺血再灌注损伤时可以通过抗炎、抗氧化、抗凋亡起到对于机体的保护作用。青蒿琥酯(ART)是青蒿素的衍生产物,主要应用治疗重症疟疾以及脑型疟疾,相关的研究发现ART具有抗肿瘤以及一定的抗炎作用〔2〕,但对于其具体的抗炎机制并不十分清楚。本文旨在通过检测ART干预后HO-1表达情况,探讨ART对老龄脓毒症小鼠急性肝损伤的作用机制,为其临床防治脓毒症提供理论依据。
1 材料与方法
1.1试剂 ART粉针剂购于桂林南药股份有限公司,HO-1抑制剂锌普林原IX(ZnPP IX)(sigma,美国),小鼠肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6 ELISA检测试剂盒购于蓝基生物科技有限公司。Western印迹以及免疫组化抗体,兔抗小鼠HO-1多克隆抗体(Santa Cruz,美国)。
1.2方法
1.2.1动物模型及分组方法 72只雄性昆明小白鼠,18~22周鼠龄,体重25~30 g,由哈医大一院动物实验中心提供,小白鼠随机分为假手术组(sham组)、脓毒症组(CLP组)、ART干预组(ART组)、HO-1抑制剂(ZnPP)组,每组18只。各组小鼠分别按6、12、24 h处死时间点分为三个亚组,每组6只。sham组与CLP组术前1 h腹腔内注射等剂量生理盐水,ART干预组术前1 h腹腔内注射ART(15 mg/kg)〔3〕,ZnPP组术前1 h腹腔内注射ART(15 mg/kg)后再注射ZnPP溶液(40 μmol/kg)。造模4 h后sham组、CLP组、ZnPP组分别给予生理盐水1次,ART组给予等体积ART 1次。脓毒症造模方法参照传统CLP模型方法〔4〕,小鼠术前12 h禁食,自由进水,戊巴比妥(40 mg/kg)腹腔注射麻醉,仰卧固定小鼠,术区备皮,常规消毒,于腹正中线做长约1 cm切口,打开腹膜,分离盲肠,用3~0丝线在距盲肠根部1/3处结扎,结扎后保持肠道通路正常,用7号针头分别于盲肠近段和末端各穿一孔,避免穿刺出血,挤出少许粪便于腹腔内,回纳盲肠,分层缝合腹腔。术后即刻背部皮下注射生理盐水1 ml以补充术中液体流失〔5〕。假手术组仅做开腹,分离盲肠远端,但不结扎不穿孔关腹。术后各组小鼠分笼饲养,不禁食不禁水。
1.2.2标本采集 分别于造模后6、12、24 h眼球取血法收集小鼠血液1 ml,3 000 r/ min,10 min离心后取上清于-80℃冰箱保存。取血后脱颈法处死小鼠,迅速打开腹腔,分离肝脏组织。取相同位置肝组织,一部分-80℃冰箱冻存,用于肝组织HO-1蛋白表达检测。另一部分肝组织4%多聚甲醛固定,石蜡包埋、切片,以备光镜下检测肝脏病理学改变和免疫组化法检测肝组织中HO-1表达情况。
1.3各项指标检测 ①应用FR-40全自动生化分析仪检测6、12、24 h血清丙氨酸转氨酶(ALT)、天门冬氨酸转氨酶(AST)水平。②ELISA法检测6、12、24 h血清中TNF-α与IL-6水平,具体操作按ELISA试剂盒说明书要求进行。③Western印迹法检测24 h HO-1在肝脏的表达。-80℃冰箱取出冻存肝组织,称重30 mg,裂解液裂解,制备肝组织匀浆。提取蛋白并纯化,用考马斯亮蓝法进行蛋白定量,各取40 μg蛋白行十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳,80 V、3 h电泳后转入硝酸纤维素膜,应用2%脱脂奶粉(PBS稀释,pH7.14)4℃封闭1 h后滴加HO-1(1∶1 00稀释)一抗过夜,次日3次洗膜后应用辣根过氧化物酶标记的二抗孵育后显影、洗片。
1.4免疫组化法检测24 h亚组HO-1在肝脏的表达 肝组织经4%多聚甲醛固定后,石蜡包埋,切厚度5 μm的切片后进行脱蜡,枸橼酸钠溶液抗原修复,过氧化氢抗原封闭10 min,磷酸盐缓冲液(PBS)冲洗3次,HO-1兔抗小鼠多克隆抗体(1∶100稀释)4℃孵育过夜,次日PBS冲洗3次,每次5 min,滴加羊抗兔二抗,37℃温箱孵育1 h后PBS冲洗3次,DAB法显色,苏木素复染,光镜200倍下观察肝脏HO-1表达情况。
1.5肝组织24 h亚组病理学损伤情况 肝组织4%多聚甲醛固定后梯度酒精脱水,脱钙后石蜡包埋,切片(切片厚度5 μm),行HE染色,在光镜200倍下观察肝脏病理学变化。
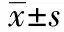
2 结 果
2.1各组小鼠血清ALT、AST水平比较 sham组ALT、AST水平基本处于正常范围,与sham组相比,CLP组小鼠各时相ALT、AST水平升高明显(P<0.05),以24 h亚组ALT、AST升高最为显著。与CLP组相比,ART组血清ALT、AST水平显著降低(P<0.05)。与ART组相比,ZnPP组各时相ALT、AST水平升高(P<0.05),ZnPP组与CLP组各时相ALT、AST表达水平相似。见表1,表2。

表1 各组小鼠血清ALT水平比较

表2 各组小鼠血清AST水平比较
2.2各组小鼠血清TNF-α、IL-6水平比较 sham组TNF-α、IL-6水平基本处于正常范围。与sham组相比,CLP组小鼠各时相TNF-α、IL-6水平升高明显(P<0.05),以24h亚组TNF-α、IL-6升高最为显著。与CLP组相比,ART干预可以显著降低TNF-α,IL-6水平(P<0.05)。与ART组相比,ZnPP组各时相TNF-α、IL-6水平升高(P<0.05),ZnPP组与CLP组各时相TNF-α、IL-6表达水平相似。见表3,表4。

表3 各组小鼠血清TNF-α水平比较

表4 各组小鼠血清IL-6水平比较
2.3Western印迹法检测24 h亚组HO-1在肝脏表达情况 Sham组HO-1几乎没有表达,CLP组脏HO-1表达水平较Sham组升高,可见清晰条带(P<0.05);与CLP组相比,ART组肝脏HO-1表达明显升高(P<0.05);与ART组相比,ZnPP组肝脏HO-1水平表达下降,但与CLP组表达水平相似。见图1。
2.4免疫组化法检测24 h亚组HO-1在肝脏表达情况 HO-1免疫组化阳性结果为黄染颗粒,HO-1表达在肝脏细胞质中。sham组肝脏HO-1表达较少,CLP组肝脏HO-1表达增加,ART组肝脏HO-1表达明显增多,ZnPP组肝脏HO-1表达与CLP组相似。见图2。
2.5各组小鼠肝脏24 h亚组病理情况 光镜下sham组肝组织无明显病理损伤,肝实质结构完整,肝窦结构清晰,无明显充血,无炎性细胞浸润,肝细胞无肿胀,无嗜酸性变性和坏死。CLP组肝细胞坏死肿胀,部分肝窦结构不清晰,肝窦以及汇管区内炎性细胞浸润,可见充血坏死。ART组肝脏炎症减轻,肝细胞变性、坏死减少,肝窦、汇管区炎性细胞浸润减轻,充血减少。ZnPP组肝脏病理结果与CLP组相似。见图3。

图2 免疫组化法HO-1在肝脏表达情况(DAB,×200)
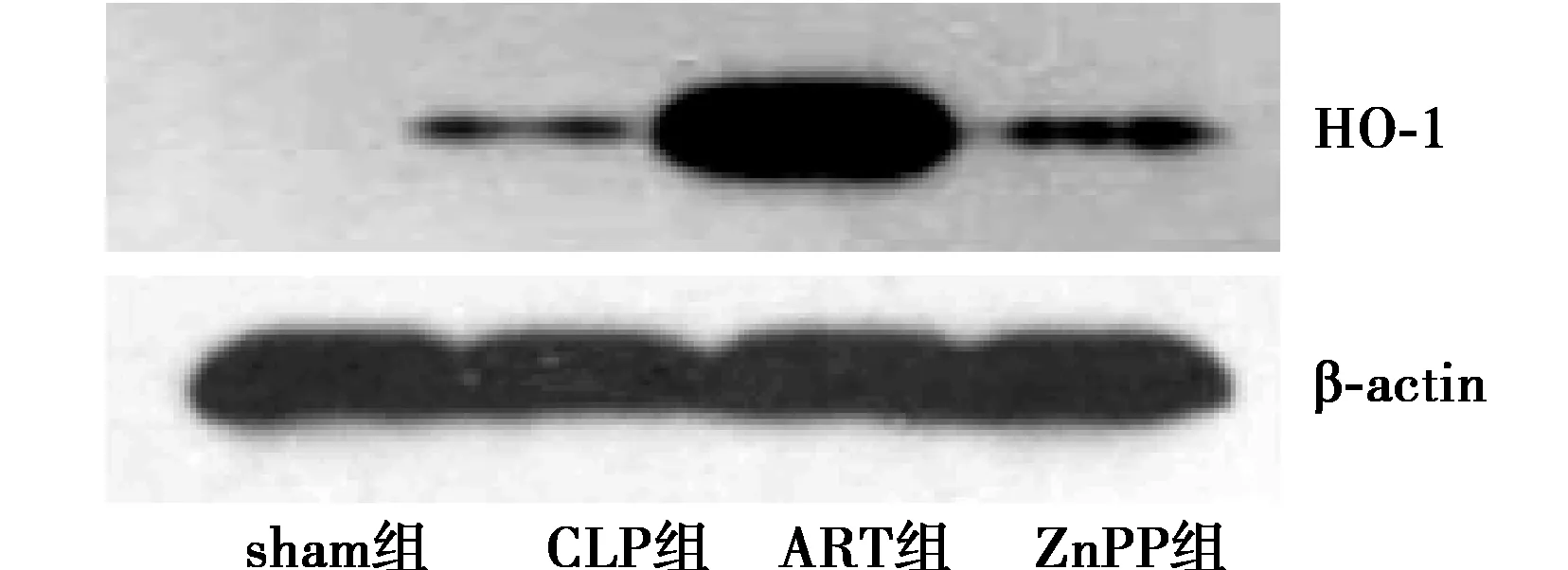
图1 Western印迹法检测肝脏HO-1表达情况

图3 光镜下肝脏病理学损伤情况(HE,×200)
3 讨 论
脓毒症是ICU老年患者死亡的重要原因〔6〕,可进展成严重脓毒症、脓毒性休克甚至诱发多器官功能障碍。在受累器官中,肝脏是最常受损的器官之一。肝脏内富含丰富的酶、凝血因子和组织蛋白质,是机体合成、代谢、解毒的主要场所。当脓毒症诱发肝脏功能受损时,机体会出现严重的甚至不可逆的结果〔7〕。脓毒症发生时,机体会出现炎性因子过量释放,补体的激活,氧化还原反应的失衡,凝血系统与神经体液调节系统的紊乱,上述因素共同作用使得单独控制某方面因素无法有效抑制脓毒症的进展。关于脓毒症研究的各种假说很多,其中最为重要的一个假说为促炎与抗炎反应的失衡(SIRS/CARS)。脓毒症发生早期主要是促炎因子的过度释放,使得全身炎症反应综合征(SIRS)占据主导作用;而脓毒症发生的晚期往往是因机体吞噬杀菌活性减弱,抗原递呈功能受抑的代偿性抗炎反应综合征(CARS)作用的增强作为主导。因此能否控制炎症反应的失衡,即在脓毒症早期抑制过量炎性因子的释放以及在脓毒症晚期促进抗感染免疫功能的恢复是能否控制脓毒症进展的重要因素之一。有研究显示在动物实验中通过上调抗炎因子IL-10以拮抗促炎因子的过度释放起到了对于机体的保护作用。上调炎性因子IL-7能够促进脓毒症晚期免疫功能的恢复。同样具有保护作用的不仅仅是一些抗炎因子,相关文献研究证实通过外源性物质作用体内或通过诱导内源性物质的释放可以减轻脓毒症时的脏器损伤。外源性的物质包括药物,一些气体分子例如氢气(H2)、硫化氢(H2S)、一氧化碳(CO)等,而内源性物质包括Toll-4样受体,乙酰胆碱酯能受体和一些酶类等。
HO-1正是在脓毒症发生时保护机体的酶学之一。HO-1是血红素分解代谢的限速酶,其分解血红素的产物包括Fe2+,胆绿素以及CO。HO有三种同工酶,分别为HO-1、HO-2和HO-3。HO-2和 HO-3主要在生理情况下作用于体内〔8〕,而HO-1在病理情况下释放。大量文献研究显示HO-1及其代谢产物对于脓毒症发生时的机体具有抗炎、抗氧化、抗凋亡的保护作用。除血红素外,某些重金属、热休克、高氧、低氧、紫外线辐射、内毒素等均可诱导HO-1 的产生〔9〕。HO-1广泛分布于各个组织中,在肝脏中HO-1的分布尤为明显。当机体出现应激损伤时HO-1在肝脏表达大量上调,不仅仅分布于Kuffer细胞,在肝实质以及间质细胞中均有明显表达。HO-1的上游调节产物活化蛋白-1(AP-1)以及核因子E2相关因子2(Nrf-2)可以促进HO-1释放〔10〕,HO-1通过核转录蛋白(NF)-κB、丝裂原活化蛋白激酶(MAPK)下的P38、Jun氨基末端激酶(JNK)、细胞外信号调节激酶(ERK)等通路起到抗炎、抗氧化、抗凋亡作用。Morse等〔11〕研究表明HO-1可以抑制NF-κB以及MAPK通路阻断炎症反应的发生,减轻TNF-α与IL-6的释放。南川川等〔12〕研究表明HO-1对于脓毒症小鼠血栓形成有抑制作用,并且HO-1能够防止内皮细胞损伤,减轻肝脏炎症反应,促进肝脏凝血系统功能的恢复。Ryter等〔13〕研究发现HO-1可以减少肝组织丙二醛(MDA)形成,促进肝脏超氧化物歧化酶(SOD)产生,修复肝组织中氧化还原反应的失衡,减轻脓毒症时肝脏的氧化损伤。Ke等〔14〕研究发现HO-1可以抑制Fas通路减轻肝损伤时肝细胞的凋亡。上述研究均已证实HO-1对于脓毒症时受损肝脏的保护作用。
目前对于脓毒症基础研究与药物研究都有很多,人们在研发一些新药治疗脓毒症的同时,一些中医中药和一些传统意义上的“老药”也成为研究的新热点。ART正是这些药物中的一种,目前临床主要应用于重症疟疾、脑型疟疾和类风湿关节炎的治疗中。ART对于耐药性疟疾的治疗更是起到了良好效果,其在疟疾治疗的作用于地位目前尚无可替代。除此以外大量的研究发现ART具有良好的抗肿瘤作用,ART对于胃癌、乳腺癌、卵巢癌、胰腺癌等均有较好的抗肿瘤效应,考虑其机制可能是调控氧化还原反应促进肿瘤细胞的凋亡〔15〕。相关研究发现ART同样具有抗炎作用,曹红卫等〔16,17〕研究报道ART对于脓毒症大鼠急性肺损伤以及脓毒症大鼠急性肝损伤均有保护作用,ART可以协同碳氢酶烯类抗生素发挥抗炎作用〔18〕。ART的免疫调节作用很早前就已经被发现,但是对于ART更具体更深入的抗炎作用研究仍旧缺乏。ART是否通过某些具体通路减轻炎症反应,起到减轻脓毒症脏器损伤的作用。而本研究结果也部分揭示了ART的抗炎作用通路,发现了ART可以通过上调HO-1发挥抗炎作用。
本研究证实制备CLP模型可以诱发小鼠急性肝损伤的发生。肝脏病理学损伤在24 h最为明显,肝脏中HO-1表达水平上调。而给予ART干预治疗后小鼠血清炎症因子水平下降,肝脏酶学损伤减轻,病理学中肝脏结构清晰,肝窦以及汇管区充血减轻,炎细胞浸润减少,肝细胞变性坏死损伤程度减轻。ART具有上调HO-1的作用。通常情况下,当炎症反应发生时,机体自身会释放内源性HO-1起到受损脏器的保护作用,给予ART会上调HO-1的表达,起到外源性促进HO-1释放作用。应用HO-1阻滞剂ZnPP后可以同时抑制机体内源性与外源性HO-1的释放。ART通过HO-1通路来减轻脓毒症时炎症反应、起到器官功能保护的作用。ART是青蒿素的衍生物,药理作用相同,但ART是青蒿素的升级产品。青蒿素只能通过口服途径给药,而ART可以通过静推以及肌注途径给药,这对危重病人更容易实现。尽管ART目前主要应用于重症疟疾以及脑型疟疾的治疗,但我们的研究通过动物模型证实ART也可能对其他原因导致的脓毒症(如腹腔感染等)治疗有效,并从信号转导通路上证实ART通过调节HO-1通路来发挥抗炎作用,也可能为后续研究提供有益帮助和借鉴。
4 参考文献
1Martin GS,Mannino DM,Eaton S,etal.The epidemiology of sepsis in the United States from 1979 through 2000〔J〕.N Engl J Med,2003;348(16):1546-155.
2梁爱华,薛宝云,王金华,等.靑蒿琥酯对内毒素诱导的炎性因子合成抑制作用的研究〔J〕.中国中西医结合急救杂志,2001;8(5):262-5.
3王 宁,刘 鑫,周 红,等.青蒿琥酯对盲肠结扎穿孔术脓毒症小鼠的保护作用〔J〕.中国临床药理学与治疗学,2008;13(10):1095-8.
4Rittirsch D,Huber-Lang MS,Flierl MA,etal.Immunodesign of experimental sepsis by cesal ligation and puncture〔J〕.Nat Protoc,2009;4(1):31-6.
5Caldwell CC,Martignoni A,Leonis MA,etal.Ron receptor tyrosine kinase-dependent hepatic neutrophil recruitment and survival benefit in a murine model of bacterial peritonitis〔J〕.Crit Care Med,2008;36(5):1585-93.
6Coopersmith CM,Wunsch H,Kink MP,etal.A comparison of critical care research funding and the financial burden of critical illness in the United States〔J〕.Crit Care Med,2012;40(4):1072-9.
7栾正刚,马晓春.脓毒症相关肝损伤综述〔J〕.中国实用外科杂志,2012;32(11):959-61.
8Trakshel GM,Maines MD.Multiplicity of heme oxygenase isozymes.HO-1 and HO-2 are different molecular species in rat and rabbit〔J〕.J Biol Chem,1989;264(2):1323-8.
9Yoshida T,Sato M.Posttranslation and direct integration of heme oxygenase into microsomes〔J〕.Biochem Biophys Res Commun,1989;163(2):1086-92.
10MacGarvey NC,Suliman HB,Bartz RR,etal.Activation of mitochondrial biogenesis by heme oxygenase-1-mediated NF-E2-related factor-2 induction rescues mice from lethal Staphylococcus aureus sepsis〔J〕.Am J Respir Crit.Care Med,2012;185(8):8519-619.
11Morse D,Lin L,Choi AM,etal.Heme oxygenase-1,a critical arbitrator of cell death pathways in lung injury and disease〔J〕.Free Radic Biol Med,2009;47(1):1-12.
12南川川,孟祥林,费东升,等,血红素氧合酶-1对老龄脓毒症大鼠微循环及肝脏功能的影响〔J〕.中国老年学杂志,2012;32(7):1403-6.
13Rtter SW,Choi AM.Heme oxygenase-1/carbon monoxid:novel therapeutic strategies in critical care medicine〔J〕.Curr Drug Targets,2010;11(12):1485-94.
14Ke B,Buelow R,Shen XD,etal.Heme oxygenase-1 gene transfer prevents CD95/ Fas ligand-mediated apoptosis and improves liver allograft survival via carbon monoxide signaling pathway〔J〕.Hum Gene Ther,2002;13(10):1189-99.
15母 佩,张厚德,杜冀晖.活性氧在青蒿素及其衍生物抗肿瘤作用机制中的研究进展〔J〕.当代医学,2013;19(16):13-4.
16曹红卫,郭毅斌,魏利召,等.青蒿素对于脓毒症大鼠肝脏脂质过氧化损伤影响.中国临床药理学与治疗学,2006;11(8):911-14.
17曹红卫,郭毅斌,魏利召,等.青蒿素对脓毒症大鼠肺损伤的保护作用.第三军医大学学报,2007;29(10):951-4.
18Jiang W,Li B,Zheng X,etal.Artesunate in combination with oxacillin protect sepsis model mice challenged with lethal live methicillin-resistant Staphylococcus aureus (MRSA) via its inhibition on proinflammatory cytokines release and enhancement on antibacterial activity of oxacillin〔J〕.Int Immunopharmacol,2011;11(8):1065-73.

