男性睾酮及高敏C反应蛋白水平与代谢综合征及其组分的相关性
杨士桂 卢学勉
(温州医科大学附属第三医院内分泌科,浙江 温州 325200)
代谢综合征(MS)是一组由遗传因素与环境因素共同决定的多种代谢疾病,以胰岛素抵抗(IR)为共同病理基础的临床疾病症候群〔1〕。国外相关研究显示男性睾酮(T)水平与MS密切相关;国内对于MS与T关系的研究较少。本文通过检测血清T水平、超敏C反应蛋白(hs-CRP)、腰围(WC)、收缩压(SBP)、舒张压(DBP)、空腹血糖(FPG)、空腹胰岛素(FINS)、甘油三酯(TG)、胆固醇(TC)、血尿酸(UA)等指标然后进行统计分析,以了解MS患者血清T、hs-CRP水平,探讨T水平下降及hs-CRP水平升高是否增加MS及可能的机制。
1 材料与方法
1.1对象与分组
1.1.1研究对象 选取2011年12月至2012年12月在我院内分泌科门诊就诊的男性患者150例,其中MS组85例,年龄40~80〔平均(63.4±14.31)〕岁。非MS组65例,年龄40~80〔平均(63.45±10.09)〕岁。
1.1.2MS的诊断标准 根据2007年中国成人血脂异常防治指南颁布的有关MS的诊断标准〔1〕,符合以下3项者即可诊断为MS。(1)腹部肥胖:男性WC>90 cm。(2)血压≥130/85 mmHg。(3)TG≥1.7 mmol/L。(4)高密度脂蛋白胆固醇(HDL-C)<1.04 mmol/L。(5)FPG≥6.1 mmol/L、餐后2 h血糖≥7.8 mmol/L 或有糖尿病史。
1.1.3排除标准 糖尿病酮症酸中毒、高血糖高渗状态等糖尿病急性代谢紊乱;急性心肌梗死、心肌炎急性期,脑血管意外急性期;风湿性和非风湿性心脏瓣膜病;合并严重感染、甲状腺功能亢进、结缔组织病、严重心力衰竭、肝功能异常及肾功能障碍以及近期使用影响免疫功能药物的患者;恶性肿瘤及血液病患者;1个月内服用性激素者;影响多巴胺能的途径的药物,使用抗生素、毒品、正接受噻唑烷二酮类药物的患者。
1.2研究方法 按要求测定体重、身高、WC、血压。全部入选者均禁食12 h以上于次日清晨空腹测血清T、血清UA、hs-CRP、FINS、TC、TG、HDL-C、低密度脂蛋白胆固醇(LDL-C)、FPG。IR的评价:采用胰岛素敏感性简易参数,稳态模型评估(HOMA)中的HOMA-IR公式来评价IR的程度,HOMA-IR=fpg(mU/L)×FINS(mmol/L)/22.5。本研究对象中,若HOMA-IR超过2.69,则定义为IR〔2〕。
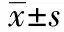
2 结 果
2.1两组一般情况比较 与非MS组相比,MS组体重、体重指数(BMI)、WC、SBP、DBP、TG、TC水平均显著升高,而HDL-C水平降低(均P<0.05)。见表1。

表1 两组一般情况比较
2.2两组年龄与T水平的关系 随着年龄的增加,血清T水平呈逐渐降低趋势,同一年龄阶段内MS组与非MS组睾酮水平比较均存在显著性差异(P<0.05)。见表2。

表2 各年龄组T水平比较
2.3MS组分数量与T、 hs-CRP水平的关系 根据MS诊断标准中存在代谢异常的个数将观察对象分为1组(0个组分)、2组(1个组分)、3组(2个组分)、4组(3个组分)、5组(≥4个组分),随着MS组分数目增加,T水平逐渐下降,而hs-CRP则逐渐升高。当研究对象分别为具有0、1、2、3、≥4个代谢异常时,单因素方差分析显示差异有统计学意义(P<0.05)。见表3。
2.4血清T与MS各组成成分指标Pearson相关性分析 血清T与年龄、BMI、SBP、DBP、FPG、FINS、TG、TC、LDL-C、hs-CRP、UA水平呈负相关(r=-0.481,-0.361,-0.183,-0.212,-0.190,-0.322,-0.314,-0.182,-0.193,-0.594,-0.543,均P<0.05);与HDL-C水平呈正相关(r=0.352,P<0.05)。
2.5多元线性回归分析 以T为因变量,以年龄、BMI、WC、SBP、DBP、FPG、HDL-C、hs-CRP为自变量进行逐步回归分析,结果T与年龄、DBP、WC、hs-CRP呈负相关,而与HDL-C呈正相关(P<0.05)。Y=7.835-1.634a+7.538b-0.194c-0.029d-0.108e (a代表年龄,b代表HDL-C,c代表DBP,d代表WC,e代表hs-CRP)。见表4。

表3 按MS组分分组后血清T、hs-CRP水平比较

表4 T水平和MS相关组分的多元回归分析(以T为因变量)
3 讨 论
MS是由于IR引发的一系列包括肥胖、高血压、高血糖和血脂紊乱、高UA为核心的症候群。由于涉及一系列心血管疾病的危险因素,而这些危险因素相互作用,更增加了心脑血管疾病的相对危险度,故被称为“死亡四重奏”〔3〕。MS患者相对于非MS患者冠心病和糖尿病的危险度明显增加。MS的病因与发病机制尚未完全阐明。近来国外有许多研究强调低雄激素,与MS、糖尿病、冠心病之间的联系〔4〕。最新研究表明,除了中心性肥胖和IR、性腺功能不全也可能是MS的组成部分。Smith等〔5〕报道提示低睾酮水平与MS紧密相关。
随着年龄的增加,男性的血清T水平明显下降,尤其是70 岁以上的老年男性T水平明显下降与先前的研究结果一致〔2〕。T水平降低会伴发一系列身体变化,如脂肪增加、肌肉组织减少、脂代谢紊乱、骨质疏松、免疫力下降等,同时会影响心血管系统及神经系统的功能。
研究〔2,6〕表明男性低T水平与心血管危险因素相关。中心性肥胖可能是低T与心血管危险因素媒介之一。BMI是测量全身脂肪量的很好指标,但不能表明脂肪分布情况,WC是评估中心性肥胖的合适指标,因此T水平的低下提示与肥胖相关,尤其是内脏性肥胖密切相关。
国外有研究表明给予肥胖老年男性生理剂量的睾酮替代治疗12 w后,MRI扫描显示内脏脂肪明显减少〔7〕,但BMI变化不明显,从中可进一步推测T决定脂肪分布。但T替代治疗能否给肥胖男性心血管获益尚有争论。
大量流行病学研究结果显示,2型糖尿病(T2DM)与性激素有密切关系。而IR普遍存在T2DM和糖耐量受损(IGT)中。T水平的过低推测与IR有关。T可通过调节雄激素受体介导的多能干细胞减少脂肪组织的生成,增加肌肉量,故能减少IR〔2,8〕。
高TC、LDL-C和HDL-C是冠心病危险因素,而低T同样是冠心病的危险因素。一系列横断面研究提示低T水平与血脂异常呈相关性〔9〕。富路等〔10〕研究表明,对去势雄兔补充生理剂量的T后HDL-C水平明显升高。Kapoor等〔11〕对伴T2DM的性腺功能减退者予T替代治疗引起TC、TG下降。而2005年的一份荟萃分析则显示生理剂量睾酮替代治疗可降低TC,但对LDL-C却无影响,对HDL-C的作用也不统一〔12〕。T能增加脂蛋白脂肪酶的活性,减少TG向脂肪组织转化,增加TC从周围组织穿梭回到肝脏。生理剂量T对血脂代谢有益,低T引起脂代谢紊乱。
原发性高血压的发病原因至今尚未完全清楚,高血压患者体内有多种激素分泌失衡,其中肾素血管紧张素醛固酮激活为主要原因,而性激素失衡也可能是高血压发生发展的原因之一。本研究显示随着血压的升高,血清T水平呈逐渐降低趋势。这与梁春红等〔13〕研究一致。可能机制为低T水平促进IR,使肾脏水钠重吸收增强,交感神经系统活性亢进,动脉弹性减退,从而血压升高,具体深入机制有待进一步研究。
有研究表明高UA血症的发生率随着年龄的增加而升高,目前认为高UA血症也是MS的组成成分。男性T水平对血UA的影响目前研究较少。本研究中血T水平与UA呈负相关。可能为睾酮促进蛋白质、核酸合成代谢,T水平降低上述物质合成减少,分解增多,促进内源性嘌呤增多,引起高UA血症〔14〕。
近年来越来越多的证据表明慢性、低度炎症状态参与了MS的发病与发展过程〔3〕。hs-CRP作为研究最充分的炎症因子与MS及其各组分的关系尤为密切〔15〕。hs-CRP升高不但可导致IR,还直接参与动脉粥样硬化发生的全过程,hs-CRP已被证实是由慢性炎症引发心血管疾病的独立危险因素〔3〕。
本研究提示睾酮及hs-CRP水平高低与MS组分多少密切相关。当睾酮水平下降,抑制肿瘤坏死因子(TNF-α)作用减弱,TNF-α表达增加,刺激肝细胞CRP mRNA表达,CRP合成增加,促进机体非特异性、慢性炎症反应,导致IR及MS的出现,增加心血管疾病风险。
综上所述,血清T水平低下是男性MS的特征,炎症对MS的发生发展起重要作用。进一步研究男性睾酮,炎症因子的关系及其相互作用机制,对防治男性MS有重要意义。
4 参考文献
1中国成人血脂异常防治指南制订联合委员会.中国成人血脂异常防治指南〔J〕.中华心血管病杂志,2007;35 (5):390-419.
2Pitteloud N,Mootha VK,Dwyer AA,etal.Relationship between testosterone levels,insulin sensitivity,and mitochondrial function in men〔J〕.Diabetes Care,2005;28(7):1636-42.
3陆再英,钟南山.内科学〔M〕.第7版.北京:人民卫生出版社,2008:120-41.
4Fukui M,Kitagawa Y,Nakamura N,etal.Association between serum testosterone concentration and carotid atherosclerosis in men with type 2 diabetes〔J〕.Diabetes Care,2003;26(6):1869-73.
5Smith MR,Finkelstein JS,McGovern FJ,etal.Changes in body composition during androgen deprivation therapy for prostate cancer〔J〕.J Clin Endocrinol Metab,2002;87(2):599-603.
6Holmäng A,Björntor P.The effects of testosterone on insulin sensitivity in male rats〔J〕.Acta Physiol Scand,1992;146(2):505-51.
7Mårin P,Odén B,Björntor P. Assimilation and mobilization of triglycerides in subcutaneous abdominal and femoral adipose tissue in vivo in men:effects of androgens〔J〕.J Clin Endocrinol Metab,1995;80(1):239-43.
8Pitteloud N,Hardin M,Dwyer AA,etal.Increasing insulin resistace is associated with a decrease in Leydig cell testosterone secretion in men〔J〕.J Clin Endocrinol Metab,2005;90(5):2636-41.
9Makinen JI,Perheentupa A,Irjala K,etal.Endogenous testosterone and sefum lipids in middle-aged men〔J〕.Atherosclerosis,2008;197(2):688-93.
10富 路,屈昌芝,高倩萍.睾酮对雄兔血脂代谢的影响〔J〕.中华老年心脑血管病杂志,2008;10(6):462.
11Kapoor D,Goodwin E,Channer KS,etal.Testosterone replacement therapy improves insulin resistance,glycaemic control,visceral adiposity an hypercholesterolaemia in hypogonadal men with type 2 diabetes〔J〕.Eur J Endocrinol,2006;154(6):899-906.
12Isidori AM,Giannetta E,Greco EA,etal.Effects of testosterone on body composition,bone metabolism and serum lipid profile in middle-aged men:a meta-analysis〔J〕.Clin Endocrinol(Oxf),2005;63(3):280-93.
13梁春红,李小鹰,楚新梅.雄激素受体及雄激素在老年高血压患者中的变化及意义〔J〕.中国分子心脏病学杂志,2006;6(4):191-3.
14黄 强,杨振青,滕险峰.老年2型糖尿病合并高尿酸血症及相关因素分析〔J〕.中国预防医学杂志,2009;12:1139-40.
15Corrado E,Novo S.Evaluation of C-reactive protein in primary and secondary prevention〔J〕.J Investig Med,2007;55(8):430-8.

