糖尿病足复发感染病原菌及相关危险因素
付 晗 张 川 孙立娟 李艳华 刘殿媛
(吉林大学中日联谊医院内分泌科,吉林 长春 130033)
糖尿病引起的重要并且常见并发症之一糖尿病足发病较晚,是糖尿病患者住院及影响运动功能的主要原因,给患者、家庭及社会造成严重的影响和负担〔1,2〕。由于糖尿病足感染(DFIs)反复发生后截肢率较高,会出现一系列的心理和运动问题,更加亟需寻找可行及低成本的预防和治疗方法,因此对于引起感染的病原菌的进一步认识有助于帮助医务工作者及时采取措施,尽快控制感染。本研究探讨糖尿病足复发感染的病原菌分布及耐药性情况,并分析复发性感染与糖尿病足病程、病原菌多重耐药性及周围血管病变之间的相关性,探讨多重耐药的产生与近期应用抗生素的关系,为糖尿病足感染的预防及治疗提供依据。
1 资料和方法
1.1一般资料 连续收集2012年1月至2014年1月住院的糖尿病足发生溃疡并感染患者90例,其中男性49例,女性41例,年龄36~85岁,平均(62±1.31)岁。90例糖尿病患者均符合1997年美国糖尿病协会(ADA)制定的糖尿病诊断标准。糖尿病病程12个月~35年(平均8.6年),糖尿病足病程3个月~30年(平均120 d),25例患者均首次感染,65例患者有糖尿病足感染病史。糖尿病足分级按照Wagner分级标准,其中WagnerⅡ级22例,Ⅲ级27例,Ⅳ级35例,Ⅴ级6例。
1.2方法
1.2.1标本采集 生理盐水清洁创口表面,严重者需进行清创术,去除坏死组织,避免杂菌污染,影响对真正病原菌的判断。表浅溃疡用无菌拭子取溃疡底部的脓液或分泌物。深部溃疡用器械从正常和坏死组织的交界处取样,操作过程严格遵守无菌术。样本保存于灭菌试管及时送检,微生物的培养和药敏实验均遵循标准的实验室操作程序。
1.2.2诊断及判定标准 双下肢周围血管病变的判断依据是足背动脉或胫后动脉搏动消失,或者踝臂收缩压比<0.8。糖尿病足溃疡病程的记录方法:溃疡发生至溃疡愈合,或有必要截肢,或观察评价过程结束。是否感染的判定标准以病原菌培养结果为准。
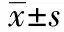
2 结 果
2.1病原菌分布 65例糖尿病足感染复发患者中首次感染细菌培养结果不做分析,其余复发感染99病例次中共培养出140株细菌,其中41例次(41.4%)为混合细菌感染(两种或两种以上病原菌感染)。革兰阳性(G+)菌66株(47.1%),以金黄色葡萄球菌〔31株(22.1%)〕、粪肠球菌〔20株(14.3%)〕和链球菌属〔5株(3.5%)〕为主;革兰阴性(G-)菌55株(39.3%),以大肠埃希菌〔21株(15.0%)〕、绿脓假单胞菌属〔11株(7.9%)〕、肺炎克雷伯菌〔9株(6.4%)〕及变形杆菌属〔8株(5.7%)〕为主,其他19株(13.6%)。
2.2耐药性分布 110菌株(78.6%)对2种及2种以上抗生素具有耐药性。G+球菌对万古霉素较敏感(表1);G-菌对头孢氨苄、头孢噻肟、红霉素等耐药严重,对帕尼培南较敏感,耐药相对较低(表2)。
2.3相关危险因素 复发的糖尿病足感染发生在同一位置或不同位置的共65例(72%);36例有2次感染,24例有3次感染,5例有4次感染发生,99例次为复发感染。大部分感染仅发生在软组织,但有4例(4%)患者经骨组织培养,证实有骨髓炎的发生。
经过统计学分析发现,溃疡未愈合时间超过60 d(χ2=6.330,P<0.05),出现多重耐药性(χ2=12.631,P<0.05),外周血管病变致下肢缺血(χ2=9.498,P<0.01)与复发感染相关。90例患者中有79例(88%)患者在近30 d内应用过抗生素治疗。多重耐药菌株出现的频率与近期应用抗生素治疗之间有显著相关性(χ2=30.877,P<0.01,Fisher校正)。

表1 主要G+菌耐药性检测结果〔株数(%)〕

表2 主要G-菌耐药性检测结果〔株数(%)〕
3 讨 论
糖尿病足溃疡可引起外周感觉运动神经病变,外周血流量不足和机体免疫功能损害导致大部分的足部溃疡会发生感染。糖尿病足反复感染是导致糖尿病足患者截肢且具有潜在生命危险性的并发症,不但给患者造成痛苦,而且增加巨大的经济负担。
3.1病原菌及多重耐药性 目前国内外的研究报道糖尿病足感染的病原菌与G+菌为主〔3〕,但也有以G-菌居多的〔4〕。考虑原因为抗生素的应用、环境条件有所差异等。糖尿病足感染中,与表浅组织相比,深部组织和骨组织的感染经常由多种病原菌引起,如金黄色葡萄球菌、B组链球菌、肠球菌、兼性G-杆菌、G+厌氧球菌、拟杆菌属,混合感染经常是由以上细菌的累积作用所引起的。
本研究发现病原菌多重耐药性的出现与近期应用抗生素有关。这与Kandemir等〔5〕的研究结果一致。多重耐药性的产生原因:滥用抗生素,慢性病程,经常住院治疗。被认为是人体皮肤正常菌群的G-细菌,如铜绿假单胞菌,可能会使糖尿病足患者产生严重的感染〔6〕。病原菌的耐药性不是固有的而是获得性的,先前的病原菌可经过DNA突变或通过质粒、转位子等基因组分获取另一种DNA,来获取耐药性。传递耐药性的质粒可包含大约10种抗药基因〔7〕。因此具有多重耐药性病原菌的感染在需要更长时间治疗的同时,要保证应用合理的抗生素及合适的剂量。
3.2相关危险因素 以微循环甚至大血管阻塞为特征的周围血管病变的出现,延缓糖尿病患者溃疡疮口的愈合。溃疡疮口无法愈合可归结为,一方面是由于血流量的降低,另一方面是由于生长因子和细胞因子的异常表达。有研究还发现下肢缺血能够增加感染的严重程度。糖尿病患者经常会缺失对于损伤或感染的炎症反应特点,由于缺血,可能此症状会进一步严重。血流的降低会减少皮肤红肿或硬结等能提示感染发生的特征;尤其是在有疼痛或温度感觉缺失的神经病理疾病中,会迟缓患者对于感染的警觉。病例对照研究〔8〕发现,对于脚部溃疡感染的患者,炎症的外部表现是糖尿病患者就医的主要原因,而非疼痛。周围血管病变的出现还可以是抗菌药物无法到达病变部位,不但感染无法控制,而且可能促进筛选出耐药菌,并有助于多重耐药菌感染的出现。
有研究〔9〕发现溃疡未愈合超过30 d是感染发生的重要危险因素,本研究发现溃疡未愈合超过60 d会使感染反复发生的概率增加。影响慢性溃疡愈合的一个重要因素就是生物膜的形成。生物膜是附着在有生命或无生命物体表面的由细菌自身产生的多聚基质包裹的菌细胞结构群体, 大部分的慢性感染疾病,包括与慢性疮口有关的细菌感染,都是由生物膜介导〔10〕。因此传统的治疗方案对于包裹在生物膜内的细菌是疗效甚低的,且慢性溃疡大部分都会演变为混合感染。如今,处理生物膜最有效的方式就是定期对于糖尿病足溃疡进行清创。
多重耐药性的出现也同样会增加感染复发的可能性。耐药性的产生必然会导致抗菌药物疗效的降低,并有利于生物膜的形成,使大量耐药性病原菌得以存活,引起感染的反复发生,进而更加延长病程,增加住院时间及院内感染的机会。事实上,糖尿病足溃疡所感染的耐药性病原菌,在经过健康人员处理疮口敷料之后,如果操作不当,会很容易传递给下肢有溃疡未感染的患者。糖尿病足溃疡复发感染病程长,更加需要制定合理的抗生素治疗方案。
4 参考文献
1Amini M, Davati A, Piri M. Assessment of diabetic foot ulcers predisposing factors and its outcomes on patients with diabetic foot syndrome hospitalized in hazrat Rasoul-e-Akram in Tehran during 1996-2001〔J〕. Iran Uni Med J,2004;39(1):77-84.
2Armstrong DG, Lipsky BA. Diabetic foot infections: stepwise medical and surgical management〔J〕. Int Wound J,2004;1:123-32.
3刘建烽, 冉建民,刘 薇, 等. 糖尿病足溃疡面细菌培养及药敏特点分析〔J〕.临床医学工程,2012;19(1):32-5.
4Ramakant P, Verma AK, Misra R,etal. Changing microbiological profile of pathogenic bacteria in diabetic foot infections: time for a rethink on which empirical therapy to choose〔J〕? Diabetologia,2011;54(1):58-64.
5Kandemir O, Akbay E, Sahin E,etal. Risk factors for infection of the diabetic foot with multi-antibiotic resistant microorganisms〔J〕. J Infect,2007;54:439-45.
6Zubair M, Malik A, Ahmad J,etal. A study of biofilm production by gram-negative organisms isolated from diabetic foot ulcer patients〔J〕. Biol Med,2011;3(2):147-57.
7Gold HS, Moellering RC. Antimicrobial-drug resistance〔J〕. N Engl J Med,1996;335:1445-53.
8Lavery LA, Armstrong DG, Quebedeaux TL,etal. Puncture wounds: normal laboratory values in the face of severe infection in diabetics and non-diabetics〔J〕. Am J Med,1996;101:521-5.
9Malik A, Mohammad Z, Ahmad J. The diabetic foot infections: biofilms and antimicrobial resistance〔J〕. Diabetes Metab Syndr,2013;7(1):101-7.
10James GA, Swogger E, Wolcott R,etal. Biofilms in chronic wounds〔J〕. Wound Repair Regen,2007;16(1):37-44.

