ERCC1基因多态性与铂类联合方案治疗晚期肺腺癌患者疗效及预后的研究
原发性支气管肺癌(简称肺癌)是最常见的恶性肿瘤之一,发病率和死亡率在恶性肿瘤中居首位。肺癌中最常见类型为非小细胞肺癌(NSCLC),很多患者确诊时已为晚期,晚期非小细胞肺癌的治疗主要采用以化疗为主的综合治疗。目前以铂类为基础的化疗方案作为综合治疗的重要组成部分是治疗晚期NSCLC的主要方法。铂类药物主要是通过引起DNA损伤而发挥其抗肿瘤疗效,其引起的DNA损伤主要由核酸切除修复(Nucleotide excision repair,NER)通路修复,该途径的DNA修复能力与铂类药物的疗效及预后关系密切[1]。本研究探讨了在晚期NSCLC中ERCC1基因多态性与含铂类方案化疗疗效及预后的相关性。
1 材料与方法
1.1 研究对象
选取江西省人民医院2012年4月至2013年11月收治的经组织病理学或细胞学诊断的Ⅲb-Ⅳ期肺腺癌患者50例,经CT扫描证实肺部具有可测量的肿瘤病灶。50例中男性14例,女性36例,平均年龄56岁(45~78岁)。临床分期:Ⅲb期26例,Ⅳ期24例。化疗前患者体力评分采用ECOG(美国东部协作肿瘤组)评分为0~1分。血常规、肝肾功能及心电图均正常。
1.2 ERCC1基因检测实验方法
基因组DNA的提取:化疗治疗开始前,经患者同意进行遗传标志物与疗效相关研究,并自愿捐献3 ml静脉血用于提取基因组DNA。采用DNA试剂盒(购自乐悠生物科技有限公司)提取外周血基因组DNA。引物系列:C8092A:上游引物5'-ACAGTGCCCCAAGAGGAGAT-3',下游引物5'-AGTCTCTGGGGAGGGATTCT-3',扩增产物204 bp;ERCC1 118:上游引物5'-GCAGAGCTCACCTGAGGAAC-3',下游引物5'-GAGGTGCAAGAAGAGGTGGA-3',扩增产物199 bp。引物由乐悠生物科技有限公司合成。PCR反应条件;94 ℃预变性3 min;94 ℃ 30 s、58 ℃ 30 s、72 ℃ 45 s,共30个循环;72 ℃再充分延伸7 min后置4 ℃冰箱保存。酶切处理体系及电泳:对C8092A采用限制性内切酶BstEⅡ(购自乐悠生物科技有限公司)进行酶切、100V 电泳50 min。C8092A基因为A/A型获得酶切产物片段大小为116 bp和88 bp 2个片段;C/T型则获得204 bp、116 bp和88 bp 3个片段;而C/C型则只有204 bp 1个片段。对ERCC1 118采用限制性内切酶BsrD Ⅰ(购自乐悠生物科技有限公司)进行酶切、100 V 电泳50 min,为C/C型则检测获得片段大小为208 bp;C/T型,则为128和208 bp;T/T型,则为128 bp。
1.3 化疗方案
顺铂75 mg/m2,静脉滴注第1天,长春瑞滨25 mg/m2,静脉滴注第1、8天,21天为1个周期,共4个周期。化疗结束后4周复查目标病灶CT,根据世界卫生组织实体瘤疗效评价标准进行疗效评价。
1.4 疗效评估
按世界卫生组织实体瘤疗效评价标准:近期疗效分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、恶化(PD)。参考国内外同类研究,设定CR+PR为有效,SD+PD为无效。另观察无进展生存期(progression for survival,PFS)。患者的随访资料来源于门诊和病房的病历资料。随诊工作主要由本课题组成员随诊组完成。对于在随访截至日期无进展的病例,在统计时作为删失数据。
1.5 统计处理
应用SPSS17.0软件进行分析。检验水准α=0.05,应用卡方检验或Fisher’s精确概率法分析计数资料;采用Kaplan-Meier法对生存资料进行统计描述,运用Log-Rank检验比较各因素水平间生存率,采用Cox比例风险回归模型分析法进行多因素生存分析。
2 结果
2.1 ERCC1 C8092A、118位基因型频率
50例晚期肺腺癌患者ERCC1 C8092A位点CC、CA和AA基因型频率分别为: 42.0%(21/50)、24.0% (12/50)、34.0%(17/50);ERCC1 118位点 CC、CT和TT基因型频率分别为: 36.0%(18/50)、28.0%(14/50)、36.0%(18/50)。不同年龄、性别、吸烟状况、临床分期患者间ERCC1 C8092A、118多态性均无统计学差异(P>0.05)(表1)。
2.2 ERCC1 C8092A、118多态性与疗效的相关性
50例肺腺癌患者经疗效评价后,CR为0例,PR为 14例(28.0%),SD 为24例(48.0%),PD 为12例(24.0%),总有效率(CR+PR)为28.0%。ERCC1 C8092A CC和CA+AA基因型患者疗效比较,差异有统计学意义(P=0.00)。ERCC1 118位点CC和CT+TT基因型患者疗效比较,差异有统计学意义(P=0.00) (表2)。ERCC1 2个位点同为CC型患者疗效与其它基因型患者比较无统计学差异(P=0.76)(表3)。
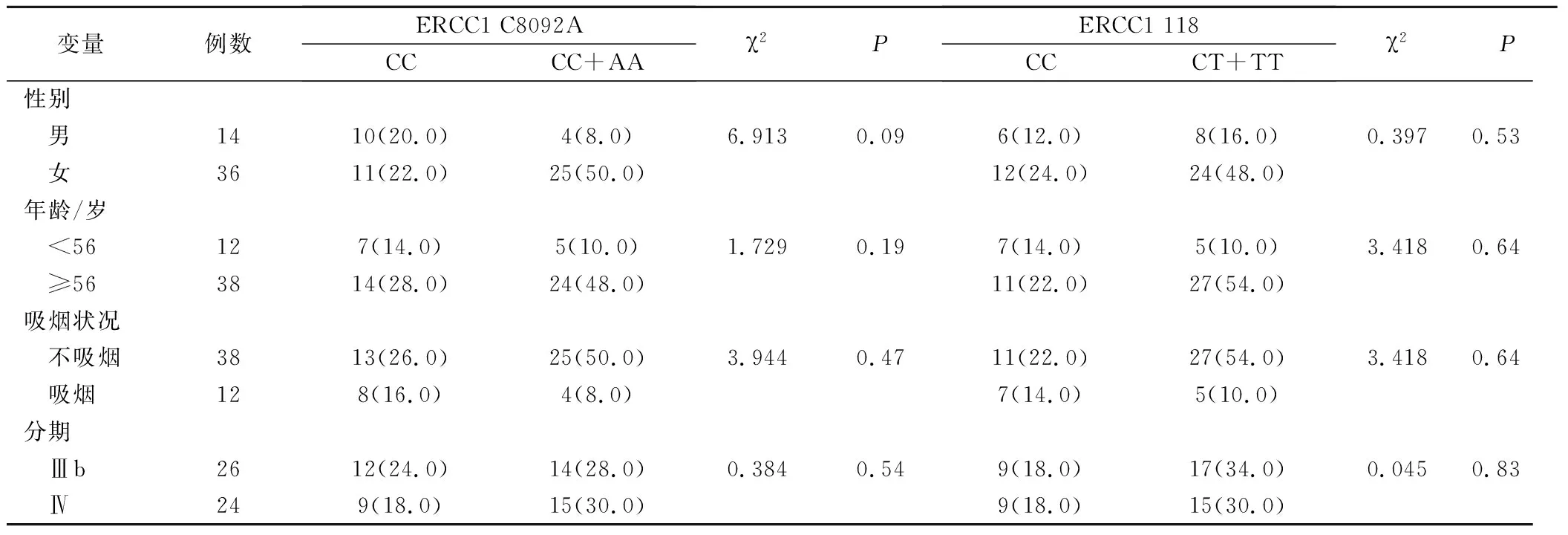
表1 患者基本情况与ERCC1 C8092A、118多态性相关性分析(例,%)
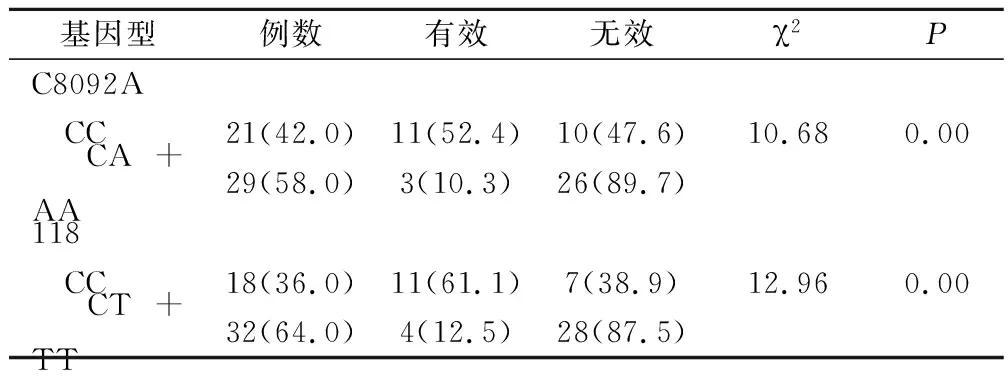
表2 肺腺癌患者ERCC1 C8092A、118多态性与含铂化疗疗效的关系(例,%)
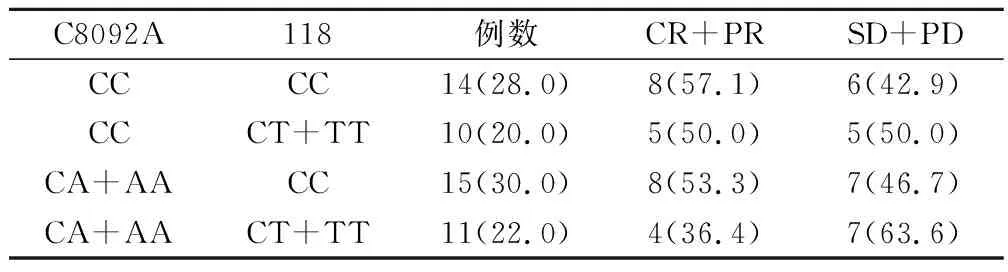
表3 肺腺癌患者ERCC1 C8092A、118多态联合与含铂化疗疗效的关系(例,%)
2.3 ERCC1 C8092A、118多态性与PFS的相关性
ERCC1 C8092A CC和CA+AA基因型患者的中位PFS为4个月,经Log-rank检验,两者PFS无统计学差异 (P=0.58) (图1A);ERCC1 C8092A CC和CT+TT基因型患者的中位PFS分别为5个月和4个月,经Log-rank分析无统计学差异(P=0.16)(图1B): Cox多因素回归分析显示ERCC1 C8092A、118多态性均不是影响肺腺癌患者PFS的独立因素。
3 讨论
铂类药物作为肺癌化疗的最重要的药物,其抗肿瘤作用的主要机制在于引起DNA损伤包括DNA加合物的形成、交联和氧化损伤。这些损伤阻断DNA的复制从而导致细胞死亡[2]。但是,这些损伤可以被人类核苷酸切除修复通路(nucision repair pathway,NER)修复。因此机体DNA修复能力的差异可能是不同患者采用铂类药物化疗后疗效和预后不同的分子生物学基础。王云南等研究发现ERCC1是参与修复DNA加合物等损伤的重要核苷酸切除修复基因,其表达低下在肺癌发生中起着重要作用[3]。且NSCLC中,ERCC1在肺癌组织中的表达显著高于癌旁组织[4],许崇安等认为ERCC1在非小细胞肺癌中表达升高并且存在正相关关系,可能在非小细胞肺癌发生发展中起协同作用,ERCC1阳性表达者生存期长,可能在预后判定中有一定作用[5]。同时有学者认为ERCC1高表达是Ⅰ期NSCLC术后良好预后的独立指标,含DDP化疗延长了Ⅱ期ERCC1低表达患者的生存,术后可根据ERCC1的水平决定是否选择含DDP方案化疗,ERCC1表达对NSCLC术后生存期的影响在Ⅰ期和Ⅱ期DDP化疗患者中可能不尽相同,ERCC1高表达在Ⅰ期NSCLC术后展现的是其保护的一面,而Ⅱ期以化疗抵抗为主[6]。Park等证明ERCC1 118C变异为T,CT或TT等位基因使ERCC1 mRNA水平增高,DNA修复能力增强,患者对铂类药物的敏感性降低,野生型基因(CC)患者对含铂化疗更敏感[7]。而王敬慧等研究认为ERCC1 C8092A、118多态性可能与晚期非小细胞肺癌患者铂类化疗疗效无明显相关性[8]。

图1 ERCC1 C8092A(A)和118(B)多态性的Kaplan-Meier生存曲线
本研究对我院50例晚期肺腺癌患者ERCC1基因C8092A、第118密码子多态性与含铂方案化疗疗效的相关性进行探讨,结果发现,不同年龄、性别、吸烟状况、临床分期患者间ERCC1 C8092A、118多态性均无统计学差异(P>0.05)。50例肺腺癌患者经疗效评价后,总有效率(CR+PR)为28.0%。ERCC1 C8092A中,CC基因型患者使用含铂方案化疗有效率高于CA+AA基因型患者,疗效间差异有统计学意义(P=0.00)。ERCC1 118中,CC基因型患者使用含铂方案化疗有效率高于CT+TT基因型患者,疗效间有统计学差异(P=0.00) (表2)。但ERCC1 2个位点同为CC型患者疗效与其它基因型患者比较无统计学差异(P=0.76)(表3)。ERCC1 C8092A、118多态性与晚期肺腺癌患者PFS无明显相关性。
目前国内外大量关于ERCC1多态性与铂类药物治疗疗效相关性研究得出的结论不尽相同。WEI等[9]认为118位基因多态性铂类药物化疗敏感性有关,D.Isla1等[10]研究ERCC1多态与多西他赛加卡铂联合治疗晚期非小细胞肺癌疗效之间的关系得出118位基因CC纯合型疗效更好,能更好延长患者的生存期。Kalikaki等[11]通过聚合酶链式反应一限制性片段长度多态性(PCR-RFLP)法对晚期NSCLC患者进行基因型分析,结果表明携有1个或者2个C的等位基因(CC,CT) 对化疗敏感性优于不含有C等位基因(OR:0.10;95%CI:0.013~0.828;P=0.033)。还有研究也证实了该观点,即认为ERCC1 codon118 CC型患者对铂类化疗反应优于CT及TT型[12]。然而,也有少部分研究报道不同,Caicun Zhou等[13]通过对ERCC1 118基因多态研究就发现118TT或CT基因型能明显地提高铂类联合药物治疗晚期非小细胞肺癌患者的生存期。关于C8092A与铂类药物治疗疗效报道较少,Ji-Youn Han等[14]研究结果显示在不吸烟的肺腺癌患者中,携带C8092A的AA基因型比CC、CA基因型的患者在治疗中获得更好的疗效。
各研究结果不一致可能受入组病例数、化疗方案、基因型检测方法等因素影响,也可能与不同种族基因型频率分布显著不同有关[15]。同时也可能与基因表达程度相关,这有待于今后进一步观察研究。
[1] 唐春兰,杨和平,周向东.DNA损伤修复与肺癌顺铂耐药机制的研究进展〔J〕.中国肺癌杂志,2011,14(12):960-964.
[2] Cepeda V,Fuertes MA,Castilla J,et al.Biochemical mechanisms of cisplatin eytotoxiety〔J〕.Anticancer Agents Med Chem,2007,7(1): 3-18.
[3] 王云南,吕嘉春,曾波航,等.肺癌组织中DNA修复基因ERCC1的表达与多环芳羟-DNA加合物的关系〔J〕.中国病理生理杂志,2004,20(7):1153-1156.
[4] 陈 芹,周彩存,张 颉.ERCC1、RRM1和BRCA1在非小细胞肺癌中的表达及预后的意义〔J〕.肿瘤,2007,27(9):719-722.
[5] 许崇安,冯 丹,李 琳,等.ERCC1和GST-pi在肺癌中的表达及预后意义〔J〕.中国肺癌杂志,2010,13(3):195-200.
[6] 王慧敏,冯久贤,张雪艳,等.ERCC1、RRM1和p53表达与Ⅰ-Ⅱ期肺癌术后预后相关性分析〔J〕.中国肺癌杂志,2009,12(5):387-395.
[7] Park DJ,Zhang W,Stoehlmaeher J,et al.ERCC1 gene polymorphism as a predictor for clinical outcome in advanced colorectal cancer patients treated with platinum-based chemotherapy〔J〕.Clin Adv Hematol Oncol,2003,1(3):162-166.
[8] 王敬慧,张 权,张 卉,等.ERCC1基因多态性与晚期非小细胞肺癌患者铂类化疗疗效的关系〔J〕.中国肺癌杂志,2010,13(4)337-341.
[9] WEI SZ,ZHAN P,SH1 MQ,et al.Predictive value of ERCC1 and XPD polymorphism in patients with advanced non-small cell lung cancer receiving platinum based chemotherapy:a systematic review and Meta-analysis〔J〕.Med Oncol,2011,28(1):315-321.
[10] Isla1 D,Sarries C,Rosell R,et al.Domine,Single nucleotide polymorphisms and outcome in docetaxel-cisplatin-treated advanced non-small-cell lung cancer〔J〕.Annals of Oncology,2004,15(8): 1194-1203.
[11] Kalikaki A,Kanaki M,vasalon H,et al.DNA repair gene polymorphisms predict favorable clinical outcome in advanced non-small cell lung cancer〔J〕.Clin Lung Cancer,2009,10(2):118-123.
[12] Reed E.ERCC1 measurements in clinical oncology〔J〕.N Engl J Med,2006,355(10): 1054-1055.
[13] Zhou C,Ren S,Zhou S,et al. Predictive effects of ERCC1 and XRCC3 SNP on efficacy of platinum-based chemotherapy in advanced NSCLC patients〔J〕.Jpn J Clin Oncol,2010,40(10):954-960.
[14] Han J,Yoon KA,Park JH,et al.DNA repair gene polymorphisms and benefit from gefitinib in never-smokers with lung adenocarcinoma〔J〕.Cancer,2011,7(14):3201-3208.
[15] Gandara DR,Kawaguchi T,Crowley J,et al.Japanese-υs commonarm analysis of paclitaxel plus carboplatin in advanced nonsmall cell lung cancer:a model for assessing population-related pharmacogenomics〔J〕.J Clin Oncol,2009,27(21):3540-3546.

