小鼠过敏性哮喘模型制备的特点分析
马子风,尹磊淼,冉君,王宇,徐玉东,管楠,杨永清
(上海中医药大学 上海市针灸经络研究所,上海 200030)
过敏性哮喘(简称哮喘)发病率逐年升高,严重影响人类健康[1],已成为全球性社会卫生问题[2]。哮喘发病机制复杂[3],疾病动物模型作为生命科学研究的重要支撑条件极大地促进了对哮喘病理生理机制的理解[4]。作为最常用的免疫研究工具,小鼠哮喘模型可模拟人类哮喘的速发相及迟发相反应、变态反应性炎症以及气道重塑特征,并在哮喘发病机制的相关分子研究中发挥着重要作用[5]。
目前小鼠哮喘模型已广泛应用在变应性哮喘、感染性哮喘、运动性哮喘、压力性哮喘、心理应激哮喘以及职业性哮喘等研究方面。根据不同类型研究的需要,模型制作方法不尽相同。在小鼠哮喘模型的制作过程中,小鼠品系、致敏及激发方法多种多样。因此弄清小鼠哮喘模型制备方法与模型特点的联系,根据实验目的选择实验所需的模型,合理选择小鼠品系、过敏原及制作方案,是哮喘科研工作的首要任务。
1 常用小鼠品系
从20世纪60年代起,小鼠就开始应用在哮喘研究领域。作为目前最常用的实验模型,有200多个近交系可供挑选,常用的有BALB/c、C57BL/6、129Sv、A/J等。以哮喘和小鼠为主题词检索近10年PubMed数据库中所有关于哮喘和小鼠的文章,结果显示从2003年9月1日至2013年9月1日采用小鼠制作哮喘模型的文献约有14 814篇,其中使用BALB/c和C57BL/6制作哮喘模型比例分别占33.04%和23.75%,BALB/c使用频率约为C57BL/6的1.4倍(图1)。
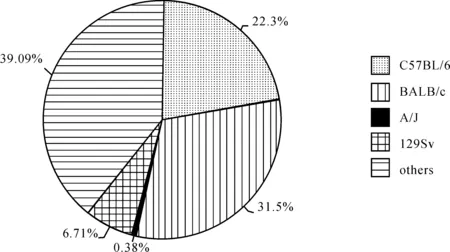
图1近10年PubMed数据库中采用各品系小鼠制作哮喘模型情况
Fig1ApplicationofvariousstrainsofmiceforasthmamodelinPubMeddatabaseduringthelastdecade
不同品系小鼠对致敏原敏感性不同,且抗原激发后过敏性炎症表现不同(表 1)。在对不同致敏原反应表现上C57BL/6小鼠对尘螨和豚草抗原反应性较强;A/J小鼠对尘螨反应性远高于卵白蛋白(ovalbumin,OVA)[6];129Sv对OVA以及呼吸道合胞病毒(respiratory syncytial virus,RSV)反应性更强[7],表现出明显的Th2型免疫反应并出现肺内嗜酸粒细胞浸润;BALB/c小鼠较易产生针对OVA和花粉的气道高反应性[8],但容易对长期单一致敏原的雾化攻击产生耐受,从而降低炎症和气道高反应性表现[9]。
表1不同品系小鼠对常见致敏原的敏感性表现
Tab1Susceptibilityofdifferentstrainsofmicesensitizedbycommonallergens
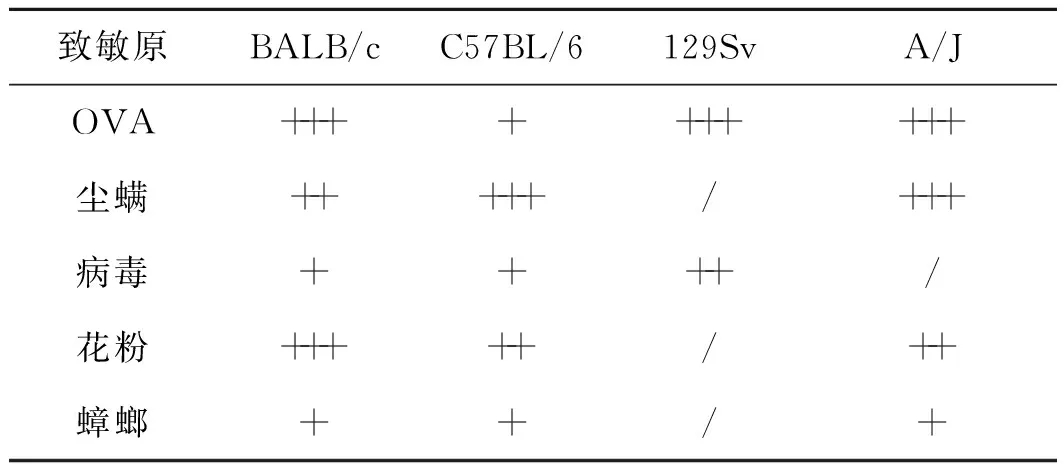
致敏原BALB/cC57BL/6129SvA/JOVA++++++++++尘螨+++++/+++病毒++++/花粉+++++/++蟑螂++/+
注:+为出现,++为强烈,+++为剧烈,/为未报道
Note:+appear,++intense,+++severe,/unreported
在抗原致敏及激发后过敏性炎症表现上BALB/c、C57BL/6和129Sv致敏后均可产生相应的IgE抗体,但BALB/c小鼠总IgE量比后两者少而特异性IgE量更多[10],也有研究表明该模型可能存在非IgE依赖性哮喘通路[6]。BALB/c小鼠较易出现强烈的Th2型细胞因子免疫反应,能产生广泛肺嗜酸粒细胞浸润[11]。C57BL/6小鼠致敏后产生的气道高反应性被认为和嗜酸粒细胞血症有关[12]。
目前研究认为气道高反应性以及激发后气道阻塞表现和基因相关度很高,而A/J小鼠在这方面表现比BALB/c、C57BL/6和129Sv更具有优势[13],可能与白介素- 4(IL- 4)受体基因多态性有关[14]。在采用滴鼻激发制作的气道高反应性哮喘模型中,BALB/c、C57BL/6、129Sv对乙酰甲胆碱反应性远不如A/J,但若改用雾化激发则结果又完全相反[15],由此可见哮喘模型病理表现与制作方法相关性很高。
2 小鼠哮喘模型的致敏
致敏方法能够影响宿主小鼠的免疫反应,因此,合理地选择一种模型需要综合考虑致敏原和佐剂的类型、致敏方式以及致敏剂量。
2.1 常见致敏原
目前常用致敏原主要有OVA、尘螨、病毒、花粉、蟑螂变应原等。
作为经典的抗原,OVA具有免疫原性强、易于获得、相关试剂选择空间大等优势,常与非免疫原性佐剂联合使用。用OVA联合氢氧化铝腹腔注射致敏129Sv小鼠,OVA生理盐水溶液连续雾化激发后可得到以嗜酸粒细胞浸润、气道高反应性为主要表现的急性炎症型哮喘模型[16]。采用OVA和硫酸铝钾腹腔注射致敏3次,1周后连续滴鼻3次激发可制作过敏性哮喘模型,表现出明显的气道高反应性[17]。
有文献[18]报道,用尘螨比OVA制作的小鼠慢性哮喘模型表现出更持久的气道高反应性。给予屋尘螨致敏BALB/c小鼠,第10天用屋尘螨滴鼻激发可制作以变态反应性炎症为主要表现的过敏性哮喘模型[19]。给予屋尘螨滴鼻3~6周,每周3次可制作慢性过敏性哮喘模型,并且发现6周致敏后的总IgG1及IgE量高于3周致敏且气道重塑表现更明显[20]。持续给予屋尘螨滴鼻7周致敏BALB/c小鼠可制作气道重塑模型,并出现明显气道嗜酸粒细胞炎症和对乙酰甲胆碱的强烈气道高反应性表现[18]。虽然近年尘螨造模应用增多,但尘螨不易提纯,增加了剂量掌握的难度,应用仍不及OVA广泛。
RSV可作为抗原单独致敏小鼠,也可联合OVA用来制作重症哮喘模型。采用紫外线灭活的RSV联合氢氧化铝皮下注射致敏小鼠,RSV滴鼻激发可制作以气道黏膜下浆细胞及嗜酸粒细胞浸润的哮喘模型[21]。而在OVA致敏的条件下,使用RSV诱导制作的急性病毒性哮喘模型比单纯OVA或单纯RSV致敏激发的哮喘模型病理变化更严重,表现出感染性炎症和变态反应性炎症特征[22]。在OVA致敏条件下RSV感染可加重气道炎症,导致气道上皮的破坏增生,这可能是其增高气道高反应性的机理之一[23]。
花粉是人类支气管哮喘常见的过敏原,采用花粉致敏制作小鼠哮喘模型也能模拟哮喘实际发病情况[24]。有报道用柏树花粉提取物联合氢氧化铝腹腔注射致敏2次,3周后滴鼻激发可制作出高浓度嗜酸粒细胞浸润的变态反应性炎症模型,并出现Th2型细胞因子增多[25]。用桦树花粉提取物联合氢氧化铝腹腔注射致敏2次,3周后连续雾化4天激发可成功制作过敏性哮喘模型,出现强烈的气道高反应性[26]。也有报道皮下注射橄榄花粉提取物和氢氧化铝制作哮喘模型可表现出显著Th2型免疫反应[24]。但由于花粉种类繁多,而且存在地域差别,采用花粉制作的哮喘模型也多样,使模型的重复和相互间比较研究复杂化。
除了花粉,蟑螂也和哮喘发病有密切关系。常见的德国小蠊和美洲大蠊体内都存在多种潜在致敏原,有德国小蠊提取物Bla g2(失活天冬氨酸蛋白酶)、Bla g4(calycin)、Bla g 5(谷胱甘肽- S- 转移酶)等,所以到目前为止国内和国际对蟑螂变应原所致哮喘都很难进行标准化研究[27- 28]。有报道示蟑螂提取物联合弗氏完全佐剂腹腔注射致敏,第14天给予等量抗原液滴鼻激发,第20天气管内给予蟑螂变应原可成功制作出显著气道高反应性表现的过敏性哮喘模型[29]。每隔4 d滴鼻给予蟑螂提取物和不完全弗氏佐剂共5次,气管内给予蟑螂提取物2次激发可制作出重度气道重塑表现的慢性过敏性哮喘模型[30]。
在众多的哮喘模型中,不同致敏原基本都可以制作各种哮喘模型,但是每个致敏原也有自己本身的缺陷。比如单用OVA很难制作重症哮喘模型,尘螨提纯价格昂贵,病毒和真菌制作的哮喘模型虽为临床中通过控制病原体感染而控制哮喘发生提供依据,但稳定性欠佳,其在诱导哮喘发生中的作用还需进一步阐明[31]。蟑螂变应原、花粉及职业性致敏原等由于种类繁多、模型制作很难标准化而使模型的复制复杂化,故在制作哮喘模型中使用相对较少。
2.2 佐剂
哮喘致敏时常需联合佐剂使用。佐剂可通过特异性或非特异性免疫增强作用使机体产生更多的抗体量,不仅可以减轻免疫耐受,还能节约使用的抗原量[32]。在哮喘模型的制作中最常用的是铝化合物以及来源于病原微生物的佐剂,以氢氧化铝和灭活百日咳杆菌多见。
作为最常用的佐剂,氢氧化铝不仅可以增强免疫反应,还可以增加Th2型细胞因子的产生[33],甚至影响激发前后宿主免疫反应类型。使用剂量从1 mg到40 mg不等,最常用的剂量是2.25 mg。有报道示OVA联合氢氧化铝间隔7 d或者14 d的两次致敏,可引起强烈Th2偏向的免疫反应并产生高浓度的特异性IgE含量[34]。有研究示使用氢氧化铝佐剂联合OVA制作的哮喘模型表现出非IgE和非肥大细胞依赖的过敏性炎症和气道高反应性,相反,不使用氢氧化铝佐剂仅用OVA制作的哮喘模型则出现明显的肥大细胞依赖性过敏性炎症表现[35]。
关于百日咳杆菌佐剂,有报道比较采用单纯百日咳杆菌、OVA联合百日咳杆菌及单纯OVA致敏小鼠制作哮喘模型,发现百日咳杆菌虽然可通过引起Th1型免疫反应调节Th2型免疫反应,但仍然可加重哮喘模型病理表现、气道炎症以及气道高反应性[36]。
2.3 致敏方式及致敏原剂量
致敏方式在一定程度上影响小鼠免疫反应。致敏方式主要有腹腔注射、雾化吸入、皮下注射、鼻内给药、气管内给药等,目前最常用的致敏方式是腹腔注射致敏原加佐剂。Secor等[37]用OVA联合氢氧化铝腹腔注射致敏C57BL/6小鼠,成功制作了急性过敏性哮喘模型。此外,仅用吸入致敏原的方式也可以成功制作过敏性哮喘模型。Larsen等[38]用雾化吸入OVA致敏BALB/c小鼠,每天20 min,连续10 d,制作了最短时间的气道高反应性模型,并出现高浓度特异性IgE。此外,皮下多点注射、鼻内给药及气管内给药等方式制作的哮喘模型也可达到实验目的。Corry等[39]采用皮下注射OVA混合氢氧化铝,制作了急性气道高反应性模型。Johnson等[18]采用HDM滴鼻BALB/c小鼠7周,每周5次制作出有明显气道嗜酸粒细胞炎症、对乙酰甲胆碱的强烈气道高反应性表现的气道重塑模型。采用屋尘螨气管内给药致敏BALB/c小鼠,可成功制作变态反应性炎症表现的过敏性哮喘模型[19]。根据模型需要,也有多次致敏和单次致敏的区别。采用隔天腹腔注射粉尘螨联合氢氧化铝6次,可成功制作肺部变态反应性炎症哮喘模型[40]。
在模型制作过程中,不同抗原剂量影响肺泡灌洗液中嗜酸粒细胞数量、IgE含量、炎症程度以及气道高反应性表现[41]。在腹腔注射致敏制作的小鼠哮喘模型中,OVA致敏剂量通常在1~20000 μg,其中10~50 μg使用范围较常见[34]。有报道采用0、10、100、1000 μg OVA分别致敏小鼠,发现10 μg组产生以IgE为主的特异性抗体,且脾细胞培养上清中Th2型细胞因子增加明显,1 000 μg组产生以IgG2a为主的特异性抗体,Th1型细胞因子增多;而且气道高反应性只在10 μg OVA致敏的小鼠模型中出现[42]。此外,用0、3、30、300μg·ml-1的屋尘螨连续雾化制作气道高反应性小鼠模型,发现300μg·ml-1组出现气道高反应性以及大量炎症细胞浸润,血清IgE升高,但3μg·ml-1和30μg·ml-1组仅出现气道高反应性及血清IgE升高,并无气道炎症[43]。目前认为致敏原的剂量可能通过影响细胞因子的类型,从而影响动物模型表型的变化[44]。
3 小鼠哮喘模型的激发
模型的多样性部分程度取决于激发的途径、方法以及持续时间。激发方式常见的有雾化、鼻内给药及气管内给药。其中雾化激发小鼠状态较好,激发致死率低,使用最广泛。
急性模型多采用连续4~8 d的雾化吸入激发,模型多可表现出嗜酸粒细胞浸润及气道高反应性。变态反应性炎症哮喘模型制备中致敏和激发两阶段持续时间比较短,激发时间在两周左右。抗原系统致敏及反复较长时间的同一抗原激发对小鼠气道重塑模型的建立是必需的,抗原激发可持续亦可间断进行,激发时间多超过3周[31](图2)。

图2小鼠哮喘模型制备过程激发时间与特征联系
Fig2Relationshipbetweenchallengetimeandfeaturesinmurineasthmamodelpreparation
在探讨不同激发方式对小鼠过敏性哮喘模型影响实验中,采用同样致敏方法3次滴鼻激发和3次雾化激发制作的哮喘模型都可以表现出明显气道炎症、嗜酸粒细胞浸润,但滴鼻激发建立的哮喘模型比雾化激发表现更显著[45]。有报道示雾化激发比滴鼻激发更易产生气道高反应性[46]。采用同样致敏方法,气管内给药制作的哮喘模型表现出气道及肺组织炎症、杯状细胞增生、上皮细胞增生以及轻度的上皮组织纤维化,而雾化激发建立的哮喘模型则出现明显气道高反应性并伴有显著嗜酸粒细胞浸润[15]。
4 总 结
综上所述,小鼠哮喘模型制作方法多种多样,在哮喘研究中提供了多种思路和方法,目前常用的变态反应性炎症哮喘模型、气道重塑模型、重症哮喘模型等都在一定程度上模拟了人类哮喘的发生、发展过程(表2)。根据不同实验需要选择合适的小鼠品系及制作方案,寻找更加理想的研究平台,为研究哮喘病理生理机制提供针对性依据仍然是当前的重点问题。
此外,小鼠哮喘模型的制备方法与模型的病理表现直接相关,所以系统的对比研究不同品系、不同致敏及激发方式与哮喘模型的联系很有必要。随着小鼠哮喘模型越来越广泛的应用,造模方法、生物技术等将不断完善,对小鼠哮喘模型进行客观认识及评价,深入比较研究不同方法制作的小鼠哮喘模型的特征,将使得制备的小鼠哮喘模型更加贴近人类哮喘表现,在此基础上进一步为哮喘的发病机制及治疗提供依据。
表2 3类主要的小鼠哮喘模型特征与人类哮喘的特征区别
Tab2Thecharacteristicsthatdistinguishthreemainmurineasthmamodelswithhumanasthma
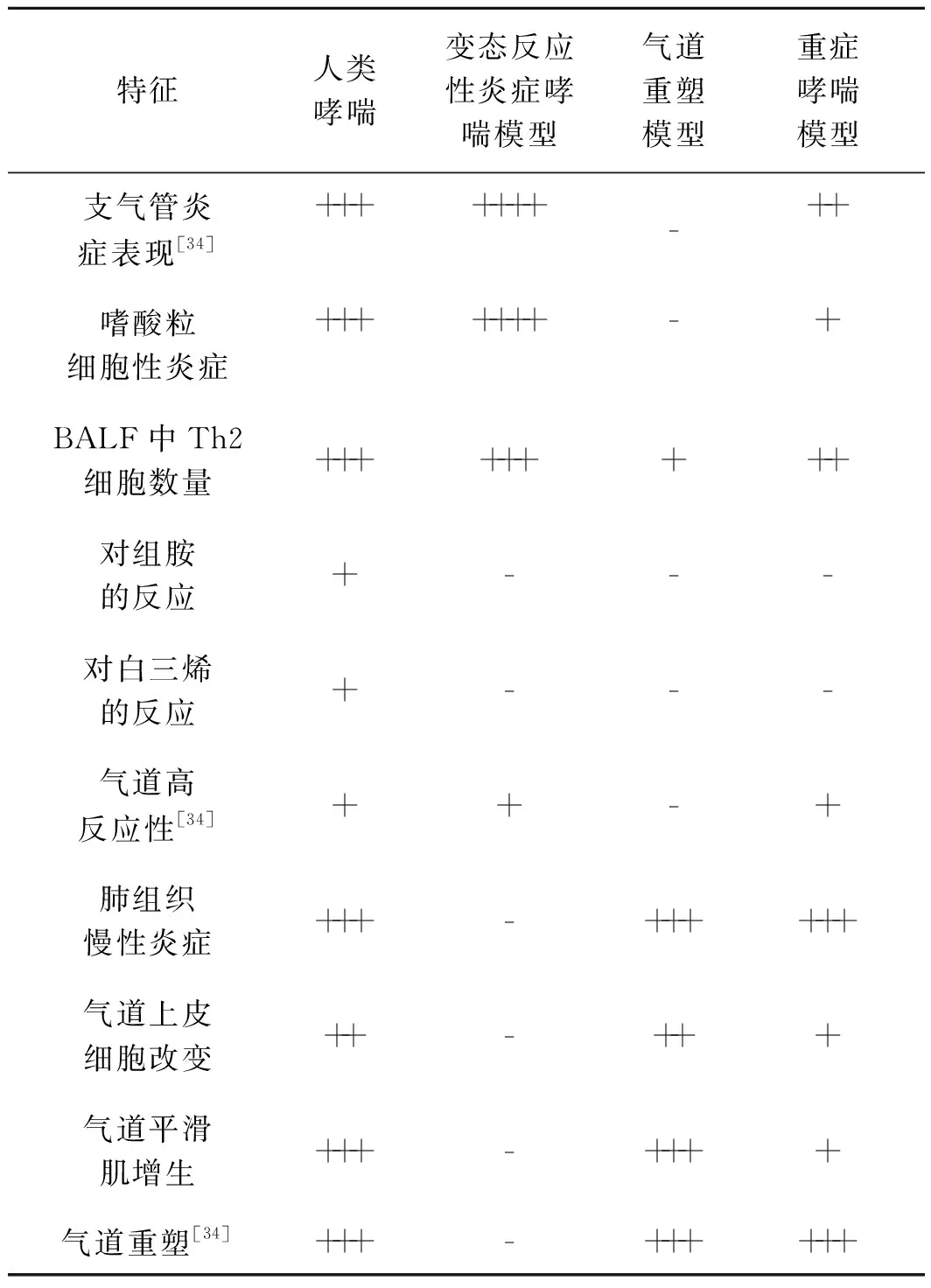
特征人类哮喘变态反应性炎症哮喘模型气道重塑模型重症哮喘模型支气管炎症表现[34]+++++++-++嗜酸粒细胞性炎症+++++++-+BALF中Th2细胞数量+++++++++对组胺的反应+---对白三烯的反应+---气道高反应性[34]++-+肺组织慢性炎症+++-++++++气道上皮细胞改变++-+++气道平滑肌增生+++-++++气道重塑[34]+++-++++++
注:+为出现,++为强烈,+++为剧烈,++++为显著,- 为不出现
Note:+appear,++intense,+++severe,++++marked,- not appear
[1] AKINBAMI L J,MOORMAN J E,BAILEY C,et al.Trends in asthma prevalence,health care use,and mortality in the United States,2001- 2010[MD].NCHS Data Brief,2012(94):1- 8.
[2] GINA.A pocket guide for physicians and nurses (Updated 2012).2012.
[3] SZEFLER S J,DAKHAMA A.New insights into asthma pathogenesis and treatment[J].Curr Opin Immunol,2011,23(6):801- 807.
[4] REDDY A T,LAKSHMI S P,Reddy R C.Murine model of allergen induced asthma[J].J Vis Exp,2012(63):e3771.
[5] GRAUSENBURGER R,BILIC I,BOUCHERON N,et al.Conditional deletion of histone deacetylase 1 in T cells leads to enhanced airway inflammation and increased Th2 cytokine production[J].J Immunol,2010,185(6):3489- 3497.
[6] ZHU Z,OH S,ZHENG T,et al.Immunomodulating effects of endotoxin in mouse models of allergic asthma[J].Clin Exp Allergy,2010,40(4):536- 546.
[7] WHITEHEAD G S,WALKER J K,BERMAN K G,et al.Allergen- induced airway disease is mouse strain dependent[J].Am J Physiol Lung Cell Mol Physiol,2003,285(1):L32- L42.
[8] 沈华浩,王苹莉.支气管哮喘小鼠模型应用评价[J].中华结核和呼吸杂志,2005,28(4):284- 286.
[9] BATES J H,COJOCARU A,HAVERKAMP H C,et al.The synergistic interactions of allergic lung inflammation and intratracheal cationic protein[J].Am J Respir Crit Care Med,2008,177(3):261- 268.
[10] HELLMAN L.Regulation of IgE homeostasis,and the identification of potential targets for therapeutic intervention[J].Biomed Pharmacother,2006,61(1):34- 49.
[11] BOYCE J A,AUSTEN K F.No audible wheezing:nuggets and conundrums from mouse asthma models[J].J Exp Med,2005,201(12):1869- 1873.
[12] JOACHIM R A,QUARCOO D,PETRA C,et al.Stress enhances airway reactivity and airway inflammation in an animal model of allergic bronchial asthma[J].Psychosom Med,2003,65(5):811- 815.
[13] WAGERS S S,HAVERKAMP H C,BATES J H,et al.Intrinsic and antigen- induced airway hyperresponsiveness are the result of diverse physiological mechanisms[J].J Appl Physiol,2007,102(1):221- 230.
[14] WEBB D C,MATTHAEI K I,CAI Y,et al.Polymorphisms in IL- 4Rαcorrelate with airways hyperreactivity,eosinophilia,and Ym protein expression in allergic IL- 13- /- mice[J].J Immunol,2004,172(2):1092- 1098.
[15] BATES J H,RINCON M,IRVIN C G.Animal models of asthma[J].Am J Physiol Lung Cell Mol Physiol,2009,297(3):L401- L410.
[16] 林志荣,王维刚,严惠敏,等.卵清蛋白诱导129Sv小鼠建立哮喘模型的方法[J].中国细胞生物学学报,2011,33(9):964- 968.
[17] KUDO M,MELTON A C,CHEN C,et al.IL- 17A produced byαβT cells drives airway hyper- responsiveness in mice and enhances mouse and human airway smooth muscle contraction[J].Nat Med,2012,18(4):547- 554.
[18] JOHNSON J R,WILEY R E,FATTOUH R,et al.Continuous exposure to house dust mite elicits chronic airway inflammation and structural remodeling[J].Am J Respir Crit Care Med,2004,169(3):378- 385.
[19] KLEIN- WOLTERINK R G,KLEINJAN A,van NIMWEGEN M,et al.Pulmonary innate lymphoid cells are major producers of IL- 5 and IL- 13 in murine models of allergic asthma[J].Eur J Immunol,2012,42(5):1106- 1116.
[20] Le CRAS T D,ACCIANI T H,MUSHABEN E M,et al.Epithelial EGF receptor signaling mediates airway hyperreactivity and remodeling in a mouse model of chronic asthma[J].Am J Physiol Lung Cell Mol Physiol,2011,300(3):L414- L421.
[21] 张惠兰,张珍祥,徐永健,等.用紫外线灭活的呼吸道合胞病毒复制小鼠哮喘动物模型[J].中国病理生理杂志,2002,18(12):1561- 1563.
[22] 童黄锦,范欣生,许惠琴,等.一种病毒性哮喘模型制作方法的建立及评价[J].西安交通大学学报:医学版,2008,29(3):349- 352.
[23] BARENDS M,BOELEN A,de ROND L,et al.Respiratory syncytial virus enhances respiratory allergy in mice despite the inhibitory effect of virus- induced interferon-γ[J].J Med Virol,2003,69(1):156- 162.
[24] CONEJERO L,HIGAKI Y,BAEZA M,et al.Pollen- induced airway inflammation,hyper- responsiveness and apoptosis in a murine model of allergy[J].Clin Exp Allergy,2007,37(3):331- 338.
[25] GABRIELE L,SCHIAVONI G,MATTEI F,et al.Novel allergic asthma model demonstrates ST2- dependent dendritic cell targeting by cypress pollen[J].J Allergy Clin Immunol,2013,132(3):686- 695.
[26] TOURDOT S,AIROUCHE S,BERJONT N,et al.Efficacy of sublingual vectorized recombinant Bet v 1a in a mouse model of birch pollen allergic asthma[J].Vaccine,2013,31(2013):2628- 2637.
[27] NARISETY S D,WOOD R A.Allergen- specific IgE as a biomarker of exposure plus sensitization in inner- city adolescents with asthma[J].Pediatrics,2011,128(Supplement 3):S101- S102.
[28] POMES A,ARRUDA L K.Investigating cockroach allergens:Aiming to improve diagnosis and treatment of cockroach allergic patients[J].Methods,http://dx.doi.org/10.1016/j.ymeth.2013.07.036.
[29] BERLIN A A,LUKACS N W.Treatment of cockroach allergen asthma model with imatinib attenuates airway responses[J].Am J Respir Crit Care Med,2005,171(1):35- 39.
[30] BERLIN A A,HOGABOAM C M,LUKACS N W.Inhibition of SCF attenuates peribronchial remodeling in chronic cockroach allergen- induced asthma[J].Lab Invest,2006,86(6):557- 565.
[31] 朱艳芬,宋泽庆.小鼠支气管哮喘模型的研究现状[J].中华哮喘杂志:电子版,2009,3(4):311- 314.
[32] KOOL M,SOULLIE T,van NIMWEGEN M,et al.Alum adjuvant boosts adaptive immunity by inducing uric acid and activating inflammatory dendritic cells[J].J Exp Med,2008,205(4):869- 882.
[33] EPSTEIN M M.Do mouse models of allergic asthma mimic clinical disease? [J].Int Arch Allergy Immunol,2004,133(1):84- 100.
[34] KUMAR R K,HERBERT C,FOSTER P S.The "classical" ovalbumin challenge model of asthma in mice[J].Current Drug Targets,2008,9:485- 494.
[35] NAKAE S,LUNDERIUS C,HO L H,et al.TNF can contribute to multiple features of ovalbumin- induced allergic inflammation of the airways in mice[J].J Allergy Clin Immunol,2007,119(3):680- 686.
[36] ENNIS D,CASSIDY J,MAHON B.Prior bordetella pertussis infection modulates allergen priming and the severity of airway pathology in a murine model of allergic asthma[J].Clin Exp Allergy,2004,34(9):1488- 1497.
[37] SECOR E R,CARSON W F,SINGH A,et al.Oral bromelain attenuates inflammation in an ovalbumin-induced murine model of asthma[J].Evid Based Compl Alt,2008,5(1):61- 69.
[38] LARSEN G L,RENZ H,LOADER J E,et al.Airway response to electrical field stimulation in sensitized inbred mice.Passive transfer of increased responsiveness with peribronchial lymph nodes[J].J Clin Invest,1992,89(3):747- 752.
[39] CORRY D B,FOLKESSON H G,WARNOCK M L,et al.Interleukin 4,but not interleukin 5 or eosinophils,is required in a murine model of acute airway hyperreactivity[J].J Exp Med,1996,183(1):109- 117.
[40] 陈华夏.粉尘瞒提取液致敏 CXCR3 基因敲除小鼠肺部变应性炎症的研究[D].北京,北京协和医学院,2009∶1- 80.
[41] 唐晓媛,于化鹏,邓火金,等.不同剂量致敏原对小鼠哮喘模型气道反应性的影响[J].现代医学,2011,39(2):121- 125.
[42] SAKAI K,YOKOYAMA A,KOHNO N,et al.Effect of different sensitizing doses of antigen in a murine model of atopic asthma[J].Clin Exp Immunol,1999,118(1):9- 15.
[43] TOUMOY K,KIPS J,SCHOU C,et al.Airway eosinophilia is not a requirement for allergen- induced airway hyperresponsiveness[J].Clin Exp Allergy,2000,30(1):79- 85.
[44] 何权瀛.对我国哮喘动物实验研究的评价与思考[J].国外医学:呼吸系统分册,2005,25(9):718- 719.
[45] 沈璐,赖克方,姜华,等.不同激发方式对小鼠过敏性支气管哮喘模型的影响[J].国际呼吸杂志,2009,29(15):909- 913.
[46] HOMMA T,BATES J H,IRVIN C G.Airway hyperresponsiveness induced by cationic proteinsinvivo:site of action[J].Am J Physiol Lung Cell and Mol Physiol,2005,289(3):L413- L418.

