高胰岛素对不同糖浓度下视网膜色素上皮细胞活性氧表达的影响
施光明,栾洁
(1.东南大学 医学院,江苏 南京 210009; 2.东南大学附属中大医院 眼科,江苏 南京 210009)
糖尿病患者因糖代谢障碍导致全身各组织器官的微血管发生病变,其中糖尿病视网膜病变(diabetic retinopathy,DR)是其最严重的微血管并发症之一,也是成年人致盲的重要原因之一[1]。胰岛素注射被认为是控制血糖并减少糖尿病并发症的较好的手段,但有临床研究观察到使用大剂量胰岛素控制血糖后出现DR恶化的现象,这引起了我们的关注。为探讨其中可能的机制,我们观察了高浓度胰岛素对不同糖浓度下体外培养的视网膜色素上皮(retinal pigment epithelium, RPE)细胞活性氧(reactive oxygen species,ROS)生成的影响。
1 材料和方法
1.1 材料
人RPE细胞(cultured human retinal pigment epithelial cells-19, ARPE-19,购自ATCC公司)、DMEM/F12培养液(Gibco公司)、胰岛素(江苏万邦生化医药股份有限公司)、胎牛血清(FCS,杭州四季青)、0.05% Trypsin- EDTA(Gibco公司)、流式细胞仪(BD FACSCalibur)。
1.2 方法
ARPE- 19悬液置于含有10% FCS的DMEM/F12培养液的培养瓶内,于37℃、体积分数为5% CO2培养箱中培养,隔天换液,待细胞长至融合后用0.05% Trypsin- EDTA消化,离心,制成单细胞悬液,按1∶4~ 1∶6传代。将长至融合状态的细胞以0.05% Trypsin- EDTA消化,离心,制成单细胞悬液。接种细胞悬液于25cm2的培养瓶,置于37℃、体积分数为5%CO2培养箱中培养,细胞融合后随机分成空白对照组(葡萄糖5.6mmol·L-1)、高胰岛素组(葡萄糖5.6mmol·L-1+胰岛素104U·L-1)、高糖组(葡萄糖30mmol·L-1)、高胰岛素+高糖组(葡萄糖30 mmol·L-1+胰岛素104U·L-1)4组;空白对照组采用24.4mmol·L-1甘露醇平衡渗透压差别;按分组分别在5.6、30mmol·L-1葡萄糖浓度下培养3d,无血清培养液培养12h。再按分组给予104U·L-1胰岛素干预24h。
1.3 细胞内ROS产生的检测
以2′,7′- 二氯荧光素二乙酸酯(DCFH- DA)法检测RPE细胞中ROS的水平,应用ROS检测试剂盒按照说明书流程操作。流式细胞仪计数50000个细胞(波长488nm)检测平均荧光强度,以反映细胞内ROS水平。
1.4 统计学处理
采用SPSS 18.0统计学软件对数据进行统计学处理,采用配对t检验分析高浓度胰岛素、高浓度糖及两者共同作用对RPE细胞ROS的影响,以P<0.05为差异具有统计学意义。
2 结 果
如图1、2所示,空白对照组、高胰岛素组、高糖组、高胰岛素+高糖组各组均显示有RPE细胞内ROS的表达,高胰岛素组、高糖组、高胰岛素+高糖组ROS的产生量均明显多于空白对照组,分别是空白对照组的1.47、1.35、1.86倍,差异均具有统计学意义(t=24.0、4.203、19.562、P<0.05),高胰岛素+高糖组RPE细胞ROS产量分别是高胰岛素组、高糖组的1.27和1.38倍,差异均有统计学意义(t=10.090、4.028;P<0.05);高胰岛素组与高糖组相比,t=1.285,P>0.05,差异无统计学意义。

图1各浓度组ROS的相对表达量

A

B

C
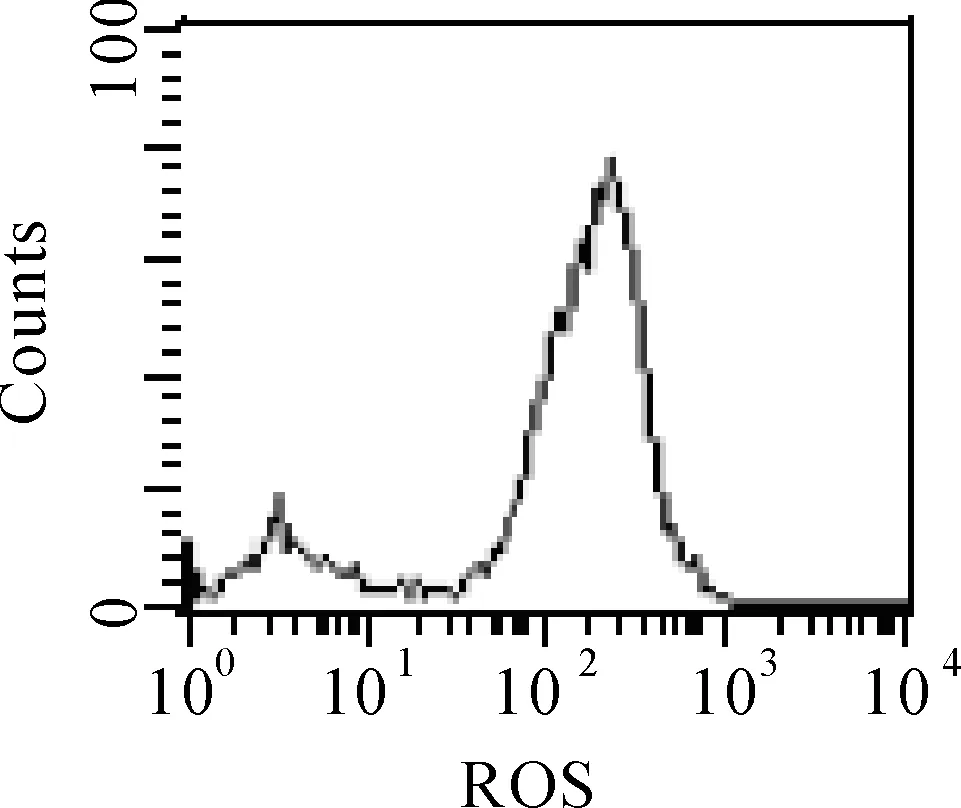
D
A.空白对照组;B.高胰岛素组;C.高糖组;D.高胰岛素+高糖组
图2各组ROS表达量
3 结 论
随着我国糖尿病患者的增多,DR患者致盲也呈上升趋势,其发病率随着病程的延长而增加。研究发现,大约一半以上的糖尿病患者在患病5~10年后会发生眼底病变,15年后则高达75%~80%,其中严重危害性的增生性DR占25%[2]。关于DR发生的机制一直是临床和科研工作者研究关注的热点,Brownlee[3]提出的糖尿病并发症发生的统一机制学说认为,经典的多元醇途径、糖基化终末产物(AGEs)途径、蛋白激酶C(PKC)途径和氨基己糖途径均是在高糖环境下,线粒体呼吸链中氧自由基生成过多导致的结果。有研究[4]认为,2型糖尿病并发症的发生还与炎症及胰岛素抵抗有密切联系。
胰岛素是由胰岛β细胞分泌,是机体内唯一降低血糖的激素,胰岛素注射被认为是控制血糖并减少糖尿病并发症的较好手段,但有临床研究发现,胰岛素强化治疗会引起DR的恶化[5]。
我们的前期试验证实,高浓度糖条件下培养ARPE- 19可致细胞损伤,抑制增殖,并使ROS生成增加[6]。本次实验也再次证实了这点,高糖组产生的ROS量显著高于空白对照组,高胰岛素组产生的ROS量也显著高于空白对照组,说明高胰岛素也能引起RPE细胞中ROS的产生增加。而当高浓度胰岛素作用于高浓度糖条件下培养的RPE细胞时,ROS的产生量明显高于高浓度糖和高浓度胰岛素分别单独作用于RPE细胞时ROS的产生量,提示高浓度胰岛素与高浓度糖对RPE细胞的氧化损伤可以产生协同作用,这可能就是糖尿病患者行胰岛素强化治疗时引起DR恶化的机制之一。
[1] MORLEY J E.Diabetes and aging:epidemiologic over view[J].Clin geriatr Med,2008,24(3):395- 405.
[2] BHADURI G,BANDYOPADHYAY M.Challenges to confront diabetic retinopathy and retinopathy of prematurity[J].J Indian Med Assoc,2005,103:363- 367.
[3] BROWNLEE M.Biochemistry and molecular cell biology of diabetic complications[J].Nature,2001,414:813- 820.
[4] 朱亭,邓月珍,叶飞,等.吡格列酮对肥胖2型糖尿病患者炎症因子的影响[J].现代医学,2013,41(1):23- 25.
[5] The Diabetes Control and Complications Trial.The effect of intensive diabeies treatment on the progession of diabetic retinopathy in insulin- dependent diabetes mellitus[J].Arch Ophthalmol,1995,113(1):36- 51.
[6] 冯丽丽,栾洁,傅敏,等.高糖体外对视网膜色素上皮增生以及活性氧表达的影响[J].国际眼科杂志,2010(3):453- 455.

