新型荧光探针应用于帕金森病模型中NO的检测
杨流海,陈江宁,张峻峰
(南京大学生命科学学院 医药生物技术国家重点实验室,江苏 南京 210093)
大量的研究表明,NO在帕金森病(PD)发生过程中发挥了重要的作用。NO可以诱发氧化应激,导致细胞线粒体功能紊乱;NO也可以介导兴奋性神经毒性作用,并引发细胞中DNA和蛋白质不可逆的修饰损伤,最终导致神经元的死亡[1- 2]。
为了深入地研究NO在PD发生与发展过程中的具体作用,就需要对神经系统NO进行专一性的检测。NO具有很强的反应活性和不稳定性,直接进行PD中NO的检测非常困难。目前检测NO的方法有化学反光法、电子顺磁共振谱(EPR)法和电化学法等,这些方法普遍存在灵敏度低、准确性差、仪器复杂、成本昂贵等不足。相比较而言,荧光测定法是目前NO检测方法中较为灵敏的化学检测手段,检测下限一般可达到纳摩尔(10-9)甚至皮摩尔(10-12),并且操作简单、成本低,具有较高的选择性和灵敏度[3]。文献报道的许多小分子荧光探针都只能通过与NO的氧化产物进行反应间接反映NO的变化。我们课题组报道了一种新型的荧光化合物 4- 甲氧基- 2- (1- 氢- 萘- [2,3- d]咪唑- 2- 基)苯酚(4- methoxy- 2- (1H- naphtho[2,3- d]imidazol- 2- yl)phenol,MNIP),该化合物与二价铜离子形成的铜(Ⅱ)配合物(MNIP- Cu)能够专一性地与生物系统中的NO发生反应,造成荧光的极大增强,从而对神经细胞或活体脑内的NO进行荧光成像,这为我们研究NO在PD发病机制的具体作用机制提供了新的手段。
1 材料与方法
1.1 材料
1.1.1 主要试剂 荧光化合物MNIP由本实验室自己合成,1- 甲基- 4- 苯基吡啶/1- 甲基- 4- 苯基- 1,2,3,6- 四氢嘧啶(MPP+/MPTP)、7- 硝基吲唑(7- NI)、多巴胺(DA)标准品、花生油(peanut oil)、二甲亚砜(DMSO)购自美国Sigma- Aldrich公司,Mitotracker® Red cm- h2xros购自美国Invitrogen公司,硫酸铜(CuSO4)为市售分析纯试剂,30%双氧水(H2O2)购自南京生兴生物技术有限公司;Bradford蛋白浓度测定试剂盒购自碧云天生物技术研究所;DMEM培养液购自美国Gibco- BRL公司(Grand Island, NY,USA),新生牛血清购自杭州四季青生物公司,胰蛋白酶购自美国Hyclone公司。
1.1.2 主要仪器 F- 4500 model spectrophotometer(Hitachi, Tokyo, 日本),Nikon TE2000- U 荧光相差显微镜 (Tokyo, 日本),Olympus FV1000激光共聚焦显微镜,Aglient1200液相色谱仪 (Santa Clara, 美国),Leica 冰冻切片机 (Wetzlar,德国),数字式脑立体定位仪,Safire 酶标仪 (TECAN Co. Mannedorf, Zurich,瑞士)。
其他设备还包括: 二氧化碳细胞培养箱、超净工作台、Eppendorf 5810R 离心机、-20 ℃冰箱和-80 ℃低温冰箱,6、12、96孔细胞培养板为Costar公司产品。
1.1.3 实验细胞系与动物 人神经母细胞瘤株SH- SY5Y细胞购于中国科学院上海细胞库,雄性C57/BL小鼠(6~8周,18~20 g)购自中国军事科学院。
1.2 方法
1.2.1 NO荧光探针MNIP- Cu的制备 MNIP为本实验室自己合成,合成方法参考相应文献[4],MNIP结构式见图1。MNIP以DMSO配成浓度为1 mmol·L-1的溶液,40 mmol·L-1的硫酸铜溶液被缓慢滴加到MNIP溶液中,滴加的最终摩尔比为MNIP∶Cu2+=1∶1,混合后溶液在室温下搅拌30 min,得到浓度为1 mmol·L-1的MNIP- Cu溶液,即NO荧光探针,此荧光探针检测NO的有关机理及检测专一性请参考相应文献[5]。

图1MNIP结构图
Fig1StructurechartofMNIP
1.2.2 荧光探针MNIP- Cu对细胞NO的荧光成像 SH- SY5Y细胞以4×104个·ml-1的密度接种至6孔细胞培养板,等细胞贴壁过夜后加入500 μmol·L-1MPP+刺激24 h,然后加入MNIP- Cu(终浓度为10 μmol·L-1)和线粒体特异性染料MitoTracker Red(终浓度为200 nmol·L-1)共孵育30 min,然后采用Olympus FV1000激光共聚焦显微镜进行细胞荧光照片的拍摄(放大1 000倍),拍摄前吸除旧培养液,以预冷的4 ℃ 1×PBS洗涤细胞后再进行拍摄。同时设置两个阴性对照组,1个阴性对照为预先用7- NI(终浓度30 μmol·L-1)处理细胞1 h,然后再加入毒素刺激细胞24 h,接着加入探针进行荧光照片的拍摄;另1个阴性对照为细胞受到毒素刺激24 h后加入终浓度为500 μmol·L-1的NO清除剂3- 氧代- 2- 苯基- 4,4,5,5- 四甲基咪唑啉- 1- 氧(PTIO)处理细胞30 min,然后再加入探针进行荧光照片的拍摄。MNIP- Cu和MitoTracker Red的激发波长分别为405 nm和578 nm[6]。
1.2.3 PD动物模型的制作 40只雄性C57/BL小鼠(约20 g重)被随机分为3组,分笼饲养,8只为空白对照组(Control组),24只为模型组(MPTP组),又细分为MPTP连续注射3、7、10 d 3个亚组,8只为阴性对照组(7- NI组)。给予自由进食和饮水,室温维持在25 ℃,保持动物正常的12 h光照,所有动物的处理均符合南京大学实验动物操作管理规范。MPTP溶解在PBS中,7- NI溶解在花生油中。在模型组中,3、7和10 d组小鼠腹腔分别连续3、7和10次注射MPTP(溶解在100 μl PBS中),每次注射的时间间隔为24 h,每次注射剂量为30 mg·kg-1。在阴性对照组中,小鼠按照模型组同样的时间间隔和剂量腹腔注射MPTP,但每次注射MPTP前30 min先皮下注射7- NI(溶解在200 μl的花生油中),剂量也为30 mg·kg-1。空白对照组中小鼠皮下注射200 μl的花生油,30 min后皮下注射100 μl PBS,连续注射10 d,时间间隔也为24 h[7]。在最后1次MPTP注射后第4天完成以下实验。
1.2.4 小鼠行为学参数的检测 开放场地实验(open filed test)被广泛地应用于动物行为学方面的研究,而PD患者或动物模型在行为学上都表现出异常。开放场地实验装置为一个25 cm×25 cm×31 cm的亚克力盒隔音箱,底部由25个5 cm×5 cm大小的方格组成,整个装置置于JLBehv- LAM- 1自动监控系统的监测中。在安静的环境下将小鼠放入隔音箱中,监控系统自动记录下20 min内小鼠的移动距离(locomotion)和休息的时间(immobile time)。每组检测8只小鼠的行为学参数,在测完1只小鼠的行为学参数后用棉花将小鼠残留在隔音箱底部的粪便和尿液擦干净[8]。
1.2.5 小鼠脑内多巴胺浓度的检测 最后1次注射MPTP后4 d迅速断颈处死小鼠(每组处死4只),然后取出脑子,加入600 μl预冷的高氯酸溶液(0.1 mol-1)匀浆,然后15 000 r·min-1离心20 min,取上清液通过高效液相色谱(HPLC)法检测小鼠多巴胺的浓度水平。
1.2.6 MNIP- Cu对小鼠脑部NO的荧光检测 小鼠麻醉后将其牢牢地固定在脑立体定位仪上,通过数字式脑立体定位仪为每组另外的4只小鼠脑室注入10 μl的MNIP- Cu溶液(浓度为1 mmol·L-1),进样速度为1 μl·min-1。2 h后处死小鼠,迅速取出完整的脑子,其中每组取1个脑子放置于-20 ℃进行冰冻,冰冻后脑组织浸于OCT复合物(optimum cutting temperature compound)中处理1 h,处理后的脑组织以Leica冰冻切片机切成30 μm厚的薄片,置于预先处理的洁净的载玻片上,每片载玻片上加入1 ml左右4 ℃预冷的丙酮进行组织固定。固定1 h后,冰冻切片以Olympus IX71相差荧光显微镜在100倍的放大倍数下以350 nm激发光进行荧光照片的拍摄。每组的另外3只小鼠脑子加入800 μl预冷的DMSO匀浆,然后15 000 r·min-1离心15 min,连续离心2次,各取上清液200 μl在酶标仪上以350 nm激发检测荧光强度,同时取少量的上清液测定蛋白浓度,对荧光强度数值归一化。
2 结 果
2.1 PD细胞模型中NO的荧光成像
细胞在受到MPP+刺激后线粒体功能会受到损伤,氧化磷酸化作用受到抑制,同时NO等自由基大量产生而造成氧化应激,导致细胞凋亡。图2所示SH- SY5Y细胞在受到MPP+刺激后NO(蓝色荧光信号)的生成量明显增加,并且蓝色荧光信号主要集中在线粒体(红色荧光信号)区域,可见MPP+刺激SH- SY5Y细胞后主要导致细胞线粒体NO浓度的升高。7- NI能够抑制NO合酶(NOS)的活性,PTIO可以直接清除NO,两者都能抑制细胞内NO引发的荧光增强效应。
2.2 小鼠行为学参数的检测
图3显示PD模型小鼠的运动能力受到了显著损伤,同时在开放场里的不动时间(休息时间)是逐渐延长的。小鼠行为学损伤具有MPTP剂量依赖性,MPTP注射次数越多,小鼠行为学损伤越严重。而神经性一氧化氮合酶(nNOS)的特异性抑制剂7- NI对MPTP的毒性具有较强的抵御作用,能明显改善小鼠的这种状况,表明NO在这个过程中发挥了重要的作用。
2.3 MPTP抑制小鼠脑内多巴胺的合成
图4显示小鼠在注射MPTP后其多巴胺的合成受到了抑制,并且抑制作用具有MPTP剂量依赖性,小鼠注射MPTP 3、7和10 d后,其多巴胺的浓度依次下降到正常水平的64.70%、21.81%和15.07%。而7- NI对多巴胺合成系统具有明显的保护作用,能够显著减缓多巴胺浓度的减少,小鼠在受到7- NI保护后即使再注射10次的MPTP,其多巴胺的浓度依然可以达到正常水平的92.92%。
2.4 MNIP- Cu应用于PD模型小鼠中NO的荧光检测
图5显示注射了MPTP的小鼠脑切片的荧光强度显著增大,并且随着MPTP注射次数的增多,荧光强度逐渐增大。说明MPTP能够诱导小鼠脑部过度合成NO,而7- NI能够显著抑制MPTP对NO的上调作用。脑匀浆荧光检测的结果与荧光照片的结果是一致的。荧光强度的大小与NO的含量成正比,因此荧光强度的变化直接代表了NO浓度的变化。小鼠注射MPTP 3、7和10 d后,大脑内NO的浓度依次升高到正常水平的1.49、1.64和2.38倍。而7- NI能够抑制脑内NO浓度的升高,小鼠在注射了7- NI后再注射10 d的MPTP,其NO的浓度仅升高到正常水平的1.23倍。

图2MPP+刺激的细胞中MNIP-Cu对NO的荧光成像
Fig2FluorescentimagingofMNIP-CuonMPP+stimulatedcells


图3MPTP诱导小鼠行为学的损伤
Fig3MPTPinducebehaviorinjuryinmice

图4MPTP抑制小鼠脑部多巴胺的合成
Fig4MPTPinhibitdopaminesynthesisinmicebrain
3 讨 论
本研究显示PD小鼠脑内NO的合成发生显著上调,同时小鼠的运动机能受到损伤,脑内多巴胺的合成也受到显著抑制。随着MPTP注射次数的增多,小鼠脑内NO的浓度逐渐上升,而小鼠的运动能力逐渐下降,脑内多巴胺的浓度也逐渐降低;使用NO抑制剂后小鼠的运动能力逐渐上升,脑内多巴胺的浓度逐渐升高。可见小鼠运动能力受损及脑内多巴胺浓度的减少确实是由于高浓度的NO导致的,推测可能是由于NO浓度过高具有神经毒性,通过多种途径导致多巴胺能神经元的死亡,从而使多巴胺的浓度显著减少,同时运动机能受到严重损伤。PD的典型症状就是运动机能受损和大脑多巴胺水平的下降,可见我们这样一个体系确实模拟了PD的发病过程,可用于PD发病机理的研究。细胞学的研究还进一步表明PD的发生与线粒体的功能及氧化应激有着密切的关联,该研究为PD的治疗与诊断提供了新的线索。

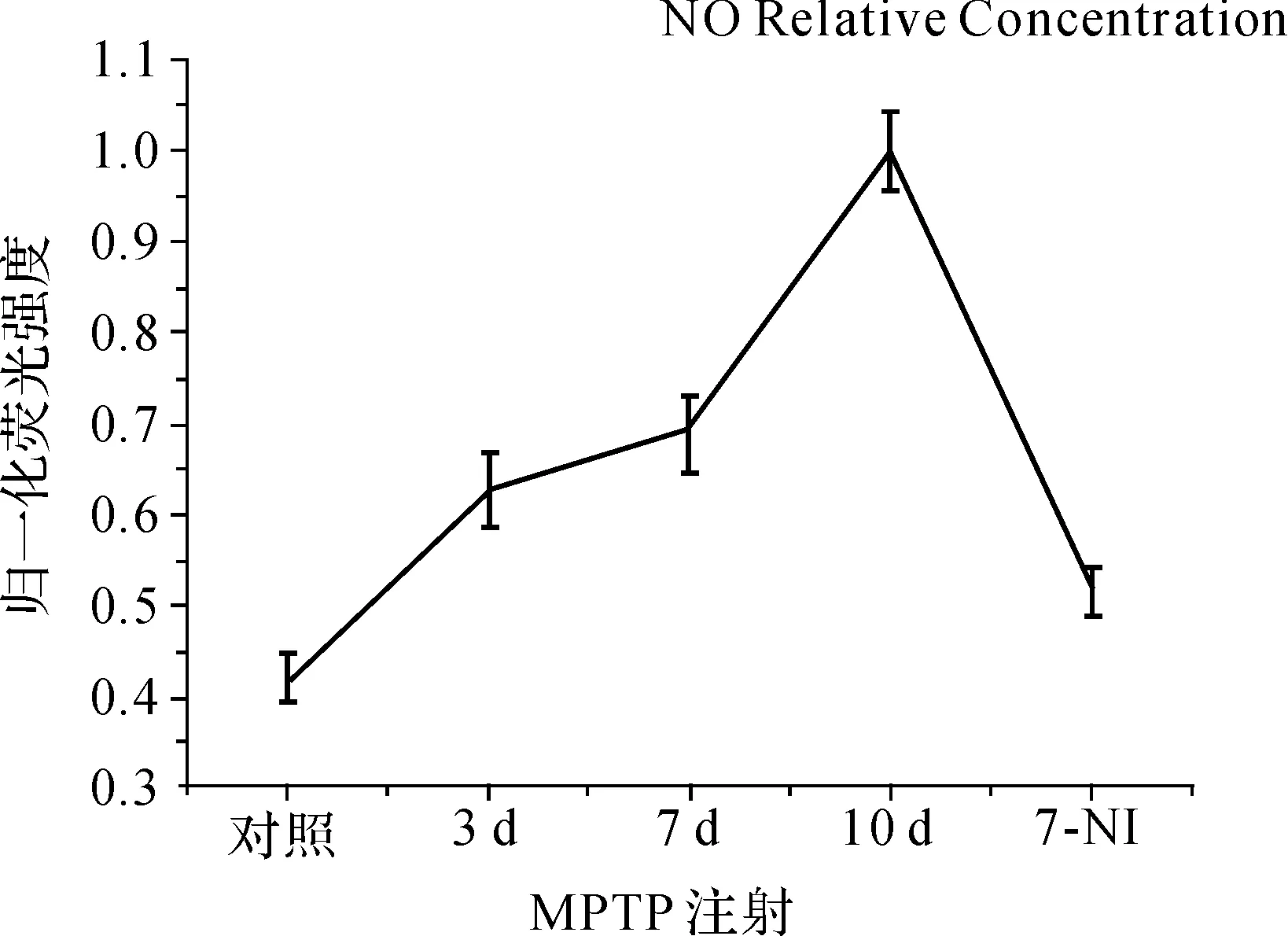
图5MNIP-Cu应用于MPTP诱导的PD模型小鼠中NO的荧光检测
Fig5MNIP-CuusedinNOfluorescentdetectiononMPTP-inducedPDmicemodel
本研究首次将新型NO荧光探针MNIP- Cu应用于PD的研究领域,直接检测到NO生成量的改变,该探针专一性强、反应灵敏,为阐明NO在PD发病机制中的作用提供了新的研究手段。
[1] KARIA A,SARA B,GIUSEPPE R,et al.Role of nitric oxide synthases in Parkinson’s disease:a review on the antioxidant and anti- inflammatory activity of polyphenols[J].Neurochem Res,2008,33:2416- 2426.
[2] 王景霞,刘妍,张建军.一氧化氮与抑郁症[J].现代医学,2011,39(1):104- 107.
[3] 赵勇,高凤博,吴可,等.苯并咪唑衍生物合铜(Ⅱ)配合物与NO的反应机理及荧光成像研究[J].无机化学学报,2009,25(9):1513- 1518.
[4] OUYANG J,OUYANG C,FUJII Y,et al.Synthesis and fluorescent properties of 2- (1H- benzoimidazol- 2- yl)- phenol derivatives[J].Heterocycl Chem,2004,41:359- 365.
[5] HUANG,K J,WANG H,MA M,et al.Real- time imaging of nitric oxide production in living cells with 1,3,5,7- tetramethyl- 2,6- dicarbethoxy- 8- (3′,4′- diaminophenyl)- difluoroboradiaza- s- indacence by invert fluorescence microscope[J].Nitric Oxide,2007,16:36- 43.
[6] JAMEEL D,JAMES P,BENNETT J.Interactions among nitric oxide and bcl- family proteins after MPP+exposure of SH- SY5Y neural cells Ⅰ:MPP+increases mitochondrial NO and Bax protein[J].Journal of Neuroscience Research,2003,79:76- 88.
[7] SERGE P,VERNICE J L,RINA Y,et al.Role of neuronal nitric oxide in 1- methyl- 4- phenyl- 1,2,3,6- tetrahydropyridine(MPTP)- induced dopaminergic neurotoxicity[J].PANS,1996,93:4565- 4571.
[8] BINUKUMAR B K,AMANJIT B,RAMESH J L K,et al.Nigrostriatal neuronal death following chronic dichlorvos exposure:crosstalk between mitochondrial impairments,a- synuclein aggregation,oxidative damage and behavioral changes[J].Molecular Brain,2010,3:35.

