溴化氧铋(BiOBr)光催化降解橙黄Ⅱ的研究
朱培娟,赵雅萍
(华东师范大学 环境与资源科学学院,上海 200241)
近年来光催化剂以及光催化技术引起了学术界极大的兴趣,能够作为光催化剂的材料多种多样,常见的有二氧化钛、氧化锌、二氧化锆等,其中二氧化钛由于其氧化能力强、性质稳定等优点成为被研究和使用最多的光催化剂之一[1-2],然而受到催化剂结构和禁带宽度的影响二氧化钛只能利用小于380 nm的紫外光[3],因而其发展前景受到了限制.为此,光催化剂可见光化的研究成为新的研究方向,对于光催化剂可见光化的研究主要包括对已有的光催化剂进行改性使原本不能利用可见光的催化剂可见光化,以及开发研究新的可以利用可见光的可见光光催化剂[4].常用的改性方法有离子掺杂、半导体复合、表面光敏化等[5-6].铋基卤氧化物BiOX(X= Cl, Br, I)是一种具有晶体结构的半导体,属于氟氯化铅(PbFCl)型, 对称性: D4h,空间群: P4Pn mm,属四方晶系[7].研究发现,BiOX在紫外-可见光区具有很高的吸收系数[8],这使它成为一种具有应用潜力的光催化剂.溴化氧铋(BiOBr)作为卤氧化铋的一种,具有独特的晶体结构,是一种新型的可见光响应的光催化剂,具有良好的光催化活性[9-10].
染料废水是在染料生产过程中产生的,其主要特点是有机物含量高、色度大、有毒有害物含量高,具有严重的“三致”作用,对环境具有巨大的潜在威胁[11].对染料废水的治理常用的方法主要有:物理法、化学法、生物法等,但每种方法都有一定的缺陷,将各种方法的优势结合,形成新的联合方法将会是治理染料废水的趋势.由于光催化降解方法对降解的有机物没有选择性,能降解不同种类的有机物,因此对于染料废水的处理将有巨大的潜力[12].橙黄Ⅱ(C16H11N2NaO4S)是一种具有刺激性的染料,可用作生物染色剂、萃取和广度测定阳离子表面活性剂等,其最大吸收波长在484 nm.作者选用橙黄Ⅱ为待降解有机污染物,以此研究BiOBr对于有机染料的降解情况,并探索其降解机制,为今后发展到实际应用中提供参考.
1 实验仪器和方法
1.1 实验仪器与试剂
主要实验设备:光催化反应实验装置、725-N紫外可见分光光度计(上海精密科学仪器有限公司)、TDL-40B离心机(上海安亭科学仪器厂)等.
光催化反应实验装置由高压汞灯、81-2型-恒温磁力搅拌器(上海县曹行无线电元件厂)、反应容器(500 mL烧杯)、遮光橱等组成.反应容器置于磁力搅拌器上,高压汞灯位于反应容器正上方,用遮光橱将高压汞灯以及整个反应容器包括在内.
主要实验试剂:橙黄Ⅱ,AR,美国Sigma Aldrich公司;甲醇、盐酸(HCl)、氢氧化钠(NaOH),AR,上海凌峰化学试剂有限公司;叠氮钠(NaN3),AR,浙江菱湖精细化工厂;苯醌,AR,上海润捷化学试剂有限公司;碘化钾(KI),AR,上海尚思化工有限公司;氟化钠(NaF) 、氯化钾(KCl)、溴化钠(NaBr),AR,上海化学试剂有限公司.
BiOBr为南开大学刘璐课题组提供,理化数据见参考文献[13].
1.2 实验方法
将0.05 g BiOBr加入300 mL 10 mg·L-1的橙黄Ⅱ溶液中,打开高压汞灯(光强为1.123 mW·m-2),溶液原始pH为5.73,在搅拌的条件下反应,每隔一段时间取样5 mL,4 000 r·min-1离心10 min,取上清液进行检测.除pH影响实验,其他实验均在溶液原始pH状态下进行.光解实验、吸附实验、催化剂用量实验、橙黄Ⅱ浓度梯度实验、pH实验以及自由基清除实验均在相同的条件下进行实验操作.pH实验中溶液的pH用0.1 mol·L-1氢氧化钠溶液和0.1 mol·L-1盐酸溶液调节.自由基清除实验选用碘化钾、甲醇、叠氮钠、苯醌作为空穴和自由基清除剂.卤素实验选用氟化钠、氯化钾、溴化钠作为卤素添加剂.
橙黄Ⅱ降解率的计算公式为
η=(A0-At)/A0×100% ,
其中:η为降解率;A0为降解前原橙黄Ⅱ溶液的吸光度;At为光降解t时间后橙黄Ⅱ溶液的吸光度.
2 实验结果与讨论
2.1 BiOBr对橙黄Ⅱ的光解、吸附、光催化实验对比
BiOBr对橙黄Ⅱ的光解、吸附、光催化实验结果如图1所示.
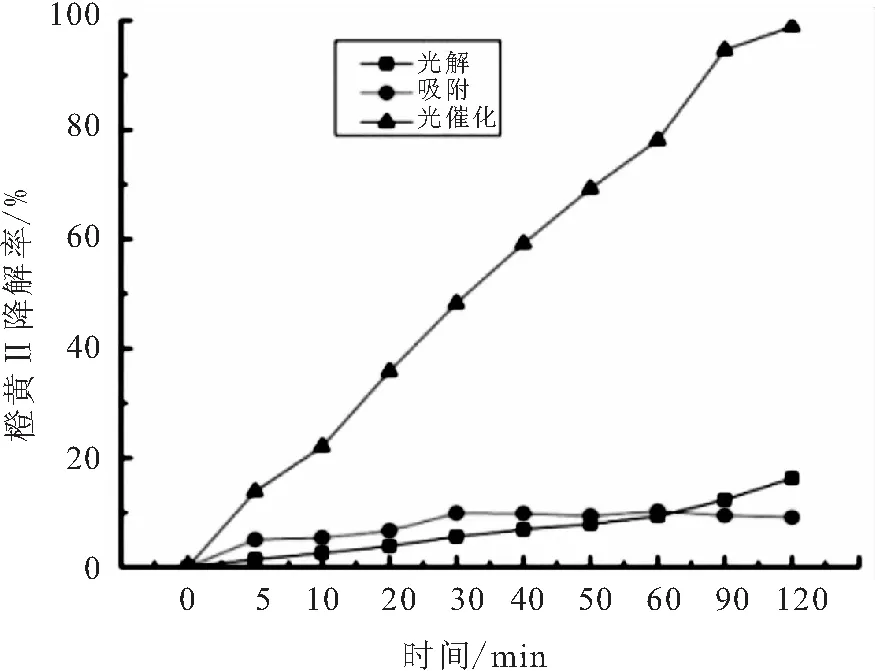
图1 BiOBr对橙黄Ⅱ的光解、吸附、光催化对比Fig.1 Photolysis,adsorption and photocatalysis of orangeⅡ by BiOBr
由图1可以看出,BiOBr光解120 min后橙黄Ⅱ的降解率在17%左右,光解曲线平稳,说明在光照的情况下BiOBr可以对橙黄Ⅱ持续稳定地光解,但光解率较低;而BiOBr对橙黄Ⅱ的吸附作用在30 min左右达到平衡,受催化剂的吸附-解吸动态过程影响,吸附过程稍有反复,总体吸附量在10%左右;由光催化曲线可以明显看出,在光催化反应进行120 min后,橙黄Ⅱ的降解率达到了99%,几乎被完全降解,说明BiOBr在紫外光照射的条件下对橙黄Ⅱ的降解具有良好的催化效果.
2.2 橙黄Ⅱ溶液浓度对光催化实验的影响
选取橙黄Ⅱ溶液的浓度分别为3、5、10、15、20 mg·L-1,BiOBr光催化降解橙黄Ⅱ溶液的实验结果如图2所示.
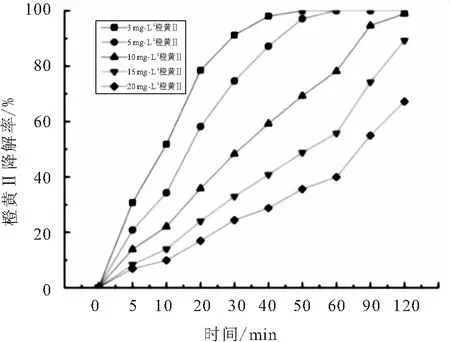
图2 橙黄Ⅱ溶液初始浓度对光催化的影响
由图2可知,随着橙黄Ⅱ溶液浓度的增加,其降解率逐渐降低.当橙黄Ⅱ溶液初始浓度为3 mg·L-1和5 m·L-1时,120 min后橙黄Ⅱ被BiOBr完全降解.光催化反应与光解反应和吸附反应都有着密切的联系,当橙黄Ⅱ溶液浓度增加时,需要被降解的橙黄Ⅱ分子也在增加,而一定量的催化剂在光照的情况下所能产生的自由基和活性点位是一定的,因此降解率势必会减少,此外当被降解物溶液浓度过高时,透光率下降也会影响溶液对光子的吸收,从而影响各种自由基和活性物质的产生,因此溶液的光催化降解率会随着溶液浓度的增加而降低.
2.3 不同催化剂用量对橙黄Ⅱ溶液的吸附和光催化影响
催化剂用量分别为0.05、0.075、0.1、0.15 g时BiOBr对橙黄Ⅱ溶液的吸附和光催化的实验结果如图3、4所示.
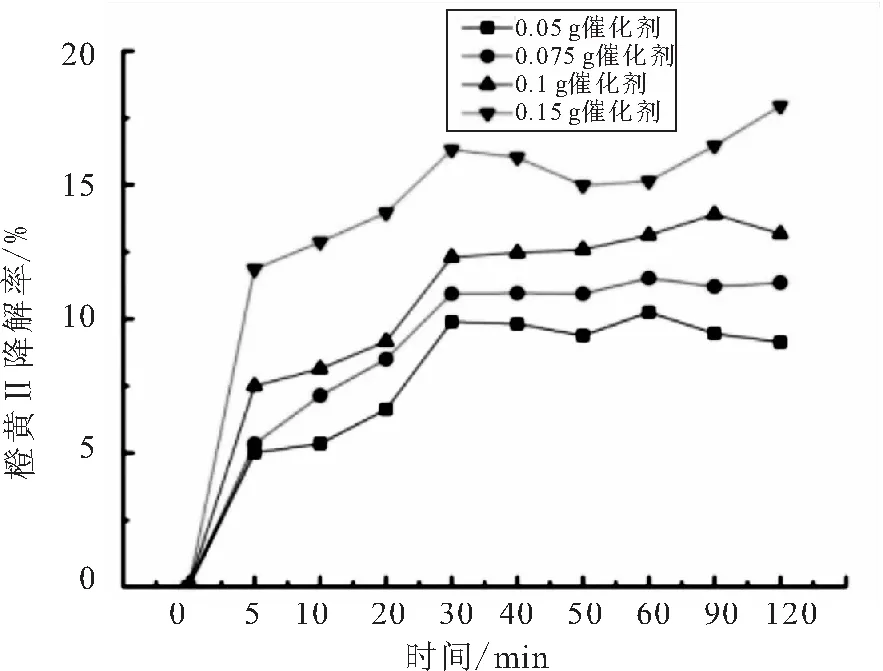
图3 催化剂用量对橙黄Ⅱ的吸附影响
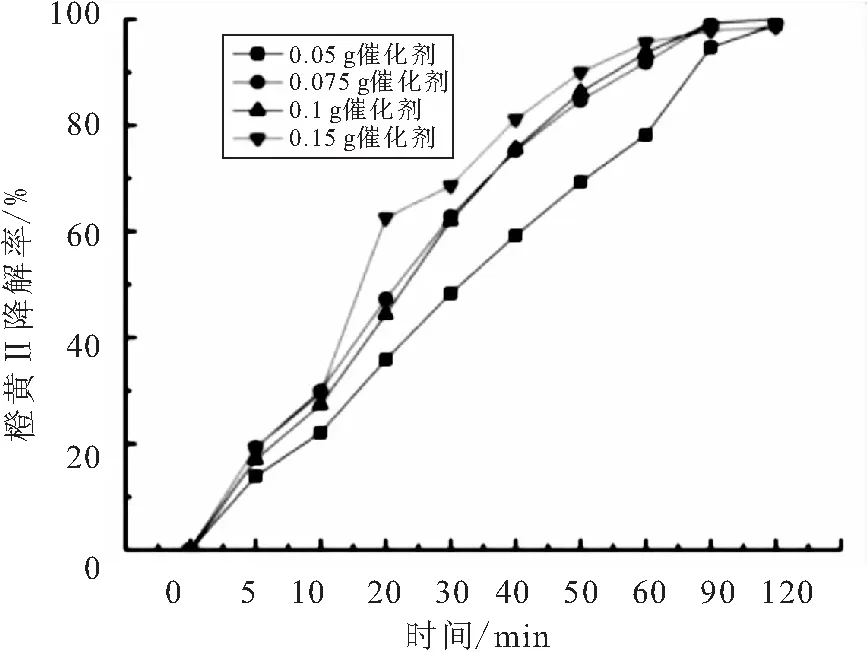
图4 催化剂用量对橙黄Ⅱ的光催化影响
Fig.4EffectofcatalystamountonphotocatalyticdegradationoforangeⅡ
如图3所示,随着催化剂用量的增加吸附率也在增加,所有的吸附曲线走势都大致相同,受吸附-解吸的动态过程影响,吸附过程稍有波动.催化剂投加量的增加使得催化剂表面积增加,因此能吸附的橙黄Ⅱ分子总量增加,从而使得吸附量增加.由图4可以看出,随着投加量的增加反应速率有所加快但最终的降解都达到了99%左右.催化剂量的增加,扩大了催化剂的表面积、产生了更多的活性物质,但催化剂的量过多也影响了光的透光率,因而降解速率以及最终降解率的提高并没有那么明显,所以在实际的应用中,需要寻找最适合、最经济的投加量.
2.4 光强对橙黄Ⅱ反应的影响
通过调节液面与高压汞灯之间的距离改变光照强度,最终光照强度选择为1.123 mW·cm-2和1.95 mW·cm-2,实验结果如图5所示.
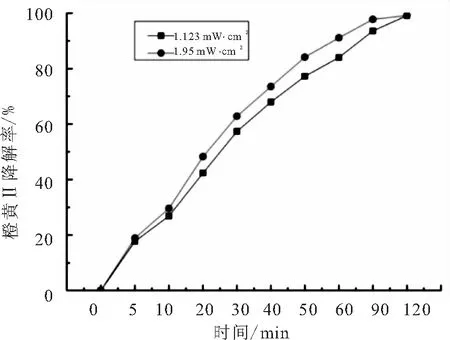
图5 光强对橙黄Ⅱ的光催化反应的影响
提高光照强度会加快反应速率,主要是因为较高的光照强度增加了光的穿透能力,增加了催化剂吸收光子的量,同时提供给反应体系更多的光能,因此反应速率加快.
2.5 溶液pH对橙黄Ⅱ反应的影响
将反应液的pH分别调节至3.28、4.46、5.73、7.72、9.32,并进行60 min的吸附实验,实验结果如图6所示.
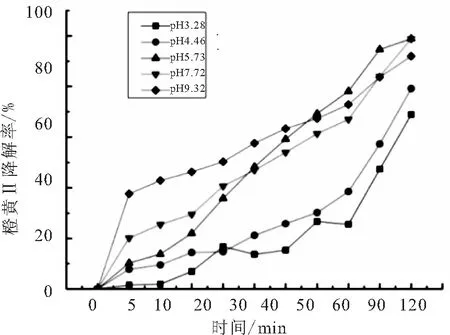
图6 不同初始pH对橙黄Ⅱ的光催化反应的影响
pH对光催化反应的影响主要通过影响催化剂表面吸附、表面特性以及化合物的存在形态等来作用[14].由图6所示的实验结果可以看出,随着pH的升高,反应速度和最终降解率都在增加,这可能是因为随着溶液的pH升高,溶液中的氢氧根离子增加而氢离子减少,因此溶液中的羟基自由基增加,而被氢离子消耗的超氧自由基将会减少,因此溶液中的活性物质增加,从而提高反应速率和降解率.通过吸附60 min的实验结果可以看出溶液的pH越高越有利于橙黄Ⅱ吸附在BiOBr表面,这可能与BiOBr表面的电荷改变有关.
3 自由基清除实验
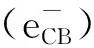
(1)
(2)
(3)
2·HO2→ H2O2+ O2,
(4)
H2O2+ hv → 2·OH ,
(5)
(6)
·OH + ·OH →H2O2,
(7)
(8)
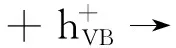
(9)
有机污染物 + ·OH → 各种中间产物 .
(10)
3.1 甲醇对光催化降解的影响
在反应体系中添加甲醇的量分别为:0.1、0.5、1、3、5 mL,实验结果如图7所示.
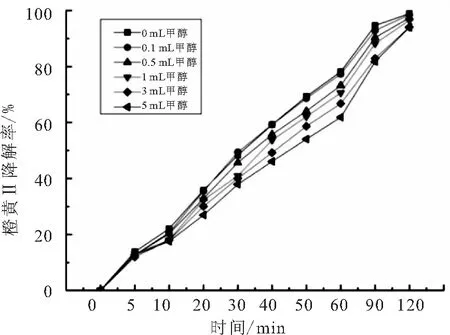
图7 甲醇对橙黄Ⅱ的光催化反应的影响
甲醇作为羟基自由基清除剂(·OH)可以捕获溶液中的羟基自由基(·OH)[16],由图7可看出,添加甲醇对BiOBr光催化降解橙黄Ⅱ的反应并没有造成强烈的影响,虽然降解速率稍有下降,但当添加量增加到5 mL时最终的降解率也达到了90%,因此羟基自由基(·OH)在反应体系中可能不是最主要的氧化剂.
3.2 碘化钾对光催化反应的影响
在反应体系中分别添加0.01、0.1、0.3、0.5、1 g 碘化钾(KI),实验结果如图8所示.
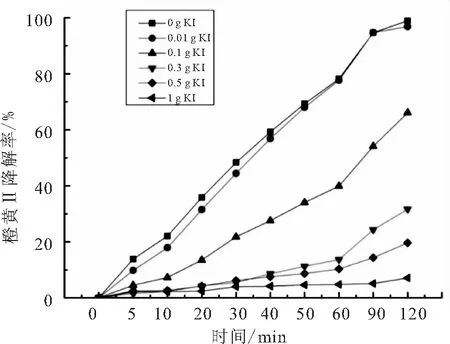
图8 碘化钾对橙黄Ⅱ的光催化反应的影响
3.3 叠氮钠对光催化反应的影响
分别添加0.01、0.03、0.1、0.25、0.5、0.8 g叠氮钠(NaN3)在光催化反应体系中,实验结果如图9所示.
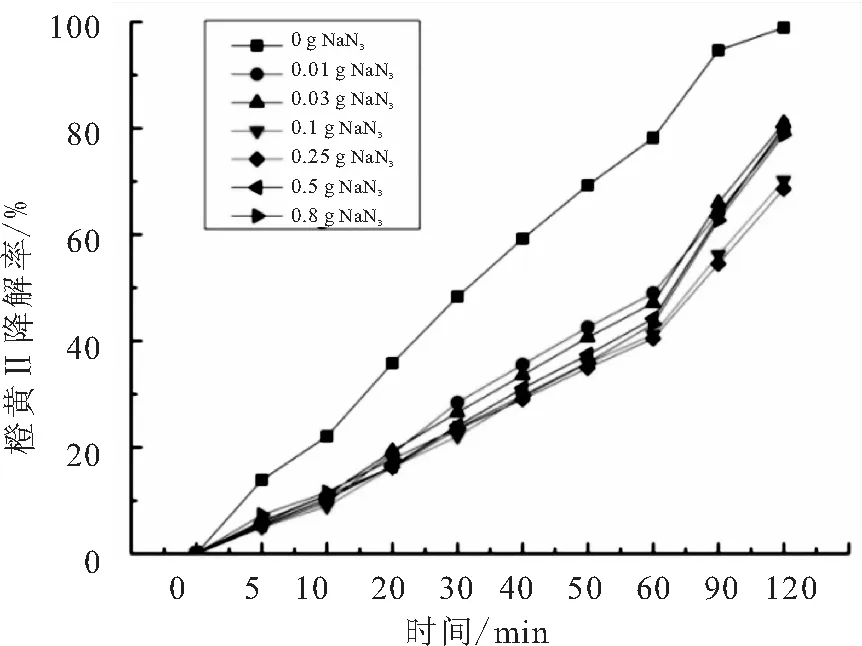
图9 叠氮钠对橙黄Ⅱ的光催化的影响
单线态氧是氧分子吸收能量后形成的激发态氧分子,具有氧化性.叠氮钠可以捕获溶液的中单线态氧[19],由图9所示的实验结果可知,添加叠氮钠对光催化反应产生了一定的抑制作用,说明单线态氧在整个反应体系中发挥了一定的氧化作用.
3.4 苯醌对光催化反应的影响
在反应体系中添加苯醌的量分别为0.25、0.5、1、2 mmol,实验结果如图10所示.
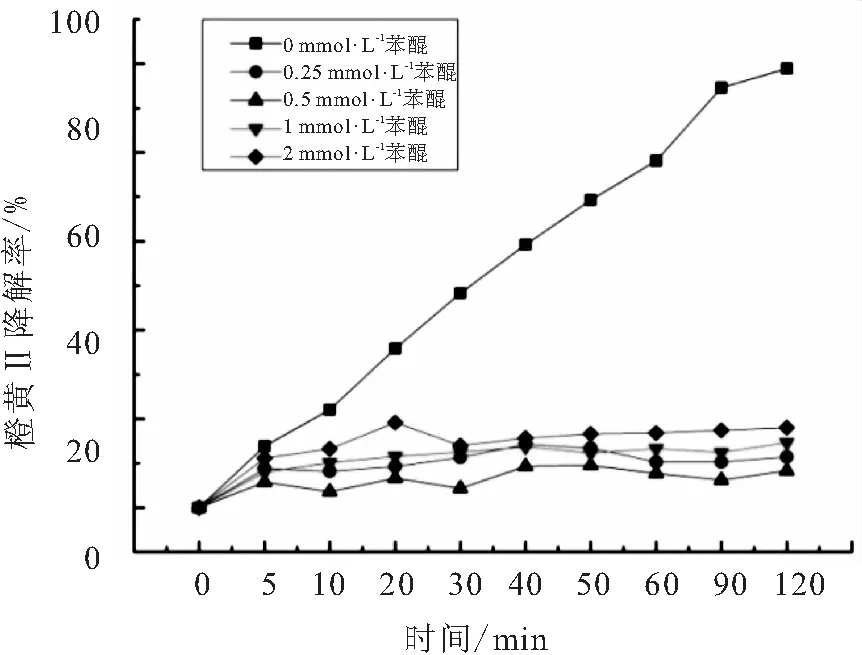
图10 苯醌对橙黄Ⅱ的光催化的影响
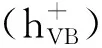
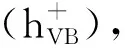
4 卤素元素对光催化反应的影响
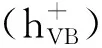
4.1 氟化钠对反应的影响
反应体系中添加氟化钠(NaF)的量为0.01、0.05、0.1、0.5、1 g,实验结果如图12所示.
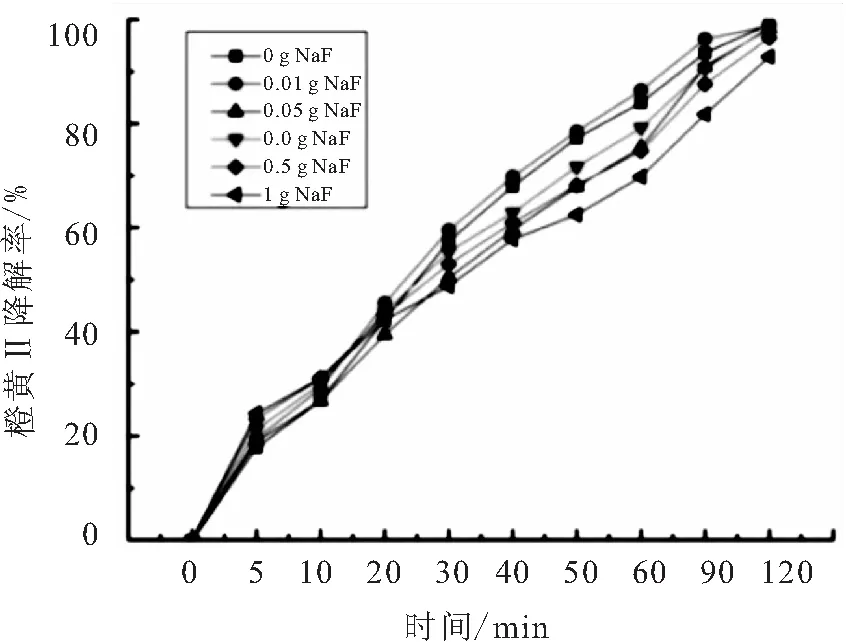
图12 氟化钠对橙黄Ⅱ光催化反应的影响
由图12所示的实验结果看,添加氟化钠对反应并未造成较大的影响,说明F-在反应体系中未能与空穴以及羟基自由基发生反应,或者发生了反应但它生成的新的自由基也具有很强的氧化性,所以反应的降解率依然很高.具体情况还有待更进一步的实验探讨.
4.2 溴化钠对反应的影响
反应体系中添加溴化钠(NaBr)的量分别为0.05、0.1、0.5、1、2 g,实验结果如图13所示.
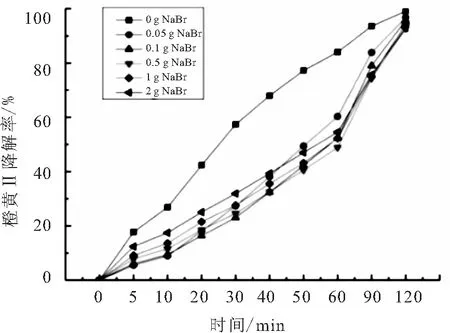
图13 溴化钠对橙黄Ⅱ的光催化反应的影响
由图13所示的实验结果可知,添加溴化钠在反应的前60 min降低了反应速率,但120 min后橙黄Ⅱ的降解率并没有明显降低,说明Br-的添加只是降低了反应速率,可能是因为Br-的存在影响了橙黄Ⅱ分子与各种活性物质的接触但它本身并没有与橙黄Ⅱ争夺活性物质,所以只是使反应速率降低.
4.3 氯化钾对反应的影响
反应体系中添加氯化钾(KCl)的量分别为0.05、0.1、0.5、1、2 g,实验结果如图14所示.
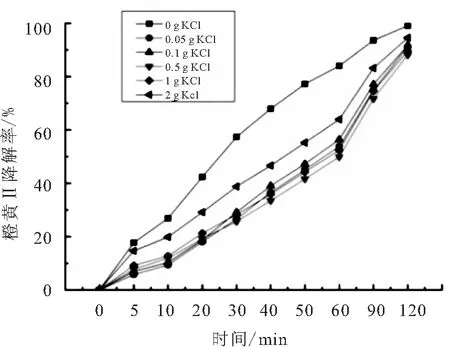
图14 氯化钾对橙黄Ⅱ的光催化反应的影响
由图14可以看出,添加Cl-得到光催化曲线与添加Br-所得到的曲线基本相当,只是Cl-的影响稍微大一点,说明添加Cl-的作用与Br-的作用基本相同,只是降低了反应速率.
通过分别添加NaF、KCl、NaBr进入反应体系得到的实验结果来看,卤素元素对该光催化反应并未造成强烈的影响,只是降低了反应速率而最终的降解率没有明显的减少,说明卤素元素没有与橙黄Ⅱ分子竞争活性物质,只是它们的存在使橙黄Ⅱ分子与活性物质的接触受到一定的阻碍,但这种阻碍也是有限的.
5 结束语
作者主要研究了BiOBr对橙黄Ⅱ的降解情况,实验证明BiOBr在紫外光照射下具备良好的光催化性能,能高效降解橙黄Ⅱ染料.通过改变催化剂的用量、橙黄Ⅱ的浓度、光照强度、pH等研究不同条件对反应的影响.通过自由基清除实验,确定空穴是BiOBr降解橙黄Ⅱ体系中主要的氧化性物种,而空穴与橙黄Ⅱ分子的直接接触对反应至关重要.而卤素元素可能由于没有直接竞争降解橙黄Ⅱ的主要活性物质,因此对反应的影响不大.
参考文献:
[1] Fox M A, Dulay M T. Heterogeneous photocatalysis[J].Chem Rev,1993,93:341-357.
[2] Hoffmann M R, Martin S T, Choi W, et al. Environmental applications of semiconductor photocatalysis[J].Chem Rev,1995,95:69-96.
[3] Ohko Y, Ando I, Niwa C, et al. Degradation of bisphenolA in water by TiO2photocatalyst[J].Environmental Science & Technology,2001,35(11):2365-2368.
[4] 吴兴惠,赵景畅,柳清菊.光催化剂可见光化研究进展[J].云南大学学报:自然科学版,2003,25(3):232-239.
[5] Han F, Kambala V S R, Srinivasan M, et al. Tailored titanium dioxide photocatalysts for the degradation of organic dyes in wastewater treatment: a review[J].Appl Catal A,2009,359:25-40.
[6] 付文,王丽,黄军左.可见光诱导TiO2光催化及其机理研究进展[J].材料学报,2011,25(18):54-58.
[7] 钱逸泰.结晶化学导论[M].合肥:中国科学技术大学出版社,2005:348-352.
[8] Zhang J, Shi F J, Lin J, et al. Self-assembled 3-D architectures of BiOBr as a visible light-driven photocatalyst[J].Chemistry of Materials,2008,20(9):2937-2941.
[9] 魏平玉,杨青林,郭林.卤氧化铋化合物光催化剂[J].化学进展,2009,21(9):1734-1741.
[10] Lin X P, Huang F Q, Wang W D, et al. A novel photocatalyst BiSbO4for degradation of methylene blue[J].Applied Catalysis A: General,2006,307(2):257-262.
[11] Chung K T, Stevens S E J. Degradation of azo dyes by environmental microorganisms and helmints[J].Environ Toxicol Chem,1993(12):2121-2132.
[12] Robert D, Malato S. Solar photocatalysis: a clean process for water detoxification[J].The Science of the Total Environment,2002,291:85-97.
[13] Tian H T, Li J W, Zhao Y P,et al. Removal of bisphenol A by mesoporous BiOBr under simulated solar light irradiation[J].Catalysis Science & Technology,2012,2:2351-2355.
[14] 唐玉朝,胡春,王怡中.TiO2光催化反应机理及动力学研究进展[J].化学进展,2002,3(14):192-199.
[15] Yang S Y, Hu H, Chen Y Y, et al. Role of the reduction site in the fluorinated or sulfated TiO2photocatalytic process[J].Journal of Environmental Sciences,2007,19(10):1239-1244.
[16] Zhang X W, Sun D D, Li G T, et al. Investigation of the roles of active oxygen species in photodegradation of azo dye AO7in TiO2photocatalysis illuminated by microwave electrodeless lamp[J].Journal of Photochemistry and Photobiology A: Chemistry,2008,199(2/3):311-315.
[17] Chen Y X, Yang S Y, Wang K, et al. Role of primary active species and TiO2surface characteristic in UV-illuminated photodegradation of acid orange 7[J].Journal of Photochemistry and Photobiology A: Chemistry,2005,172(1):47-54.
[18] Fujishima A, Zhang X T, Tryk D A. TiO2photocatalysis and related surface phenomena[J].Surface Science Reports,2008,63:515-582.
[19] 章丹,徐斌,朱培娟,等.TiO2光催化降解亚甲基蓝机理的研究[J].华东师范大学学报:自然科学版,2013,5:35-42.
[20] Dionysiou D D, Burbano A A, Suidan M T,et al. Effect of oxygen in a thin-film rotating disk photocatalytic reactor[J].Environ Sci Technol,2002,36(17):3834-3843.
[21] 刘丽娜,李静谊,斯琴高娃,等.可见光照射下卤离子对TiO2/沸石光降解酸性桃红的影响[J].内蒙古石油化工,2008,11:1-4.

