链脲佐菌素诱导的胰岛素缺乏对APP/PS1转基因小鼠脑内tau蛋白磷酸化的影响
王 旭 高素杰
(辽宁中医药大学组胚教研室,辽宁 沈阳 110847)
近年流行病学资料显示,与正常人群相比,阿尔茨海默病(AD)患者脑脊液中胰岛素水平明显下降,并伴有脑内胰岛素信号转导通路障碍〔1〕。同时也有研究发现AD患者脑中胰岛素基因表达减少, 提示脑中胰岛素的含量减低可能与AD发病有直接关系〔2,3〕。但关于脑内胰岛素的缺乏加重AD的发病和发展的机制尚不明确。本研究将采用AD转基因小鼠腹腔内注射STZ制备胰岛素缺乏合并AD的动物模型,观察脑组织内tau蛋白磷酸化改变。
1 材料与方法
1.1实验动物 取3月龄健康雄性APP/PS1转基因小鼠16只,分为两组,每组8只,其中一组APP/PS1转基因小鼠腹腔内注射链脲佐菌素(STZ) (Sigma公司),使用前0.1 mol/L柠檬酸盐缓冲液新鲜配置,剂量为90 mg/kg,连续2 d。另一组作为对照组,注射同等剂量的柠檬酸盐缓冲液。7 d后自尾静脉采血,用便携式血糖测定仪 (美国,强生) 测定血糖水平,随机血糖持续大于15 mmol/L者符合糖尿病标准,表明造模成功。动物精心饲养20 w,每周监测体重和血糖的变化。
1.2小鼠脑组织取材 动物饲养第20周,各组小鼠麻醉后断头,迅速取出大脑放冰盘上,从中间矢状缝切开,一半放入4%多聚甲醛中固定,常规制备石蜡切片,用于免疫组织化学染色;另一半-80 ℃保存备用,供Western 印迹使用。
1.3Western 印迹 取APP/PS1转基因小鼠大脑皮层,按1∶5比例加入蛋白裂解液,超声粉碎,4 ℃裂解过夜,4 ℃ 12 000 r/min低温离心30 min,取上清,考马斯亮蓝法进行蛋白定量。按50 μg蛋白上样,用10%聚丙烯酰胺分离胶,将蛋白质提取物分离,再将其转印到硝酸纤维膜上。用5%脱脂奶粉室温下封闭 1 h后,分别加入鼠抗phosph-tau (Thr231) 抗体 (Invitrogen公司), 兔抗phosph-tau (Thr205) 抗体、兔抗phosph-tau (Ser396),兔抗tau (Abcam公司) 4 ℃过夜。TBST洗后加入辣根过氧化物酶标记羊/鼠抗兔IgG抗体室温孵育1 h,ECL显色,图像分析。
1.4免疫组化染色 石蜡包埋组织切片常规脱蜡至水,以3%H2O2灭活内源性过氧化物酶。PBS液冲洗后,柠檬酸/盐缓冲液中微波修复抗原,正常山羊血清封闭液室温孵育30 min,甩去多余液体,滴加适当稀释的兔抗phospho-tau (Thr489) 抗体 (Beijing Boisynthesis Biotechnology),4 ℃过夜。滴加生物素标记的二抗室温下孵育1 h,滴加链霉素抗生物素蛋白-过氧化酶,室温孵育1 h。DAB显色,苏木素复染,常规脱水,透明,封片,光镜下观察。以上各步骤均用PBS液冲洗,同时另用PBS代替一抗作为阴性对照。

2 结 果
2.1Western 印迹法检测p-tau和tau的表达 Western印迹实验方法检测三个位点tau蛋白 (Thr205、Thr231和Ser396) 的表达 (图1),结果显示:在Thr205位点上两组实验小鼠脑内tau蛋白磷酸化水平比较无显著性差异(0.358±0.047 vs 0.411±0.036,P>0.05);与对照组比较,STZ组tau蛋白在位点Thr231(0.622±0.083 vs 1.178±0.092)和Ser396(0.449±0.068 vs 1.304±0.108)上的磷酸化程度显著增高(P<0.01);两组实验小鼠脑内总tau蛋白的表达增高无显著差异(0.590±0.068 vs 0.645±0.071,P>0.05)。

图1 STZ致APP/PS1转基因小鼠脑内多位点tau蛋白过度磷酸化
2.2免疫组化检测p-tau的表达 在STZ组皮层神经元的核周区胞质中出现大量的棕黄色p-tau阳性表达颗粒,在同一区域内对照组胞质中仅见极少量棕黄色颗粒。STZ组p-tau阳性细胞免疫反应强度高于对照组(0.036±0.006 vs 0.109±0.012,P<0.05)。见图2。
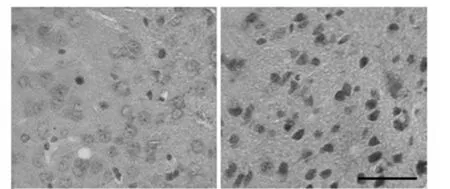
对照组 STZ组
3 讨 论
AD的主要病理特征是脑内淀粉样蛋白沉积形成的老年斑 (SP) 和神经元内出现神经原纤维缠结 (NFTs)。胰岛素是由胰岛β细胞分泌的一种蛋白质类激素,其主要功能是降低血糖。研究发现脑内存在胰岛素和胰岛素受体 (IR)。脑内的胰岛素可以由外周血中胰岛素通过血脑屏障入脑,同时脑内的部分神经元也能够合成和分泌胰岛素〔4,5〕。近年来,大量流行病学和临床研究发现脑中胰岛素的含量减低可能与AD发病有直接关系〔2,3〕,给予胰岛素治疗可使AD症状减轻〔6〕。本实验前期研究已经发现胰岛素缺乏可使APP/PS1转基因小鼠的AD症状加重,其机制是通过增强了APP向淀粉样斑块沉积形成通路的代谢,从而使Aβ的分泌大大增多〔7〕。但胰岛素缺乏是否也能引起tau蛋白过度磷酸化从而使AD症状加重的研究并未进行,而且国内尚未见报道。
Tau蛋白是一种重要的小分子微管相关蛋白,其作用为促进微管组装和稳定微管,其促微管活性与磷酸化状态密切相关,过度磷酸化的tau蛋白是NFTs的主要组成部分,是AD病理改变中重要的标记性蛋白,与AD的发病有着不可分割的联系〔8〕。有研究表明胰岛素的功能障碍与tau蛋白的异常磷酸化有着密切的关系。Freude等〔9〕通过注射胰岛素使外周血液中胰岛素浓度增高,结果发现脑内tau蛋白Ser202位点磷酸化。另外,这项研究也报道了在胰岛素受体缺乏的转基因小鼠模型中,由于胰岛素信号转导系统发生障碍从而导致脑内tau蛋白的过度磷酸化。Clodfelder-Miller等〔10〕研究也发现,向小鼠腹腔内注射STZ诱导产生胰岛素缺乏可导致小鼠脑内多个位点的tau蛋白过度磷酸化。
本研究研究结果发现在STZ组的APP/PS1转基因小鼠脑内所检测的Thr231、Ser396位点tau蛋白发生过度磷酸化改变。胰岛素缺乏能导致tau蛋白过度磷酸化,从而加重AD发病。
4 参考文献
1Gasparini L,Netzer WJ,Greengard P,etal. Does insulin dysfunction play a role in Alzheimer's disease〔J〕. Trends Pharmacol Sci, 2002; 23(6):288-93.
2Brands AM,Kessels RP,de Haan EH,etal. Cerebral dysfunction in type 1 diabetes: Effects of insulin,vascular risk factors and blood-glucose levels〔J〕. Eur J Pharmacol,2004; 490(1-3):159-68.
3de la Monte SM,Wands JR. Molecular indices of oxidative stress and mitochondrial dysfunction occur early and often progress with severity of alzheimer's disease〔J〕. J Alzheimers Dis,2006; 9(2): 167-81.
4Craft S,Watson GS. Insulin and neurodegenerative disease: Shared and specific mechanisms〔J〕. Lancet Neurol,2004; 3(3): 169-78.
5Baskin DG,Figlewicz DP,Woods SC,etal. Insulin in the brain〔J〕. Annu Rev Physiol,1987; 49: 335-47.
6Park CR,Seeley RJ,Craft S,etal. Intracerebroventricular insulin enhances memory in a passive-avoidance task〔J〕. Physiol Behav,2000; 68(4): 509-14.
7Wang X,Zheng W,Xie JW,etal. Insulin deficiency exacerbates cerebral amyloidosis and behavioral deficits in an Alzheimer transgenic mouse model〔J〕. Mol Neurodegener,2010; 5: 46-58.
8Janson J,Soeller WC,Roche PC,etal. Spontaneous diabetes mellitus in transgenic mice expressing human islet amyloid polypeptide〔J〕. Proc Natl Acad Sci U S A,1996; 93: 7283-8.
9Freude S,Plum L,Schnitker J,etal.Peripheral hyperinsulinemia promotes tauphosphorylation in vivo〔J〕.Diabetes,2005;54(12):3343-8.
10Clodfelder-Miller BJ,Zmijewska AA,Johnson GV,etal.Tau is hyperphosphorylated at multiple site in mouse brain in vivo after streptozotocin induced insulin deficiency〔J〕.Diabetes,2006;55(12):3320-5.

