绞股蓝总皂苷对阿霉素致心力衰竭大鼠心功能的影响
葛 敏 刘国平 关宿东
(蚌埠医学院药理学教研室,安徽 蚌埠 233003)
阿霉素(ADR)被广泛用于治疗实质性及血液系统恶性肿瘤,但随着剂量的增加患者常伴有扩张型心肌病和充血性心力衰竭〔1,2〕,且预后很差,因而临床应用受到限制。绞股蓝属于葫芦科绞股蓝属植物,其主要药效成分为绞股蓝总皂苷(GP)。GP具有较强的抗氧化、抑制细胞内Ca2+超载〔3,4〕等多种药理作用。本研究旨在探讨GP对ADR致心力衰竭大鼠心脏功能的影响及作用机制。
1 材料与方法
1.1实验动物 SD大鼠50只,体重(232±13)g,由蚌埠医学院实验动物中心提供。
1.2实验药物和试剂 GP(纯度90%),购于惠州绿源公司;盐酸ADR:浙江海正药业有限公司生产(批号:070501)。ATPase试剂盒、琥珀酸脱氢酶(SDH)试剂盒和Ca2+-ATPase试剂盒购自南京建成生物工程研究所;RT-PCR试剂盒:宝生物(大连)有限公司;Trizol 100ml/瓶:Invitrogen公司;Tris-HCl购自美国Promega公司;其余试剂均为国产分析纯。
1.3动物模型制备 大鼠随机分为五组,即正常对照组(NC),ADR组,GP低、中、高剂量(L-GP、M-GP、H-GP)组,每组10只。具体处理如下:ADR给药方法:除NC组外,其余各组均腹腔注射ADR,2.5 mg/kg体重,隔日1次,共6次,累积剂量15 mg/kg体重,NC组给予等容量的生理盐水腹腔注射,隔日1次,共6次;GP给药方法:GP低、中、高剂量组分别在注射ADR半小时前给予0.5%、1%、2%GP 10 ml·kg-1·d-1灌胃,共6 w;对照组等量的生理盐水灌胃,1次/d,连续6 w。
1.4心功能测定 实验第7周,20%乌拉坦5 ml/kg腹腔注射麻醉大鼠,肝素化(1%肝素1 ml/kg股静脉注入),手术游离出右侧颈总动脉,经其插入自制的心室插管(直径1 mm,充满1%肝素),描记血压曲线;再继续插入左心室,描记室内压曲线,自动分析处理左室收缩压(LVSP)、左室舒张末压(LVEDP)、心室内压最大上升/下降速率(±dp/dtmax)等数据。
1.5心肌组织ATPase和SDH活性测定 取其左心室肌,标本放置-80℃冰箱保存。心肌匀浆测定ATPase活性和SDH活性,蛋白定量采用考马斯亮蓝法,严格按照试剂盒说明书操作。
1.6心肌肌浆网Ca2+-ATPase(sarcoplasmic reticulum Ca2+-ATPase,SERCA2a)活性测定 ①心肌SR制备:按文献〔5〕的方法制备心肌SR膜:取定量左心室组织置于4℃匀浆液(NaHCO310 mmol/L,NaN35 mmol/L,Tris-HCl 15 mmol/L,pH6.8)进行匀浆,经离心(9 500 r/min,20 min)去除细胞碎片,上清液再离心(19 000 r/min,45 min),将沉淀悬浮于缓冲液(KCl 600 mmol/L,Tris-HCl 10 mmol/L,pH6.8)中离心(19 000 r/min,45 min),沉淀即为SR膜,悬浮于缓冲液(sucrose 250 mmol/L,histidine 1 mmol/L)。②心肌肌浆网蛋白测定:采用考马斯亮蓝法。心肌SERCA2a活性测定:采用无机磷酸根法。
1.7心肌超微结构观察 大鼠处死时,取心尖部切成1 mm3小块,2.5%戊二醛固定,电镜观察超微结构变化。
1.8逆转录-聚合酶(RT-PCR)半定量测定SERCA2a mRNA的表达 ①引物设计 β-actin(285 bp):上游引物5′-TCATGAAGTGTGACGTTGA CATC CGT-3′,下游引物5′-CCTAGAAGCATTTGCGGTGCA CGATG-3′;SERCA2a(134 bp):上游引物5′-AAGCAGTTCATCCGCTACCT-3′,下游引物5′-AGACCATCCGTCACCAGATT-3′,均由上海生工合成。②RT-PCR反应:取100 mg 组织采用Trizol 法提取心肌组织总RNA。反应体系20 μl ,包括10×PCR缓冲液2 μl,MgCl24 μl,dNTP(各10 mmol/L)2 μl,去DEPC水7.5 μl,Random 9 mers 1 μl, RNA酶抑制剂(40 U/μl) 1 μl,RNA 2 μl。反应条件:30℃10 min,50℃20 min,94℃5 min,5℃5 min然后进入PCR 循环,PCR反应体系40 μl:Taq 酶0.5 μl,上下游引物各0.5 μl,去DEPC水28.75 μl,5×PCR缓冲液10 μl;94℃预变性2 min,94℃30 s,60℃30 s, 72℃2 min,循环30次。取PCR 产物5 μl于2 %琼脂糖凝胶电泳,然后在凝胶成像系统上扫描,测定SERCA2a mRNA和β-actin mRNA扩增产物的吸光度值,分别计算其比值。

2 结 果
2.1血流动力学指标的变化 与NC组相比,ADR组LVSP和±dP/dtmax均明显下降,LVEDP上抬(P<0.05),提示ADR致大鼠慢性心力衰竭模型成功,ADR组大鼠发生心肌损伤;与ADR组相比,GP各组LVSP和±dP/dtmax均有升高,其中M-GP、H-GP组LVSP和±dp/dtmax均显著升高(P均<0.01),LVEDP显著下降 (P均<0.01),表明中、高剂量GP对ADR致心脏毒性有较好的保护作用,可明显改善心力衰竭大鼠的心脏收缩与舒张功能。见表1。
2.2心肌组织ATPase活性和SDH活性的变化 与NC组相比,ADR组心肌ATPase活性和SDH活性明显下降(P<0.01)。GP中、高剂量组与ADR组比较,心肌组织中ATPase活性和SDH活性均升高(P<0.05,P<0.01)。与NC组相比,GP各组心肌组织中ATPase活性和SDH活性比较差异有显著性(P<0.05,P<0.01) 。见表1。
2.3心肌超微结构变化 NC组:肌小节Z线排列整齐;线粒体形状规则,嵴丰富,排列规则;细胞核完整。ADR组:心肌细胞内肌原纤维断裂、溶解,肌浆网扩张,肌小节失去正常结构;线粒体水肿,嵴减少或消失,甚至空泡变。L-GP组:心肌肌原纤维尚整齐,部分横纹不清;线粒体肿胀变性和局限性增多,部分嵴断裂和溶解。M-GP组:肌小节灶性溶解,断裂,部分横纹模糊不清;肌浆网轻度扩张;线粒体大小不一,部分线粒体轻度水肿。H-GP组:心肌病变明显减轻,肌原纤维排列整齐,无溶解、坏死等病变,仅部分线粒体水肿、空泡变。见图1。
2.4心肌组织SERCA2a活性和SERCA2a mRNA表达的变化 与NC组相比,其余各组SERCA2a活性和SERCA2a mRNA表达均有显著性下降(P<0.01);与ADR组相比,M-GP和H-GP组SERCA2a活性和SERCA2a mRNA表达均增加(P<0.05,P<0.01)。见图2和表2。

表1 GP对ADR中毒大鼠心功能、心肌组织SDH活性和ATPase活性的影响±s)

图1 各组大鼠心肌超微结构(×12 000)
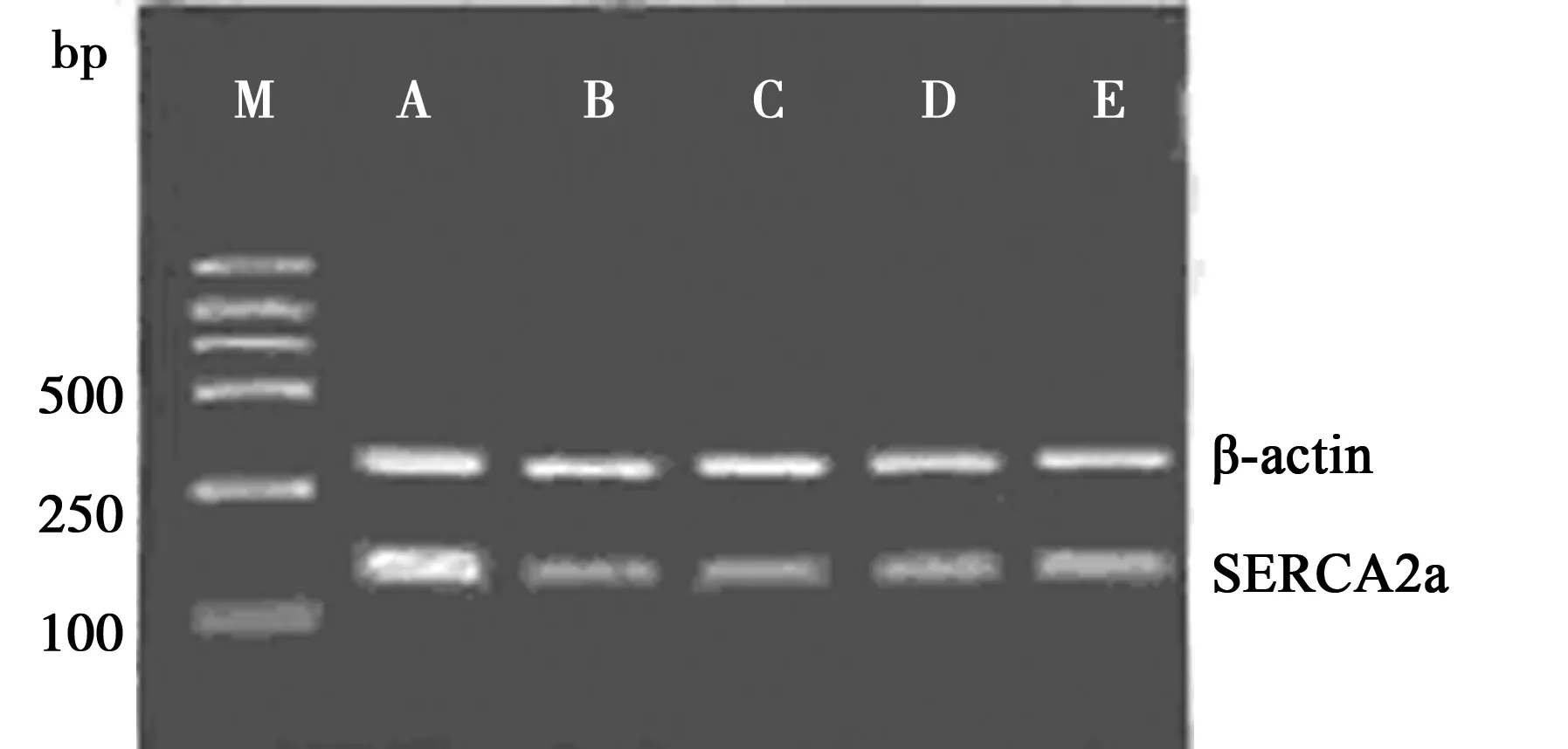
M:Marker;A:NC组;B:ADR组;C:L-GP组;D:M-GP组;E:H-GP组

表2 GP对ADR中毒大鼠心肌SERCA2a酶活性和mRNA表达的影响±s)
3 讨 论
ADR最明显的副作用之一是剂量依赖的不可逆转的心肌病伴有充血性心力衰竭的扩张型心肌病〔1,2〕。ADR致心脏毒性具体机制尚不完全清楚,研究表明主要与脂质过氧化增强,细胞内钙超载及细胞凋亡有关。实验观察到,ADR中毒后,其功能及形态学上的改变,可能是ADR使氧自由基生成增多,细胞膜产生脂质过氧化,造成质膜损伤,无法形成正常肌小节,对心肌细胞膜完整性具有损害作用〔5〕,从而损伤心肌收缩和舒张功能。
细胞内Ca2+转运异常是心力衰竭患者心室收缩和舒张功能降低的主要原因,胞浆内钙的超负荷可引起心肌收缩和舒张功能的异常。由于心肌线粒体内膜富含心磷脂,其DNA缺少组蛋白的保护,因而更易于受到氧自由基的攻击而导致结构和功能损伤。线粒体是能量代谢的重要场所,ATP的产生和储存在线粒体进行,心肌细胞几乎全赖有氧代谢产生ATP以供细胞生存及做功的需要。当线粒体生成ATP减少,可导致ATP依赖性酶功能障碍。ADR可直接抑制Na+-K+-ATP 酶活性,使Na+-K+交换减少,Na+-Ca2+交换增加,从而增加钙内流,诱发钙超载〔6〕。在心肌细胞内Ca2+的调节中,SERCA2a起主要作用。心肌细胞收缩期间释放到胞质的钙离子60%~90%是由SERCA2a转运入肌浆网内储存〔7〕,由于大部分Ca2+由SERCA2a摄入肌浆网,导致心肌舒张,并为下一次收缩储备Ca2+,因此SERCA2a在心肌舒、缩中起重要作用。肌浆网Ca2+-ATPase表达减低,钙泵对胞质内Ca2+的摄取下降,造成细胞内Ca2+超负荷,心肌细胞不能有效地舒张〔8〕。SERCA2a表达的增高使Ca2+能在舒张期更快地回泵入肌浆网,从而加速心肌舒张的速度和心室总体舒张功能,使舒张末期压降低,减少心肌的压力和容量过负荷。ADR致心衰时,细胞内长期处于Ca2+超载状态,细胞对Ca2+不敏感,导致收缩功能降低〔9,10〕。
本研究结果显示GP给予预防性处理后,中、高剂量组大鼠心脏功能明显改善,超微结构损伤减轻。进一步研究表明GP可能通过增加SERCA2a mRNA的表达,而增加SERCA2a活性;也可以抑制Ca2+内流〔3〕,从而调节了心肌细胞的钙稳态;通过提高心肌组织ATPase活性、SDH活性而改善ADR对心功能的影响。综上,GP是通过其抗脂质过氧化作用,增加SERCA2a mRNA的表达,抑制细胞内Ca2+超载起到保护作用,但具体机制有待进一步深入研究。
4 参考文献
1Swain SM, Whaley FS, Ewer MS. Congestive heart failure in patients treated with doxorubicin a retrospective analysis of three trial〔J〕.Cancer,2003; 97(11): 2869-79.
2杨冬花,付 蓉,罗建华,等.心力衰竭大鼠不同时期血浆内皮素-1、降钙素基因相关肽及神经肽Y水平变化及益气温阳活血方对其影响〔J〕.中国老年学杂志,2012;32(21):4668-70.
3赵 颖,胡大一.绞股蓝总皂苷对单个豚鼠心室肌细胞的钙、钠、钾电流及动作电位的影响〔J〕.中国药理学通报,1998;14(1): 60-2.
4韦登明,饶广勋,张建明.绞股蓝总甙对大鼠脑局灶性缺血再灌注神经细胞凋亡影响的实验观察〔J〕.中国老年学杂志,2004;24(11):1046-8.
5Wallac KB. Doxorubicin induced cardiac mitochondrionopathy〔J〕. Pharmacol Toxicol, 2003;93(3):105-15.
6Huang XM, Zhu WH, Kang ML. Study on the effect of doxorubicin on expressions of genes encoding myocardiac sarcoplasmic reticulum Ca2+transport myocardiac protection in rabbits 〔J〕 .J Zhejiang Univ Sci, 2003;4 (1):114-20.
7Chossat N, Griscelli F, Jourdon P,etal. Adenoviral SERCA1a gene transfer to adult rat ventricular myocytes induces physiological changes in calcium handling 〔J〕. Cardiovasc Res,2001;49(2):288-97.
8钟 明,张 薇,卜培莉,等.肌浆网钙泵和磷酸受纳蛋白在舒张性心衰患者中的表达〔J〕.中国老年学杂志,2002;22(3):209-11.
9Li MX, Tian GZ, Ou YT,etal. The establishment of a chronic heart failure model by adrinmycin and judgment of the indexes〔J〕.Am Nat Res, 2005;27(3):176-8.
10Matin E, Thougaard AV, Grauslund M,etal. Evaluation of the topoisomerase Ⅱ-inactive bisdioxopiperazine ICRF-161 as a protectant against doxorubicin-induced cardiomyopathy 〔J〕.Toxicology,2009;255(1/2):72-9.

