慢病毒介导多短发卡RNA串联载体构建与体内外抗口蹄疫效果评估
张晓溪,李兰玉,刘庆友,郑海学,李湘萍,崔奎青,石德顺
(1广西大学动物科学技术学院,广西南宁 530005;2中国农业科学院兰州兽医研究所,甘肃兰州 730046)
慢病毒介导多短发卡RNA串联载体构建与体内外抗口蹄疫效果评估
张晓溪1,李兰玉1,刘庆友1,郑海学2,李湘萍1,崔奎青1,石德顺1
(1广西大学动物科学技术学院,广西南宁 530005;2中国农业科学院兰州兽医研究所,甘肃兰州 730046)
【目的】探讨应用多短发卡RNA(shRNA)串联沉默口蹄疫病毒RNA复制的可行性.【方法】针对口蹄疫病毒(Foot and mouth disease,FMDV)非结构蛋白基因3B和3D保守区域设计合成3个shRNA的串联片段,并分别用3个不同序列的启动子引导,成功构建了3shRNA串联的慢病毒RNAi载体.利用慢病毒3质粒包装系统共转于293T细胞包装成慢病毒颗粒.利用包装的慢病毒处理细胞及乳鼠,并接种FMDV,观察FMDV抑制情况.【结果和结论】结果显示,慢病毒处理BHK-21获得的转基因细胞中检测shRNA表达;通过O型FMDV接种发现转基因细胞对口蹄疫病毒的复制有明显的抑制,其中在接种后24 h病毒拷贝量仅为普通细胞的1/3;O型FMDV毒株接种于抗口蹄疫慢病毒载体预处理过的3~5日龄乳鼠,在5 LD50滴度下全部乳鼠均存活,在20 LD50滴度下存活率也提高50%.构建的慢病毒介导多shRNA串联表达抗口蹄疫载体能提高BHK-21细胞和乳鼠对口蹄疫病毒的抵抗力,有效地避免了5 LD50滴度内乳鼠的死亡现象,具有抵抗口蹄疫病毒毒性的良好性能.
口蹄疫病毒;多shRNA;慢病毒载体;抗病毒
口蹄疫(Foot-and-mouth disease,FMD),是由口蹄疫病毒(Foot-and-mouth disease virus,FMDV)引起的以侵害偶蹄动物为主的急性、热性、高度接触性人畜共患传染病,在国际上受到高度重视.该病毒属于小RNA病毒科FMDV属,有O型、A型、C型、SATⅠ型、SATⅡ型、SATⅢ型及AsiaⅠ型等7个血清型,70多个亚型,各型之间无交叉反应.流行病学调查和试验感染证明,有100多种动物可以感染.口蹄疫已被世界动物卫生组织(World organization of animal health,OIE)列为A类动物传染病之首.至今,科学家们已针对FMDV不同基因在细胞和动物等不同水平对RNAi抗FMDV效果进行了研究和探索[1-4].有报道指出,在长期使用siRNA抑制病毒复制的治疗过程中会使病毒基因变异而产生RNAi抗性,导致病毒逃逸[5-6].而为了解决这一问题,人们开始将病毒基因组保守区或同时以不同基因序列作为靶基因[6-9].经过科学家们多年研究表明,具有茎环结构的shRNA分子比在细胞中直接导入siRNA对靶基因的抑制效率高;而shRNAs通过转染可整合基因的质粒载体或反转录病毒载体、慢病毒载体进行表达,能够稳定长效地抑制靶基因表达[10].2008年,Brake等[11]对慢病毒介导几种shRNAs以不同的启动子进行多重shRNA表达从而抑制HIV-1复制,结果发现,载体中每个shRNA的表达与单独表达这些shRNA的效率基本一致.这样的多个shRNA串联表达载体设计可以在转入载体量不变的条件下整体增加shRNA表达的效率.本研究拟选取高度保守的适于设计shRNA的位点,以多个shRNA串联表达的载体形式,构建靶向FMDV的shRNA表达载体,并且对表达的siRNA在体外和体内抑制口蹄疫病毒复制的能力进行了评估,为进一步生产抗口蹄疫转基因家畜奠定了基础.
1 材料与方法
1.1 主要试验材料
慢病毒3质粒包装系统(pNRF、pVsvg和pSicoR)、293T细胞和BHK-21细胞由广西大学亚热带农业生物资源保护与利用国家重点实验室自行保存;脂质体LipofectamineTM2000、DMEM细胞培养基及胎牛血清(FBS)为美国Invitrogen公司产品;试验用昆明小鼠由中国农业科学院兰州兽医研究所提供.所有涉及FMDV试验操作均在中国农业科学院兰州兽医研究所国家口蹄疫参考实验室进行.
1.2 主要试验方法
1.2.1 选择抗口蹄疫shRNA 通过比对O、Asia I、A、C等血清型不同毒株的FMDV基因组序列(AF189157、AY304994、AY593751和AF274010),选择非结构蛋白基因3B和3D的保守区间设计3段shRNA,由南京金斯瑞生物科技有限公司合成.
1.2.2 构建多shRNA串联抗口蹄疫表达质粒 将水牛7SK启动子(JN417658)、水牛U6启动子(JN417659)以及牛U6启动子(DQ150532)分别连接在3个shRNA的5′端,并将3组shRNA表达框串联,以慢病毒载体质粒pSicoR为载体骨架,构建成多个抗口蹄疫shRNA表达载体pSicoR-3shRNA.获得的质粒pSicoR-3shRNA属于慢病毒载体中的载体质粒.
1.2.3 包装慢病毒和测定滴度 将293T细胞传代至事先铺过明胶的培养皿中,使293T细胞贴壁能力增强,减少其在转染过程中的脱落.用脂质体法将载体质粒pSicoR-3shRNA与慢病毒包装质粒pNRF、包膜质粒pVsvg以2∶3∶1的比例共转至293T细胞中.转染后24 h观察荧光情况.此时pVsvg表达形成的病毒衣壳会导致293T细胞变形,但不影响病毒的形成.转染后72 h收集细胞上清液,3 000 r/min离心10 min,以去除细胞碎片,0.45μm滤器过滤,其中一小部分分装成500μL/管,-80℃条件冷冻保存.取10μL病毒原液用Reed-Muench法进行慢病毒滴度测定.
1.2.4 制备慢病毒介导转基因BHK-21细胞与检测shRNA表达 将500μL病毒原液成滴加入BHK-21细胞培养皿中,轻轻摇晃以使培养基混合均匀,置于37℃CO2培养箱孵育12~24 h后,换成含体积分数为10%FBS的DMEM培养基.感染72 h后通过荧光显微镜观察细胞荧光表达情况;通过流式细胞仪分选,得到转基因细胞系(BHK-LV).利用茎-环RT-PCR法,以U6基因作为内参基因,检测3条shRNA表达情况.
1.2.5 绘制FMDV在BHK-LV中的复制曲线 将BHK-LV和普通BHK-21细胞以2×105mL-1分别接种于7个24孔板中,24 h后,将O型口蹄疫病毒HKN/2002以毎细胞5×103TCID50的比例接种于细胞中.分别在接毒后6、12、18、24、36和48 h收集细胞及所有上清液.各取200μL收集的细胞混合液至96孔RNA提取板中,用QIAGEN全自动高通量核酸提取工作站(QIAxtractor)提取总RNA后,吸取等体积的总RNA,根据Shaw等[12]的文献报道,用Super-ScriptⅢ/Platinum Taq One-Step rRT-PCR试剂盒进行荧光定量PCR.根据相关报道[13],以FMDV基因组的5′端UTR区保守序列为靶序列设计Taq Man®引物(SA-IR-219-246F和SA-IR-315-293R)以及探针(SAmulti2-P-IR-292-269R).定量PCR试验步骤参考SuperScriptⅢ/Platinum Taq One-Step rRT-PCR试剂盒使用说明书进行.
定量PCR反应结果测定、分析均利用Stratagene® MxProTMQPCR软件获得[13].通过FMDV复制的标准曲线回归方程计算出每个时间点的病毒RNA拷贝数,绘制细胞中O型FMDV 1~48 h内的病毒复制曲线.
1.2.6 抗口蹄疫慢病毒载体的乳鼠FMDV抗性试验 在预试验中,先对FMDV在本次试验用的昆明小鼠上的LD50进行校正.将本次启用的O型FMDV原液用PBS缓冲液进行10倍稀释,并用105~108稀释度的病毒液分别对每组4只小鼠进行颈后皮下接种,每组各设1只小鼠用生理盐水注射作为阴性对照,接种后72 h观察小鼠死亡情况.
将滴度>1×108TU/mL的纯化抗口蹄疫慢病毒颗粒(LV-3shRNA)用PBS稀释10倍,以每只0.2mL的剂量颈后皮下注射3~5日龄乳鼠,阴性对照用PBS代替慢病毒接种(表1).经LV-3shRNA处理24 h后,每只乳鼠颈后皮下分别注射5、20、100和1 000 LD50滴度的O型FMDV 0.2 mL.各滴度组乳鼠数量见表1.接毒后12、24、30、36、48、72 h和7 d观察LV-3shRNA组及阴性对照组各滴度接种鼠的死亡情况.7 d后每个滴度组各选择1只乳鼠,提取RNA,用SuperScriptⅢ/Platinum Taq One-Step rRT-PCR试剂盒进行实时定量PCR检测病毒含量.

表1 试验乳鼠的分组Tab.1 Grouping the experimental sucklingm ice
2 结果与分析
2.1 多shRNA串联抗口蹄疫表达质粒构建
根据GenBank上O型FMDV基因组序列(AF189157),选择3个FMDV非结构蛋白基因3B和3D保守区间:(1)3B区域中5′-CCT GTC GCT TTG AAA GTG AAA GC-3′位于4 900~4 922 nt;(2)3D区域中5′-GAG ATT CCA AGC TAC AGA TCA CTT TAC CTG CGT TGG GTG AAC GCC GTG TGC GGT GAC GC-3′位于6 934~6 992 nt;(3)3D区域中5′-GAC GAG TAC CGG CGT CTC TTT GAG CC-3′位于6 892~6 917 nt[1].设计3个shRNA,其序列如图1A.
将启动子依次连入3个shRNA串联序列后,得到p18T-3shRNA,用XbaⅠ/NotⅠ双酶切得到的片段(XbaⅠ-bu7SK-Cons1-buU6-Cons2-boU6-Cons3-loxPNotⅠ)约1 298 bp.多个抗口蹄疫shRNA表达载体pSicoR-3shRNA结构如图1B.
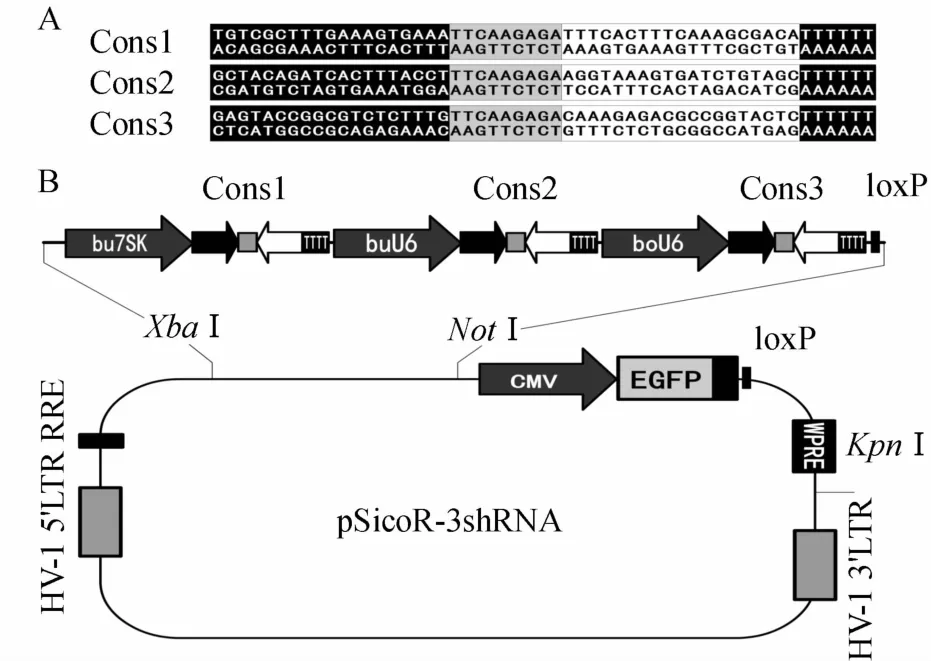
图1 shRNA序列和抗口蹄疫载体构建Fig.1 Sequences and expression vector constructions ofmultiple FMDV-specific shRNAs
2.2 转基因细胞BHK-LV制备和阳性细胞表达检测
应用QIAGENE去内毒素质粒纯化试剂盒,获得高质量的pSicoR-3shRNA、pNRF与pVsvg载体质粒.将3个慢病毒质粒共转染293T细胞,72 h后在荧光倒置显微镜488 nm波长蓝光下观察绿色荧光表达情况,如图2A显示,接近100%的293T细胞检测到绿色荧光,部分细胞之间无明显间隙,细胞有明显拉丝现象,说明细胞已经开始生产慢病毒颗粒.此时收集细胞培养上清液,即为慢病毒原液.将大量收集的慢病毒原液,经超速离心机30 000 r/min离心30min后,用PBS重悬病毒沉淀,得到纯化慢病毒载体.纯化后慢病毒PBS稀释液滴度测定结果如图2B.滴度测定结果显示,包装出的LV-3shRNA慢病毒载体滴度大约为1×108TU/mL.

图2 慢病毒包装(A)及滴度测定(B)结果Fig.2 Lentivirus package(A)and titre detection(B)
用未纯化的慢病毒原液感染BHK-21细胞,经流式细胞分选后,阳性细胞率接近100%(图3).收集部分转基因细胞BHK-LV,提取总RNA,应用茎-环法进行实时定量PCR.定量PCR结果显示,3个针对FMDV的shRNA在BHK-LV细胞中均有表达,而在普通BHK-21细胞中几乎没有表达.比较3个shRNA的相对表达量,发现Cons1相对表达量最高,而Cons3的表达量相对最低(图4).

图3 荧光显微镜下观察转基因细胞BHK-LV(200×)Fig.3 The transgenic cells BHK-LV under fluorescence microscope(200×)
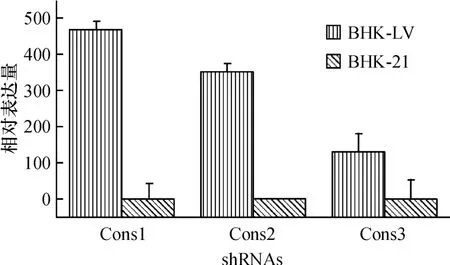
图4 转基因细胞BHK-LV中3个shRNA表达量Fig.4 The bar graph of the expression of3 shRNAs in the transgenic cells BHK-LV
2.3 FMDV在转基因细胞内的复制情况
根据10倍梯度稀释后标准品所得的Ct值和拷贝数计算出标准曲线及回归方程,y=-3.416x+ 42.850,R2值为0.998,并且计算出引物的扩增效率为96%.
用O型口蹄疫病毒HKN/2002感染转基因细胞BHK-LV,分别在1、6、12、18、24、36和48 h等7个时间点收集细胞及上清液,提取RNA进行实时定量PCR,以测定病毒RNA拷贝数.用线性图(图5)表示等量的FMDV病毒在转基因细胞和普通细胞中复制情况.结果显示,接107TCID50O型FMDV强毒后6 h时,图5中复制曲线上2种细胞病毒RNA拷贝数几乎没有差别,因此这一时间点可视为shRNA作用导致病毒复制差异的起始点,此时,2种细胞的病毒RNA拷贝数均达到约1.50×107.在接毒后12 h时转基因细胞BHK-LV中病毒拷贝数明显低于普通细胞BHK-21中的病毒.而24 h时转基因细胞BHK-LV中的病毒量减少到普通细胞BHK-21中的约1/3,直到48 h时转基因细胞仍表现出一定的抑制效果.
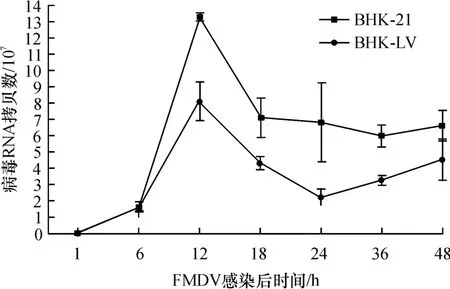
图5 FMDV在转基因细胞BHK-LV中的复制曲线Fig.5 The application curve of FMDV in transgenic cells BHKLV
2.4 慢病毒LV-3shRNA处理乳鼠的抗FMDV感染力
预试验接种后72 h观察结果显示,稀释度105~107组的昆明小鼠均无存活,而稀释度108组有2/4的小鼠存活,4组的阴性对照小鼠均正常存活,故确定该批次FMDV的LD50为108稀释度.
将纯化后的LV-3shRNA经PBS稀释,颈后皮下注射0.2 mL试验乳鼠(LV-3shRNA组)及PBS处理的阴性对照乳鼠,72 h后均分别以不同滴度的O型FMDV攻毒,观察乳鼠在各时间点发病、濒死或死亡的情况.检测结果显示,接毒后72 h内NC组在5 LD50滴度下有2只乳鼠发病死亡,在20 LD50滴度下无乳鼠存活;而LV-3shRNA组在5 LD50滴度下没有乳鼠发病死亡,在20 LD50滴度下仍有3只乳鼠存活至第7天;此外LV-3shRNA组在1 000、100、20和5 LD50滴度攻击时,其死亡乳鼠的存活时间相比NC组均有所延长(图6).在各滴度内随机选取1只乳鼠解剖,取等质量胴体提取RNA,对3D基因定量检测结果显示,在1 000和100 LD50滴度内,LV-3shRNA组样品中病毒含量的log10值分别为8.1和7.4,而阴性对照组样品同滴度测定数值分别为8.1和7.5,两组数值无显著差别.而LV-3shRNA组20和5 LD50滴度内存活乳鼠的胴体样品中,病毒含量的log10值分别为5.4和4.6,这明显低于阴性对照组中死亡乳鼠样品中的数值6.9和6.7(图6).
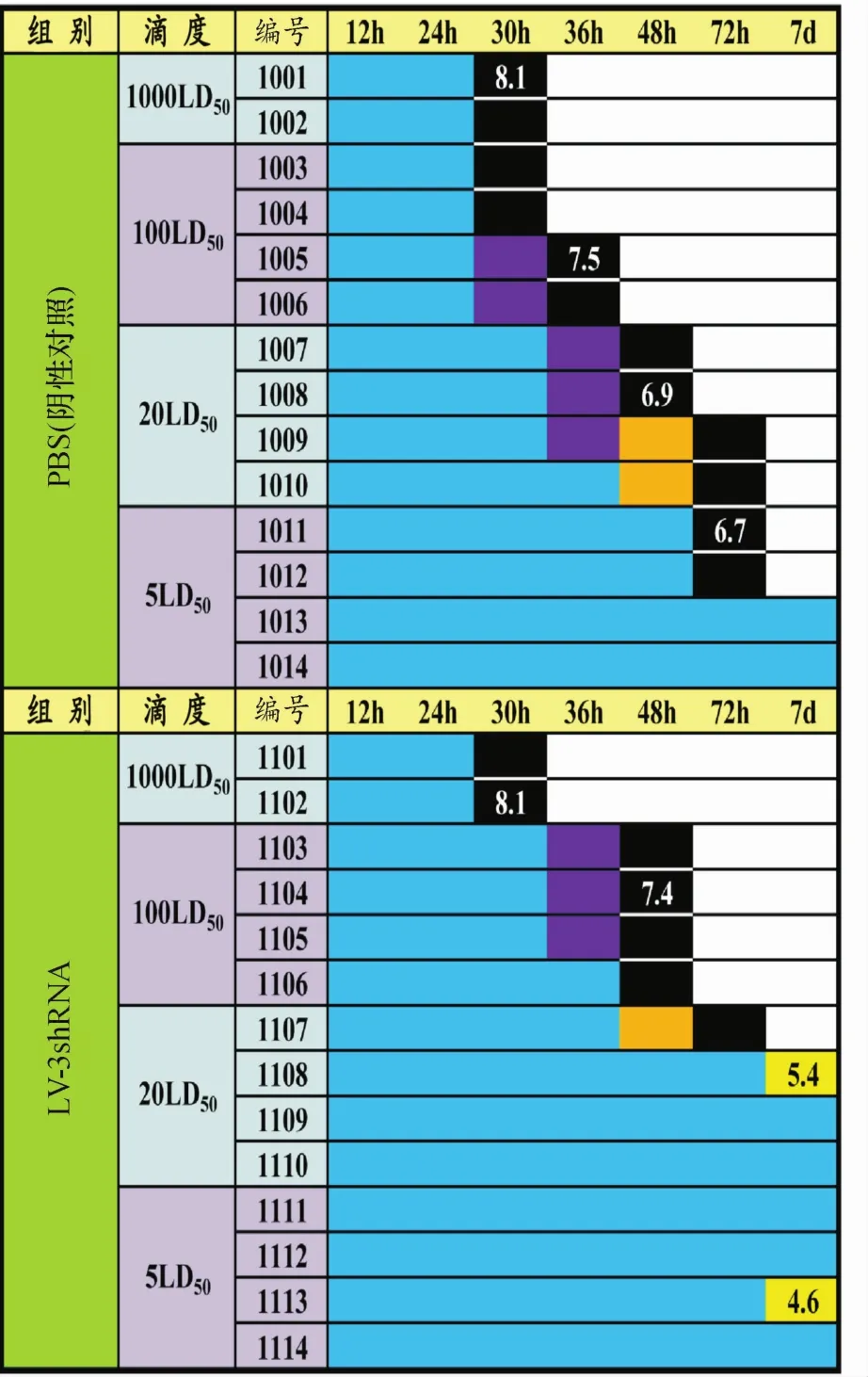
图6 慢病毒处理乳鼠抵抗FMDV能力检测Fig.6 The detection of Anti-FMDV ability of lentivirus-treated suckingmice
3 讨论
本研究借鉴Kahana等[1]研究,设计了3个shRNA,并用新克隆的水牛RNA聚合酶III启动子来引导,希望整合这些基因后,能在细胞内转录出高效siRNA,以达到提高细胞甚至动物对FMDV的抵抗力.此外笔者设计了多个shRNA串联表达的结构,并分别用不同的启动子引导,使转入的载体能同时表达多个shRNA,而每个shRNA表达的效率与单个shRNA表达载体的效率无显著差别[11].这样的结构一方面避免了多次转染以及多次慢病毒包装带来的不便和对细胞或动物带来的不必要的损伤;另一方面这样的针对多个位点的shRNA表达,能有效地降低病毒逃逸的几率[11].本研究利用第3代慢病毒载体3质粒系统,构建多个抗口蹄疫shRNA表达慢病毒载体.慢病毒载体因其转染效率、整合效率高,且既可转染处于有丝分裂活跃期的细胞,又可转染分裂缓慢及处于分裂终末期的细胞,受到科学家们的青睐,成为体内和体外基因转移的一种有效方便的工具.由于BHK-21是公认的FMDV感染试验模型,本研究选择BHK-21制备转基因细胞.通过检测转基因细胞中3个shRNA的表达量,确保该多个抗口蹄疫shRNA表达载体的有效性,以保证抑制FMDV复制试验的可行性和真实性.RNAi的作用时间短和病毒的抑制效率低一直是RNAi用于病毒防治上的一个挑战[14].在2004年Chen等[15]报道中,构建了针对FMDV的1D基因的shRNA表达载体,在BHK-21中没有产生对FMDV完全抑制的效果.同样,科学家们在IBR-2细胞中转染针对2B基因的shRNA表达载体[3],以及在BHK-21中直接转染化学合成或通过Cocktail试剂盒合成的siRNA,所得结果也是相似的[2,4].在本研究中,用高滴度的慢病毒载体作为转基因细胞的介导表达载体,是为了更高效地获得转基因细胞.在转基因细胞BHK-LV抑制病毒复制试验中,为了证明转基因细胞抑制FMDV的能力,本研究对普通和转基因细胞接种107TCID50O型FMDV(HKN/2002),这个剂量是常规检测剂量的104倍[2,15-17].通过观察试验结果,在高滴度FMDV感染下,转基因细胞具有的稳定持续表达shRNA并能有效减少2/3的病毒量,达到超过50%的抑制率,从功能上证明这个多抗口蹄疫shRNA在慢病毒载体中得以有效表达.
在细胞水平上验证抗口蹄疫慢病毒载体对FMDV的抑制能力后,本试验进一步在3~5日龄的小鼠中验证多shRNA表达慢病毒载体抵御FMDV的能力.之前的相关报道中,人们曾用单一针对口蹄疫病毒shRNA的表达质粒以及腺病毒载体注射入小鼠[18]、豚鼠或仔猪[17]体内,之后接种FMDV,通过观察动物的发病率或死亡率发现,在乳鼠5 LD50(半数致死量)以及豚鼠和猪的50 ID50(半数传染量)内载体对动物有一定保护效果,而FMDV高滴度下均对动物无保护效果.本试验通过超速离心,获得高度纯化的多个抗口蹄疫shRNA表达慢病毒颗粒,以确保其在动物体中的转染效率.预处理慢病毒载体的乳鼠在5 LD50的滴度下均得到存活,而且在20 LD50的滴度下死亡率仅为1/4.这样的试验结果优于之前的相关报道[17-18],进一步证明多个shRNA表达慢病毒载体在动物体内抗病毒作用比单个shRNA表达质粒或腺病毒载体明显.
预处理LV-3shRNA的乳鼠能成功获得较强的FMDV抗性,从一定程度上证明了慢病毒载体的免疫注射对于病毒病的防治是有效的,这为进一步探讨多个shRNA串联表达抗口蹄疫慢病毒载体介导的基因治疗在偶蹄类家畜中的应用提供了试验依据,也为通过转基因方法改良家畜品种、提高抗病能力这一途径奠定了基础.
[1] KAHANA R,KUZNETZOVA L,ROGEL A,et al.Inhibition of foot-and-mouth disease virus replication by small interfering RNA[J].J Gen Virol,2004,85(Pt 11):3213-3217.
[2] LIU Mingqiu,CHENWeizao,NIZheng,et al.Cross-inhibition to heterologous foot-and-mouth disease virus infection induced by RNA interference targeting the conserved regions of viral genome[J].Virology,2005,336(1):51-59.
[3] DE LOSSANTOST,WU Qiaohua,DE AVILA BOTTON S,et al.Short hairpin RNA targeted to the highly conserved 2B nonstructural protein coding region inhibits replication ofmultiple serotypes of foot-and-mouth disease virus[J].Virology,2005,335(2):222-231.
[4] MOHAPATRA JK,SANYAL A,HEMADRID,et al.E-valuation of in vitro inhibitory potential of small interfering RNAs directed against various regions of foot-and-mouth disease virus genome[J].Biochem Biophys Res Commun,2005,329(3):1133-1138.
[5] DASA T,BRUMMELKAMP T R,WESTERHOUT E M,et al.Human immunodeficiency virus type 1 escapes from RNA interference-mediated inhibition[J].JVirol,2004,78(5):2601-2605.
[6] GITLIN L,STONE J K,ANDINO R.Poliovirus escape from RNA interference:Short interfering RNA-target recognition and implications for therapeutic approaches[J].J Virol,2005,79(2):1027-1035.
[7] CHANG L J,LIU X,HE J.Lentiviral siRNAs targeting multiple highly conserved RNA sequences ofhuman immunodeficiency virus type 1[J].Gene Ther,2005,12(14):1133-1144.
[8] DAVE R S,POMERANTZR J.Antiviral effects of human immunodeficiency virus type 1-specific small interfering RNAs against targets conserved in select neurotropic viral strains[J].JVirol,2004,78(24):13687-13696.
[9] GEISBERT TW,HENSLEY L E,KAGAN E,etal.Postexposure protection of guinea pigs against a lethal ebola virus challenge is conferred by RNA interference[J].J Infect Dis,2006,193(12):1650-1657.
[10]SONG Erwei,LEE SK,WANG Jie,et al.RNA interference targeting fas protects mice from fulminant hepatitis[J].Nat Med,2003,9(3):347-351.
[11]TER BRAKEO,′THOOFT K,LIU Y P,etal.Lentiviral vector design for multiple shRNA expression and durable HIV-1 inhibition[J].Mol Ther,2008,16(3):557-564.
[12]SHAW A E,REID SM,EBERT K,et al.Implementation of a one-step real-time RT-PCR protocol for diagnosis of foot-and-mouth disease[J].J Virol Methods,2007,143(1):81-85.
[13]LU Zengjun,CAO Yimei,GUO Jianhong,et al.Development and validation of a 3ABC indirect ELISA for differentiation of foot-and-mouth disease virus infected from vaccinated animals[J].VetMicrobiol,2007,125(1/2):157-169.
[14]BAYRY J,TOUGH D F.Is RNA interference feasible for the control of foot-and-mouth disease outbreaks?[J]. Trends Immunol,2005,26(5):238-241.
[15]CHENW,YANWeiyao,DU Qingyun,et al.RNA interference targeting VP1 inhibits foot-and-mouth disease virus replication in BHK-21 cells and sucklingmice[J].JVirol,2004,78(13):6900-6907.
[16]LUO Jihuai,DU Junzheng,GAO Shandian,et al.Lentviral-mediated RNAi to inhibit target gene expression of the porcine integrin alphav subunit,the FMDV receptor,and against FMDV infection in PK-15 cells[J].Virol J,2011,8:428.
[17]CHENWeizao,LIU Mingqiu,JIAO Ye,et al.Adenovirus-mediated RNA interference against foot-and-mouth disease virus infection both in vitro and in vivo[J].JVirol,2006,80(7):3559-3566.
[18] WANG Pengyan,REN Yan,GUO Zhiru,et al.Inhibition of foot-and-mouth disease virus replication in vitro and in vivo by small interfering RNA[J].Virol J,2008,5:86.
【责任编辑柴 焰】
Construction of lentivirus-mediated multi-shRNAs vector and evaluation of anti-FMDV in vitro and vivo
ZHANG Xiaoxi1,LILanyu1,LIU Qingyou1,ZHENG Haixue2,LIXiangping1,CUIKuiqing1,SHIDeshun1
(1 College of Animal Sciences and Technology,Guangxi University,Nanning 530005,China;2 Lanzhou Veterinary Research Institute,Chinese Academy of Agricultural Sciences,Lanzhou 730046,China)
【Objective】The study was conducted to investigate the inhibit replication of foot-and-mouth disease virus(FMDV)bymulti-shRNAs expression.【Method】Three shRNAswere designed and chemically synthesized according to the conservative area in 3B and 3D regions of FMDV;induced by three different promoters respectively,they were constructed into a multi-shRNAs expressing lentiviral plasmid. The anti-FMDV multi-shRNAs expressing lentiviral particles were packaged by co-transfecting the three plasmid lentivirus packaging system into 293T cells.Infected FMDV into lentivirus-treated cells and sucklingmice,inhibitions of FMDV were observed.【Result and conclusion】Results showed that transgenic BHK-21 cells were obtained by infecting lentivirus.The expression of shRNAs in transgenic cells was detected by stem-loop RT-PCR.Inoculated with FMDV type O,the transgenic cells were proven to have an obvious inhibition to FMDV replication,which could reduce virus growth by three folds(24 h post-infection).After infection of FMDV type O strain into 3-5 days sucklingmice,nomousemortalitywas observed under 5 LD50titer,and survival time of the dead mice extended compared with negative control under 20 LD50titer.Based on the above results,it can be concluded that the anti-FMDV multishRNAs expressing lentiviral vector can improve FMDV resistance of BHK-21 cells and sucklingmice.
foot-and-mouth disease virus;multi-shRNAs;lentiviral vector;anti-virus
S813.3
A
1001-411X(2014)04-0001-06
2013-02-21优先出版时间:2014-06-03
优先出版网址:http:∥www.cnki.net/kcms/doi/10.7671/j.issn.1001-411X.2014.04.001.html
张晓溪(1985—),男,博士,E-mail:xiaoxizhang527@gmail.com;通信作者:刘庆友(1976—),男,研究员,博士,E-mail:qyliu2002@126.com;石德顺(1962—),男,研究员,博士,E-mail:ardsshi@gxu.edu.cn
国家高技术研究发展计划(863)项目(2011AA100607);国家自然科学基金(31260552)
张晓溪,李兰玉,刘庆友,等.慢病毒介导多短发卡RNA串联载体构建与体内外抗口蹄疫效果评估[J].华南农业大学学报,2014,35(4):1-6.

