耐铝根瘤菌的筛选及耐性菌株特性的研究
李秀平,王瑞鹏,年 海,牟英辉
(1国家大豆品种改良中心广东分中心/华南农业大学农学院,广东广州 510642;2广东农工商职业技术学院,广东广州 510507)
耐铝根瘤菌的筛选及耐性菌株特性的研究
李秀平1,2,王瑞鹏1,年 海1,牟英辉1
(1国家大豆品种改良中心广东分中心/华南农业大学农学院,广东广州 510642;2广东农工商职业技术学院,广东广州 510507)
【目的】对我国南方地区的野生大豆根瘤菌进行耐铝的筛选,以期建立一套耐铝根瘤菌筛选和鉴定体系,为南方大豆区接种高效耐铝菌株奠定基础.【方法】利用菌株活化培养法分离来自湖南各县和广州地区酸性土壤中的野生大豆根瘤菌株,通过分光光度计进行耐铝检测,研究耐性菌株的生长特性以及接种后对栽培大豆的生长和结瘤的影响.【结果和结论】菌株W20能在铝浓度为200μmol·L-1的培养基上正常生长,而其他菌株的生长则受到较大抑制.菌株W20的最适生长酸度为pH 6.0,致死酸度为pH 4.0.通过质子通量试验发现,W20的细胞膜能阻止过量的H+进入细胞.在Al3+浓度为200μmol·L-1时,华夏3号接种W20菌株后地上和地下部分生物量分别比对照增加了60.9%和14.8%;瘤数和瘤质量分别提高了66%和209%;地上和地下部分铵态氮含量分别比对照高25.7%和9.4%.
根瘤菌;酸铝胁迫;质子通量;铵态氮含量
我国南方酸性土壤的总面积为2.03×107hm2,约占全国土地面积的21%[1].化肥的大量施用以及酸雨的侵蚀,加剧了土壤酸化的过程[2].酸性土壤中,Al3+的毒害作用最为明显.研究发现我国南方酸铝土壤中大豆土著菌的数量都处于一个较低的水平,铝通过作用于细胞影响微生物的物质和能量代谢,抑制微生物的生长和发育[3-4].细胞膜是Al3+的作用位点,但其结合与毒害的作用方式目前还没有定论[5-6].Al3+可以通过影响细胞膜的流动性而发挥其毒害作用[7].Al3+能引起敏感菌细胞膜中低有序质膜区含量降低;在Al3+诱导条件下,抗性细菌细胞膜中低有序质膜区含量增加,增强了细胞膜流动性[8-9].Zheng等[10]研究发现将真菌酿酒酵母菌Saccharomycescerevisiae暴露于高浓度铝的条件下,可通过活性氧类物质(ROS)激活细胞程序性死亡(PCD)诱导细胞死亡[11].酸铝对慢生根瘤菌在培养基中生长的限制作用更为明显.
Wood和Cooper[12]研究表明,当pH为5.5时,三叶草根瘤菌的2株菌HP3和BEL1192增殖速率相同;pH 4.5时BEL1192增殖缓慢;pH小于4.5时,菌株HP3基本不长.在pH为4.5的液体培养基中,Al3+浓度达到50μmol·L-1时,BEL1192菌体数量急剧下降,而pH 5.5时50μmol·L-1的Al3+就使HP3的菌体数量急剧下降.50μmol·L-1的Al3+对菌株HP3对数生长期的毒害作用比延滞期大[12]. Johnson等[13]的研究结果表明,适当浓度的Al3+能刺激敏感菌株DNA的合成,抗性菌株DNA的合成几乎不受Al3+的影响.野生大豆作为栽培大豆的祖先,其基因型的多样性与抗逆能力均好于栽培大豆,接种根瘤菌后对作物的生物量和固氮能力都有明显的提高[14].本研究通过对野生大豆根瘤菌进行耐酸铝筛选,筛选出耐性菌株,并对酸铝胁迫下菌株的生长特性和接种后的效果进行分析,为南方大豆生产提供有利条件奠定基础.
1 材料与方法
1.1 供试材料
大豆Glycinemax品种为华夏3号.菌株W3、W11、W20、W23来自湖南各县酸性土壤中的野生大豆根瘤,Cl分离自广州地区酸性土壤中的栽培大豆根瘤,C2分离自广州地区含镉土壤中的栽培大豆根瘤,C5为模式菌株USDA110,W14为铝敏感菌株,分离自湖南龙秀.菌株活化培养采用YMA(Yeastmannitol agar)培养基.
1.2 菌株的耐酸铝筛选
菌株活化培养后,分别接种于铝浓度为0(对照)、25、50、100、200μmol·L-1的YMA液体培养基中(pH 4.5、V为10 mL),置恒温振荡器中(28±1)℃、180 r·min-1振荡培养,3 d后分光光度计测量D600nm(用UV-MINI-1240 220VE型岛津紫外分光光度计测定).每个处理3个重复,并记录pH.
1.3 致死pH和质子通量测定
致死pH:将耐性菌株W20分别转接到pH为3.0、4.0、4.5、5.0、6.0和7.0的YMA液体培养基中,培养和测定方法同1.2,记录pH.
质子通量:将待测菌种在中性培养液中振荡培养至指数期中期,经离心、洗涤收集活细胞1~3 g(湿质量),转入50 mL 0.1 mol·L-1的KCl溶液中制成菌悬液,水浴中保温[(28±1)℃]并搅拌.用pH仪测定其酸度,待pH稳定2 min以上,迅速加入0.05 mol·L-1的HCl,将pH调至4.0±0.1,并在15 min之内每30 s记录1次pH,重复3次.同样,将中性培养液培养至指数期中期的2种菌悬液经离心、洗涤收集活细胞1~3 g,转入pH 5.2的培养液中振荡培养1 h,然后重复上述冲击方法并测定pH变化,计算质子通量.
1.4 回接试验
大豆种子处理:挑选籽粒饱满的大豆种子数粒,先在φ为95%的乙醇溶液中处理3 min,取出后用无菌水冲洗5~6次,放入φ为10%的H2O2溶液浸泡1 min,取出后用无菌水冲洗5~6次,然后埋于经120℃高温灭菌30 min的沙子中,保持一定的湿度,在28℃的培养箱中培养48 h.
菌液培养:用接种环在试管中挑1环根瘤菌到TY液体培养基中,用胶塞塞好后,放在摇床上培养至对数生长期(约3~4 d),培养温度为28℃.
水培箱的制备:将试验用的塑料桶洗净,并用φ为0.1%的HCl溶液浸泡24 h,用自来水冲洗2次,再用去离子水冲洗1次,晾干,每桶装入约5 mL营养液,并用过滤灭菌的AlCl3母液调配成试验所需的含铝营养液.
接种处理:将已催芽的种子放到培养皿中用菌液浸泡15 min,用灭菌棉花固定在带孔的泡沫板上.移苗后,将水培苗放在光照培养箱(光照度200 mol·m-2·s-1、光照时间12 h)中培养,生长期间定期补充营养液.
2 结果与分析
2.1 耐铝菌株的筛选
酸铝筛选的结果表明,200μmol·L-1Al3+的胁迫对多数菌株的生长有较为明显的抑制作用,抑制程度最大的菌株为W11与W23,其相对生长量分别为15.6%与12.8%,其余菌株的生长在该浓度下也受到不同程度的抑制,仅有菌株W20的生长情况较好,在200μmol·L-1高铝浓度胁迫下其生长量仍能达到对照(无Al3+处理)的90%,说明菌株W20耐铝毒的能力要强于其他菌株(表1).菌株W20的pH随铝浓度的增加变化幅度小于其他菌株,除100 μmol·L-1Al3+处理外,在其他浓度的铝处理下,菌株W20培养基的pH都显著高于其他培养基,接近中性值(表2).

表1 不同浓度铝处理下各菌株的相对生长量1)Tab.1 Relative grow th quantity of strains under different Al3+concentrations %
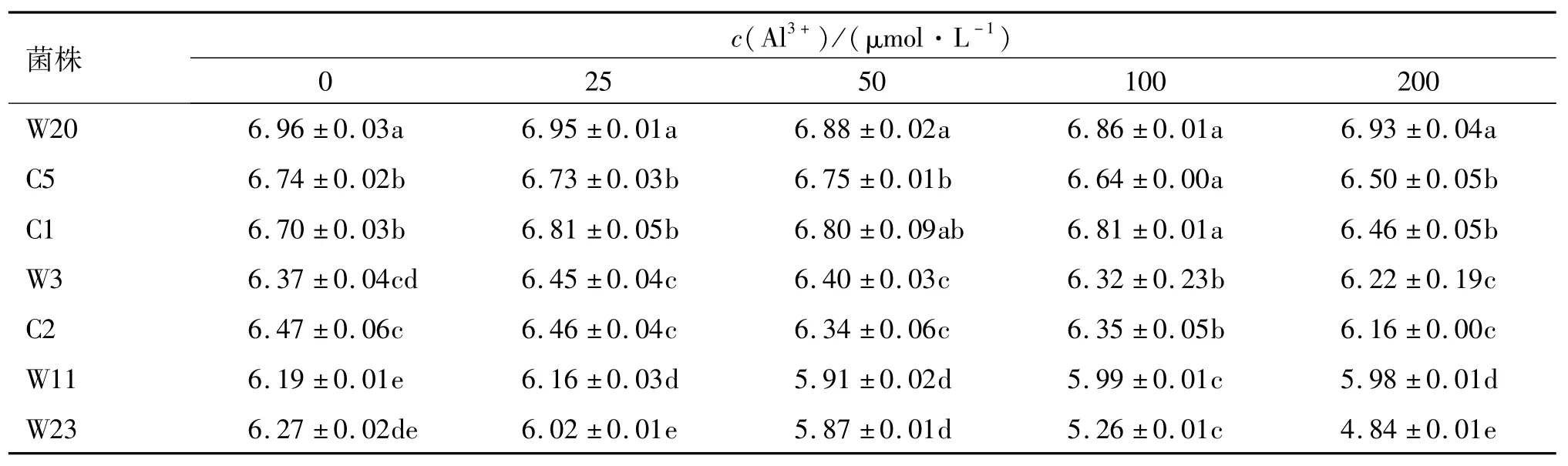
表2 不同浓度铝处理下各菌株培养基的pH 1)Tab.2 pH values of strain medium s under different Al3+concentrations
2.2 致死pH的测定
pH为4.0、4.5、5.0、6.0和7.0时菌株W20的D600nm分别为0.01、1.06、1.41、1.67和1.56.在pH≤4.0时,菌株W20的D600nm几乎不变,说明在该酸度下菌株停止生长,其致死pH为4.0;在pH≥4.5时,菌株W20均能正常生长,且D600nm>1.0;当pH≥6.0,菌悬液的D600nm>1.5,同时,菌株W20在pH为6.0环境中的生长情况要好于在7.0的情况下.
2.3 铝毒对菌株生长的影响
图1所示,在48 h之内菌株W20生长缓慢,处理与对照之间没有明显差别,54 h以后,Al3+的毒害作用开始显现,对照组的生长速度高于处理组.在浓度为100μmol·L-1的Al3+处理下,菌株的生长速度差异不大,受铝毒影响差别不明显.当Al3+达到200 μmol·L-1时,菌株的生长受到影响,66 h后,毒害作用明显加强.
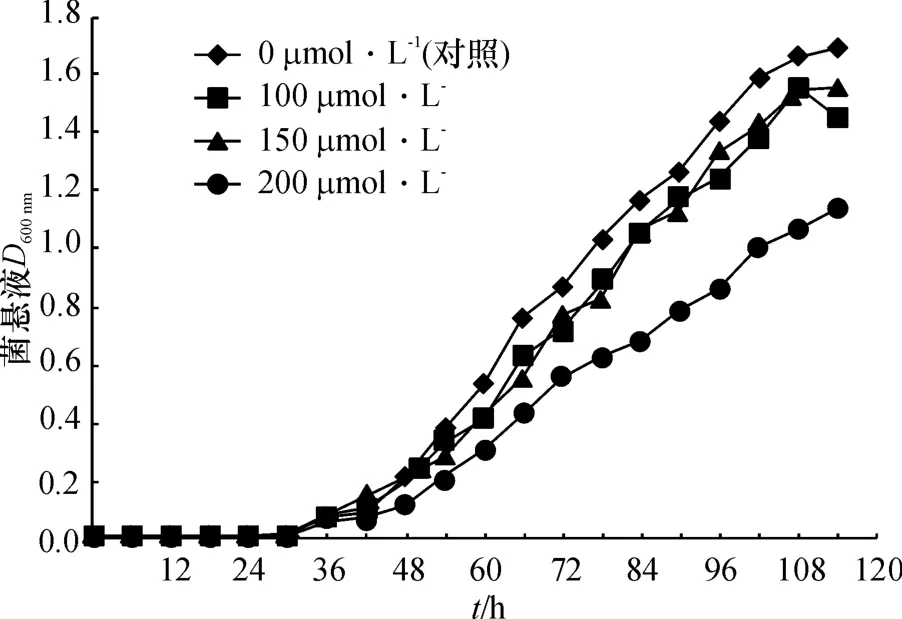
图1 W20在不同铝浓度下的生长曲线Fig.1 Growth curves ofW20 under different Al3+concentrations
2.4 耐性菌株W 20与敏感菌株W 14质子通量的变化
未经酸处理的菌株W14质子通量在6 min达到最大值3.20 nmol·mg-1·min-1,经过酸处理后其最大峰值为2.86 nmol·mg-1·min-1,出现在5 min,并且在其后的时间段,质子通量几乎均小于未经处理的菌株.经诱导和不诱导处理的W20菌株细胞的质子通量在大部分时段内几乎为0,W20耐酸菌株对酸诱导并不敏感(图2).
2.5 铝毒对大豆生物量的影响
在Al3+浓度为200μmol·L-1时,华夏3号接种根瘤菌的地上部分生物量比未接种菌株的均降低;接种根瘤菌后,生物量的积累要高于对照.接种W20的植株在无Al3+条件下以及200μmol·L-1Al3+胁迫下,其生物量均高于接种其他菌株的植株,在Al3+浓度为200μmol·L-1时,接种W20的植株生物量比CK增加了60.9%(图3A).在无Al3+条件下,华夏3号地下部分的生物量接菌处理的均要高于对照.接种W20的植株地下部分的生物量在200μmol·L-1Al3+胁迫下比未接种植株的高14.8%;接种W14的植株地下部分的生物量在Al3+浓度为200μmol·L-1时,比对照低8.7%(图3B).

图2 酸处理和未经酸处理的菌株W20与W14的质子通量Fig.2 Proton flux accumulation variation ofW20 and W14 under acid and no acid treatments
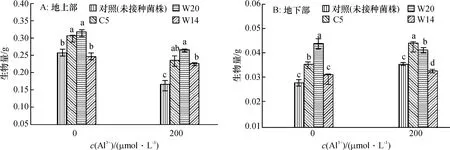
图3 铝处理后接种根瘤菌对华夏3号生物量的影响Fig.3 Effects of rhizobium on biomass of Huaxia3 under Al3+treatment
2.6 铝毒对大豆结瘤的影响
在无Al3+和铝胁迫下,W20菌株处理的华夏3号的结瘤个数均高于其他菌株处理,在Al3+浓度为200μmol·L-1时,接种W20的结瘤数比对照增加了66%,瘤质量增加了209%.敏感菌株W14在Al3+浓度为200μmol·L-1时接种后结瘤数接近于对照,瘤质量比对照增加58%(图4).
2.7 铝毒对大豆中铵态氮含量的影响
接种C5、W20、W14菌后,华夏3号地上部分铵态氮的质量分数均高于对照,其中耐性菌株W20在Al3+浓度为200μmol·L-1时接种后的铵态氮质量分数比对照高25.7%.铝胁迫下地下部分铵态氮的质量分数普遍低于无Al3+条件,在Al3+浓度为200 μmol·L-1时,接种W20菌株后地下部的铵态氮质量分数比对照增加了9.4%(图5).
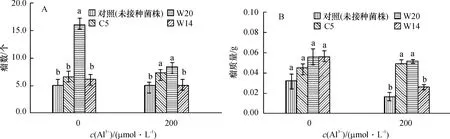
图4 铝处理后接种根瘤菌对华夏3号结瘤的影响Fig.4 Effects of rhizobium on nodulation of Huaxia3 under Al3+treatment

图5 铝处理后接种根瘤菌对华夏3号氮含量的影响Fig.5 Effects of rhizobiumoncontent of Huaxia3 under Al3+treatment
3 讨论与结论
本研究对实验室长期保存的7株根瘤菌的耐酸铝能力进行了研究,其中4株分离自野生大豆,3株分离自栽培大豆.研究结果表明,大部分的菌株都能在浓度0~200μmol·L-1的铝胁迫下生长,随着铝浓度的升高,菌株的生长受到抑制.在200μmol·L-1铝处理时,多数根瘤菌的生长量受到明显抑制,仅有W20的生长受到影响的程度较低,因此,我们筛选出具有耐铝特性的菌株W20.在酸性条件下(pH<5),铝主要以A13+的形式存在,这种形态的铝对生物的危害最为明显.Illmer和Schinner[15]认为Al3+和ATP形成稳定的复合物,并且抑制了细胞内的能量流动,尤其对质膜上的ATPase的影响尤为明显.本研究结果表明,Al3+对菌株的生长影响始于48 h,说明Al3+影响菌株W20的代谢活动.
在酸性条件下,细胞内的pH下降程度越低,胞内的可溶性铝含量也会降低,可溶性铝与核酸的磷酸基团相结合被抑制,进而影响细胞的分裂[16].有研究表明耐酸与耐铝特性可能存在一定的相关性,在耐酸的根瘤菌资源中,可能存在耐铝性强的菌株[17-20].本研究结果表明,菌株W20经过酸诱导后具有较强的抵御H+的能力,而菌株W14在经过酸诱导后对H+的抵御能力明显地降低,这可能是因为细胞膜在受到酸处理后抗拒H+能力不同引起的.在酸性200μmol·L-1铝胁迫条件下接种菌株W20明显地提高了华夏3号大豆地上部、地下部的生物量,增加了结瘤数量,促进了植株体内氮的含量.本研究通过对野生大豆根瘤菌进行耐酸铝筛选,筛选出耐性菌株W20,并对其在酸铝胁迫下的菌株生长特性和接种后的效果进行了分析,为华南酸铝性红壤地区种植大豆高产技术提供了理论基础和试验依据.
[1] 赵其国.中国东部红壤地区土壤退化的时空变化、机理及调控[M].北京:科学出版社,2002:70-280.
[2] 曾希柏.红壤酸化及其防治[J].土壤通报,2000(3):111-113.
[3] 程凤娴,曹桂芹,王秀荣,等.华南酸性低磷土壤中大豆根瘤菌高效株系的发现及应用[J].科学通报,2008(23):2903-2910.
[4] 罗义勇,刘卫红,严金平.微生物铝毒害和耐铝毒机制研究进展[J].生命科学,2011(4):414-419.
[5] ILLMER P,ERLEBACH C.Influence of Al on growth,cell size and content of intracellular water ofArthrobactersp.PI/1-95[J].Antonie Van Leeuwenhoek,2003,84(3):239-246.
[6] YAGANZA E S,RIOUX D,SIMARD M,et al.Ultrastructural alterations ofErwiniacarotovorasubsp.atrosepticacaused by treatmentwith aluminum chloride and sodium metabisulfite[J].Appl Environ Microbiol,2004,70(11):6800-6808.
[7] VIERSTRA R,HAUGA.The effectof A13+on the physical properties of membrane lipids inThermoplasmaacidophilum[J].Biochem Biophys Res Commun,1978,84(1):138-143.
[8] VAN DERZEL JM.Ceramic-fused-to-metal restorations with a new CAD/CAM system[J].Quintessence Int,1993,24(11):769-778.
[9] 李朝苏,刘鹏,蔡妙珍,等.荞麦对酸铝胁迫生理响应的研究[J].水土保持学报,2005,19(3):105-106.
[10]ZHENG K,PAN JW,Ye L,et al.Programmed cell death-involved aluminum toxicity in yeastalleviated by antiapoptotic members with decreased calcium signals[J]. Plant Physiol,2007,143(1):38-49.
[11]KEYSER H H,MUNNSD N.Effects of calcium,manganese and alumininm on growth of rhizobia in acid media[J].Soil Sci Soc Am J,1979,43:500-503.
[12]WOOD M,COOPER JE.Acidity,aluminum and multiplication of rhizobium trifolii:Effects of initial inoculum density and growth phase[J].Soil Biol Biochem,1988,20:83-87.
[13]JOHNSON A C,WOOD M.DNA,a possible site of action of aluminum inRhizobiumsspp.[J].Appl Environ Microbiol,1990,56(12):3629-3633.
[14]史晓霞,师尚礼,杨晶.豆科植物根瘤菌分类研究进展[J].草原与草坪,2006(1):12-17.
[15]ILLMER P I,SCHINNER F S.Influence of aluminum on motility and swarming ofPseudomonassp.andArthrobactersp.[J].FEMSMicrobiol Lett,1997,155(1):121-124.
[16]WOOD M.A mechanism of aluminium toxicity to soil bacteria and possible ecological implications[J].Plant and Soil,1995,171(1):63-69.
[17]辜建平,张磊,魏世清,等.一株耐酸野生葛藤(Pueraria lobata)根瘤菌的筛选与耐酸机理初步研究[J].微生物学报,2006,46(4):653-656.
[18]陈淑珍.酸铝对大豆-根瘤菌共生固氮体系影响研究[D].广州:华南农业大学,2008.
[19]徐开未,张小平,陈远学,等.钼与花生根瘤菌的复配及在酸性紫色土上的接种效果[J].植物营养与肥料学报,2005,11(6):816-821.
[20]陈远学,徐开未,张小平,等.花生根瘤菌对微量元素耐性的筛选[J].中国土壤与肥料,2007(4):76-79.
【责任编辑周志红】
Screening for Al-tolerant rhizobium and a study on its characters
LIXiuping1,2,WANG Ruipeng1,NIAN Hai1,MU Yinghui1
(1 Guangdong Sub-center of National Soybean Improvement Center/College of Agriculture,South China Agriculture University,Guangzhou 510642,China;2 Guangdong AIB Polytechnic College,Guangzhou 510507,China)
【Objective】The resistant aluminium strains of wild soybean rhizobia in Southern China were screened to set up a system of isolating and identifying aluminum-tolerant rhizobium,and to establish the foundation of effective inoculant for soybean planting areas in South China.【Method】The nodules of wild soybean which grew in Hunan Province and Guangzhou areawere isolated by using technique of strains activated culturemethod.The tolerance of aluminum was detected by spectrophotometer.The growth characteristics of aluminum-tolerant rhizobium were analyzed using themethod of inoculation.The effects on growth and nodulation of the cultivated-soybean were explored by inoculatingwith aluminum-tolerant strains.【Result and conclusion】The results showed that the isolated rhizobium could grow with 200μmol·L-1Al3+distinct from the other strains,showing some special features of tolerance to aluminum.The boundary pH thatW20 could not survive was 4.0,while the favorite pH was 6.0.In the Proton flux assay,W20 had the ability to preventmore H+from penetrating the cytomembrane than W14,which could makeW20 avoid some damage caused by H+.Inoculating with the effective rhizobium could significantly increase soybean biomass,nodulation,N content and reduce the content of Al3+with aluminum addition.The shoot and root biomass of soybean increased by 60.9%and 14.8%respectively,while the nodule num-ber and nodule weight increased by 66%and 209%with the rhizobium ofW20 strain inoculants at 200 μmol·L-1Al3+,respectively.Meanwhile NH4-N content of shoot and root was stimulated by 25.7% and 9.4%respectively.
rhizobium;acid and aluminum-tolerant;proton flux assay;NH4-N content
S565.1
A
1001-411X(2014)04-0050-06
2014-01-06优先出版时间:2014-06-03
优先出版网址:http:∥www.cnki.net/kcms/doi/10.7671/j.issn.1001-411X.2014.04.010.html
李秀平(1971—),女,讲师,博士,E-mail:lxpyx2008@163.com;通信作者:牟英辉(1975—),男,副教授,博士,E-mail:youhymoon@scau.edu.cn
国家自然科学基金(31371642,31171508);亚热带农业生物资源保护与利用国家重点实验室开放课题(SKL-CUSA-2013-08)
李秀平,王瑞鹏,年 海,等.耐铝根瘤菌的筛选及耐性菌株特性的研究[J].华南农业大学学报,2014,35(4):50-55.

